Renata H. Bahous
1 Departamente de genetică umană și pediatrie, Institutul de cercetare al Centrului de sănătate al Universității McGill, Montreal, Quebec, Canada
Nafisa M. Jadavji
2 Departamentul de Neuroștiințe, Universitatea Carleton, Ottawa, Ontario, Canada
Liyuan Deng
1 Departamente de genetică umană și pediatrie, Institutul de cercetare al Centrului de sănătate al Universității McGill, Montreal, Quebec, Canada
Marta Cosín-Tomás
3 Unitatea de farmacologie, Facultatea de Farmacie, Institutul de Neurociència Universitat de Barcelona (IBUB), Nucli Universitari de Pedralbes, Barcelona, Spania
Jessica Lu
1 Departamente de genetică umană și pediatrie, Institutul de cercetare al Centrului de sănătate al Universității McGill, Montreal, Quebec, Canada
Olga Malysheva
4 Divizia de Științe Nutriționale și Genomică, Universitatea Cornell, Ithaca, NY, SUA
Kit-Yi Leung
5 Programul de biologie a dezvoltării și cancer, Great Ormond Street Institute of Child Health, University College London, Londra, Regatul Unit
Ming-Kai Ho
6 Departamentul de Neurologie și Neurochirurgie, Universitatea McGill, Montreal, Quebec, Canada
Mercè Pallàs
3 Unitatea de farmacologie, Facultatea de Farmacie, Institutul de Neurociència Universitat de Barcelona (IBUB), Nucli Universitari de Pedralbes, Barcelona, Spania
Perla Kaliman
7 Institutul de Investigații Biomedice din Barcelona, Consiliul Național de Cercetare Spaniol, Barcelona, Spania
8 Center for Mind and Brain, Universitatea din California Davis, Davis, CA, SUA
Nicholas D.E. Greene
5 Programul de biologie a dezvoltării și cancer, Great Ormond Street Institute of Child Health, University College London, Londra, Regatul Unit
Barry J. Bedell
6 Departamentul de Neurologie și Neurochirurgie, Universitatea McGill, Montreal, Quebec, Canada
Marie A. Caudill
4 Divizia de Științe Nutriționale și Genomică, Universitatea Cornell, Ithaca, NY, SUA
Rima Rozen
1 Departamente de genetică umană și pediatrie, Institutul de cercetare al Centrului de sănătate al Universității McGill, Montreal, Quebec, Canada
Date asociate
Abstract
Introducere
Derivații de folat sunt critici pentru dezvoltarea creierului și sinteza neurotransmițătorilor, deoarece oferă unități cu un singur carbon pentru sinteza nucleotidelor și reacțiile de metilare (1). Una dintre cele mai studiate enzime din calea metabolică a folatului este metilenetetrahidrofolat reductaza (MTHFR, EC 1.5.1.20), o enzimă omniprezentă care generează 5-metiltetrahidrofolat (5-metilTHF) pentru remetilarea homocisteinei la metionină (2). Metionina este precursorul S-adenosilmetioninei (SAM), principalul donator de metil în majoritatea reacțiilor de metilare a mamiferelor. O cale alternativă independentă de folatul pentru sinteza metioninei este prezentă în principal în ficat și rinichi; folosește metabolitul colinei betaină ca donator de metil. Tulburările în metabolismul folatului pot fi genetice și/sau dietetice și deseori duc la tulburări compensatorii în metabolismul colinei. Colina este necesară pentru a sintetiza neurotransmițătorul acetilcolină și fosfolipidele critice pentru integritatea membranei (3,4).
Deficiențe severe relativ rare în polimorfismul MTHFR (de obicei T (A222V), este prezent în starea homozigotă în 10-15% din multe populații caucaziene și codifică o enzimă termolabilă cu o activitate reziduală de ± 30% (2). Acest SNP a fost raportat la creșterea studiului pentru defecte ale tubului neural, complicații ale sarcinii și boli neuropsihiatrice, cum ar fi schizofrenia și autismul (3,6-8). Pentru a studia aceste trăsături complexe, am dezvoltat modele de șoarece care imită aceste deficiențe MTHFR (9). Un model pentru homocistinurie, au insuficiență de memorie pe termen scurt, morfologie hipocampică alterată și tulburări ale metabolismului acetilcolinei (10). Deficitul de MTHFR heterocigot la baraje (șoareci Mthfr +/-) a avut ca rezultat afectarea memoriei la puilor.
Folatul nu poate fi sintetizat de oameni și trebuie obținut din dietă (12). Aportul scăzut de folat matern în timpul sarcinii este un factor de risc pentru defecte ale tubului neural și alte defecte congenitale, precum și alte complicații ale sarcinii, inclusiv restricție de creștere intrauterină (3). Aportul scăzut de folat matern a fost, de asemenea, asociat cu tulburări ale funcției creierului descendenților, deoarece creierul în curs de dezvoltare este sensibil la epuizarea nutrienților în timpul gestației și dezvoltării timpurii. Atât la oameni, cât și la rozătoare, deficitul de folat în timpul sarcinii a fost asociat cu tulburări cognitive, anxietate crescută și depresie (13,14). La șoareci, dietele cu deficit de folat matern sau cu deficiență de colină duc la creșterea apoptozei la nivelul creierului fetal, în special la hipocamp (11,15).
Într-un efort de sănătate publică pentru a reduce incidența defectelor tubului neural, boabele au fost fortificate cu acid folic în peste 50 de țări. Aportul zilnic recomandat pentru adulți este de 0,4 mg, cu un nivel maxim admisibil recomandat de 1 mg (16). Cu toate acestea, există grupuri în populație care consumă 4-5 mg/zi, în principal datorită utilizării crescute a suplimentelor de vitamine (17,18). Au apărut îngrijorări cu privire la posibilele consecințe ale aportului ridicat de acid folic; aceste preocupări includ creșterea crescută a tumorilor subclinice, posibilitatea de a masca deficiența de B12 și afectarea funcției imune (16,19). Am investigat rezultatele adverse potențiale ale aportului ridicat de acid folic la șoareci. Am constatat că șoarecii masculi adulți hrăniți cu o dietă suplimentată cu acid folic (FASD, 10 × cantitatea recomandată pentru rozătoare) timp de 6 luni au dezvoltat un deficit pseudo-MTHFR, cu leziuni hepatice (20).
Utilizarea suplimentelor de vitamine este deosebit de importantă pentru femeile aflate la vârsta fertilă, deși suplimentarea cu doze mari de acid folic ridică întrebări cu privire la posibilele efecte negative asupra descendenților lor, în special asupra dezvoltării creierului (21). Prin urmare, în acest studiu am urmărit să determinăm dacă aportul ridicat de acid folic matern la șoareci a afectat funcția creierului sau metabolismul la puii și embrionii lor. În acest scop, am hrănit șoareci femele de tip sălbatic cu o dietă de control (CD) sau FASD timp de 5 săptămâni înainte de împerechere și am menținut dietele pe tot parcursul sarcinii și alăptării, pentru a evalua dezvoltarea creierului la descendenți. Am constatat că descendenții mamelor hrănite cu FASD au avut întârziere de creștere intra-uterină, tulburări de memorie pe termen scurt și alterare a creierului. Este posibil ca deficitul pseudo-MTHFR matern și descendent cu tulburări ale metabolismului colinei/metilului să fi contribuit la aceste rezultate.
Rezultate
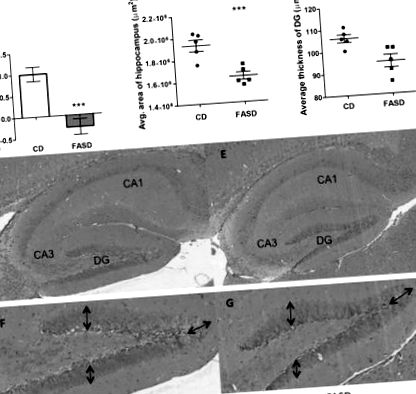
Puii de trei săptămâni născuți de mame FASD au avut tulburări de memorie pe termen scurt și au redus zona hipocampului
Puii FASD au redus expresia Dnmt3a
Embrionii și placentele mamelor FASD au fost mai mici la E17,5
Embrionii și placentele de la mamele FASD au fost mai mici la E17,5. Greutățile embrionilor și placentelor au fost măsurate la sacrificiu. (A) FASD a dus la o greutate corporală medie mai mică/așternut de embrioni. (B) A existat o tendință către greutăți/așternuturi placentare mai mici (#P = 0,08). Valorile sunt medii ± SEM de 6 l/grup; * P Fig. 7A; P Fig. 7B; P Fig. 7C; P = 0,08, test t nepereche). Această enzimă utilizează derivatul colinei betaină pentru sinteza metioninei și SAM. Enzimele cheie din sinteza și utilizarea SAM au fost, de asemenea, scăzute de FASD. Expresia metioninei adenosiltransferazei 1A (Mat1a) (Fig. 7D), enzima care sintetizează SAM din metionină și a Pemt (Fig. 7E), un consumator major de SAM pentru sinteza fosfatidilcolinei, a fost redusă (P Fig. 8A; P Fig. 8B; P = 0,06, test t nepereche) și PCho au scăzut semnificativ (Fig. 8C; P Fig. 9B și D) în comparație cu embrionii CD (Fig. 9A și C), iar celulele corticale par să fie mai dezvoltate datorită la forma lor alungită. Aceste observații sugerează rate diferite de dezvoltare corticală datorate dietei. De asemenea, am observat o grosime crescută a SVZ la embrionii FASD (Material suplimentar, Figura S3). Este necesară o experimentare suplimentară pentru a înțelege natura acestor diferențe de dezvoltare.
Alterarea dezvoltării creierului la embrioni de mame FASD. Secțiunile coronare ale creierului embrionar au fost colorate cu H & E. Imagini reprezentative de la embrioni în CD (A și C) și FASD (B și D) sunt reprezentate grupuri. Imaginile prezintă straturile corticale, zona intermediară (IZ) și zona subventriculară (SVZ). Straturile corticale de la embrioni FASD păreau a fi mai organizate și dezvoltate.
Mamele însărcinate la E17.5 au prezentat modificări relativ minore în metabolismul cu un singur carbon
La E17.5, hipocampul și straturile superioare ale cortexului se dezvoltă rapid (32) și disponibilitatea redusă a colinei poate avea consecințe negative asupra dezvoltării creierului embrionar. Dietele cu deficiență de colină materne la șoareci au dus la scăderea proliferării și la creșterea apoptozei la hipocamp (33) și la alterarea neurogenezei și a stratificării corticale, în special în neuronii născuți ulterior (34). Am examinat proliferarea în hipocamp și cortex la E17.5 folosind Ki67 (date neprezentate), dar nu am observat diferențe. Analize mai extinse ale markerilor în diferite momente de timp ar fi utile pentru a înțelege diferențele de dezvoltare.
Disponibilitatea redusă a colinei poate modula, de asemenea, expresia ADN-ului și a histonei metiltransferazelor (35,36). Am observat tulburări semnificative ale metaboliților colinei la embrionii FASD și am scăzut mARN-ul Dnmt3a atât în cortex cât și în hipocampus la puii FASD. Dnmt3a joacă un rol important în dezvoltarea creierului și în maturarea neuronală (37). Șoarecii cu un knockout condiționat de Dnmt3a au avut o performanță slabă în sarcinile de memorie, în special NOR (25). Scăderea expresiei Dnmt3a ar fi de așteptat să modifice metilarea ADN și, în consecință, expresia genelor care pot fi esențiale pentru dezvoltarea creierului. S-a demonstrat că aportul crescut de acid folic matern modifică metilarea și exprimarea genelor neurodezvoltării într-o manieră specifică sexului la puii nou-născuți (24,38). Diferențele în rata dezvoltării creierului în acest studiu pot fi legate de expresia modificată a Dnmt3a.
Greutatea medie a embrionilor pe litru a fost redusă în grupul FASD. Fenotipul observat amintește de restricția de creștere intrauterină observată în condiții de folat scăzut (39,40). Prin urmare, consumul ridicat de folat poate avea efecte negative similare cu cele observate cu folat scăzut, mai ales că folatul ridicat inhibă MTHFR, o enzimă folică critică și ar putea inhiba alte enzime sau transportori dependenți de folat.
Embrionii de la mame FASD au avut deficit pseudo-MTHFR cu tulburări semnificative în metabolismul folatului și colinei. Embrionul este un sistem care proliferează rapid și se dezvoltă cu cereri ridicate de nutrienți. Nu au existat modificări dramatice în metaboliții șoarecilor însărcinați. Aceste observații sugerează că, în acest stadiu de dezvoltare, metabolismul folicului embrionar și al colinei funcționează relativ independent de metabolismul matern.
Spre deosebire de femeile însărcinate, șoarecii FASD care alăptau au avut modificări mai accentuate din cauza dietei: proteine MTHFR reduse, tulburări semnificative ale metabolismului cu un singur carbon și nivelurile lor de Pemt au fost crescute în ficat, posibil pentru a menține nivelul colinei. Metabolismul matern în timpul alăptării este esențial pentru menținerea nutrienților care sunt transferați puii prin lapte. Cu toate acestea, nu putem exclude posibilitatea ca diferențele dintre mamele însărcinate și cele care alăptează să fie datorate perioadei mai lungi de expunere la FASD și scăderii proteinelor MTHFR la barajele care alăptează, în locul unui răspuns diferențial în timpul sarcinii sau alăptării.
Descoperirile noastre sunt în concordanță cu studiile recente efectuate la om care au examinat efectele aportului excesiv de folat matern asupra sănătății descendenților. Mamele care au consumat cele mai mari cantități de acid folic au avut copii cu dimensiuni embrionare reduse (41). Insuficiența memoriei la puii nou-născuți din barajele FASD din acest studiu este în concordanță cu constatările dintr-un studiu spaniol care demonstrează că copiii ale căror mame au consumat peste 5 mg/zi de acid folic periconcepțional au întârziat dezvoltarea psihomotorie (21). În plus, există un raport recent că folatul plasmatic matern ridicat a fost asociat cu un risc crescut de tulburare a spectrului autist la descendenți (42).
În rezumat, am arătat că aportul ridicat de acid folic la șoarecii însărcinați duce la întârzierea creșterii intrauterine cu dezvoltarea creierului modificată și afectarea memoriei la descendenți. Sugerăm că aceste rezultate se pot datora deficitului pseudo-MTHFR atât la descendenți, cât și la mame, cu tulburări consecvente ale metabolismului colinei și metilului. Acest studiu se adaugă dovezilor în creștere că consumul excesiv de acid folic în timpul sarcinii poate avea consecințe negative asupra sănătății și că determinarea unei limite superioare sigure este critică.
Materiale și metode
Experimentarea și dietele pe animale
Testarea comportamentului
Toate testele comportamentale au fost efectuate așa cum este descris în Ref. (10). Scurte descrieri ale metodelor testelor individuale sunt după cum urmează:
Test de câmp deschis
Șoarecii au fost așezați în mijlocul unei cutii de câmp deschis și au fost lăsați să exploreze timp de 5 minute. Fundul câmpului deschis a fost împărțit în 16 pătrate egale. Videoclipurile înregistrate au fost analizate pentru activitate (numărul total de pătrate traversate), numărul de intrări în pătratele interioare și pătratele exterioare și% timp petrecut în fiecare.
Testul fasciculului scării
Aparatul consta din doi pereți din plexiglas și bare metalice între pereți dispuși într-un model neregulat și a fost așezat deasupra unei cuști de șoarece. Înregistrările au fost obținute de la fiecare mouse și analizate cadru cu cadru. Scorul de eroare a fost combinația dintre numărul total de erori și numărul de pași pentru fiecare membru.
Test de recunoaștere a obiectelor noi
Puii au fost lăsați să se obișnuiască în cameră timp de 30 de minute și apoi în aparat (câmp deschis) timp de 10 minute. Animalele au explorat două copii identice ale obiectului 1 plasat în colțuri opuse într-un câmp deschis timp de 8 minute (faza de încercare), apoi s-au întors în cuștile lor timp de o oră. Memoria pe termen scurt a fost evaluată permițând animalelor să exploreze un obiect familiar (obiectul 1) și un obiect nou (obiectul 2) timp de 5 minute (faza de testare). Atât faza de încercare, cât și faza de testare au fost înregistrate, iar cantitatea de timp explorată a obiectelor a fost evaluată din înregistrările video de către doi cercetători independenți. Indicele de discriminare (DI) a fost calculat ca raportul dintre timpul petrecut de animale cu romanul și obiectul familiar. O valoare pozitivă indică faptul că animalul a preferat să exploreze obiectul nou.
Testul Y-labirint
Puii au fost lăsați să se obișnuiască în cameră timp de 30 de minute și apoi plasați la capătul brațului lung al labirintului. Animalelor li s-a permis să se miște prin labirint timp de 8 minute. Testul a fost înregistrat și seria înregistrărilor de brațe au fost înregistrate. O alternanță este considerată ca intrări succesive în cele trei brațe. Numărul alternanțelor a fost înregistrat și calculat ca procent din intrările totale ale brațului.
Secțiuni cerebrale și imunohistochimie
Metaboliții colinei
Mulțumiri
Mulțumim doctorilor Nancy Lévesque și Karen Christensen pentru sfaturi tehnice și revizuirea critică a manuscrisului. Mulțumim și membrilor Dr. Laboratorul lui Guillaume Sébire (Universitatea McGill) pentru asistență cu metodologiile și Dr. Jason Karamchandani (Universitatea McGill) pentru revizuirea secțiunilor embrionare.
Declarație privind conflictul de interese. Niciunul nu a declarat.
- Beneficiile pentru sănătate ale uleiului de semințe de bujor din arborele dietetic într-un hamster funcțional cu dietă bogată în grăsimi
- Masticarea Khat și comportamentele dietetice restrictive sunt asociate cu anemia la femeile gravide din
- Asocierea inversă între obiceiurile alimentare cu capacitate antioxidantă totală ridicată și prevalența de
- Deficiența de magneziu Cele șase semne de identificare, inclusiv constipație și hipertensiune arterială
- Dieta bogată în grăsimi modulează conținutul de proteine al transportorilor de nutrienți din intestinul subțire al șoarecilor