Douglas J. Morrison
Centrul de cercetări de mediu al universităților scoțiene, Universitatea din Glasgow, East Kilbride, Scoția
Tom Preston
Centrul de cercetări de mediu al universităților scoțiene, Universitatea din Glasgow, East Kilbride, Scoția
ABSTRACT
Formarea SCFA este rezultatul unei interacțiuni complexe între dietă și microbiota intestinală în mediul lumenului intestinal. Descoperirea receptorilor, într-o serie de tipuri de celule și țesuturi pentru care acizii grași cu lanț scurt SCFA par a fi liganzii naturali, a dus la un interes crescut pentru SCFA ca molecule de semnalizare între microbiota intestinală și gazdă. SCFA reprezintă fluxul major de carbon din dietă prin microbiota intestinală către gazdă și se evidențiază un rol de reglementare al SCFA în metabolismul local, intermediar și periferic. Cu toate acestea, lipsa unor studii umane bine concepute și controlate ne-a împiedicat înțelegerea semnificației SCFA în sănătatea metabolică a omului. Această revizuire își propune să reunească concluziile recente cu privire la rolul SCFA în metabolismul uman pentru a evidenția rolul multilateral al SCFA pe diferite sisteme metabolice.
Introducere
Producția de SCFA de către microbiota intestinală
SCFA sunt produse în principal prin fermentarea zahararitică a glucidelor care scapă de digestie și absorbție în intestinul subțire, iar căile de producție a SCFA sunt relativ bine înțelese 4 și descrise recent în detaliu. 5 Produsele majore sunt formiatul, acetatul, propionatul și butiratul. Lactatul este, de asemenea, un acid organic major produs din fermentarea unor NDC selectate, adesea fermentabile rapid. 6 Se produc, de asemenea, cantități relativ mici de acizi grași cu lanț ramificat, în principal prin fermentarea aminoacizilor cu lanț ramificat derivat din proteine. 7 Fermentarea aminoacizilor poate contribui, de asemenea, la SCFA, în principal prin producția de acetat și propionat. Se știe relativ puțin despre rolul formiatului în intestin. A fost legată de metanogeneză și pare a fi crescută în condiții inflamatorii. 8.9 Lactatul poate fi metabolizat în continuare în acetat, propionat și butirat de către un număr de organisme care se hrănesc încrucișat. 10-12
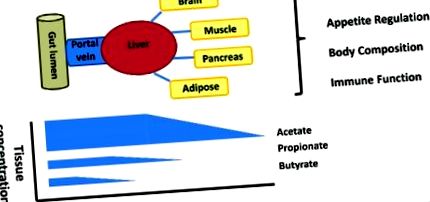
Locul producției SCFA și gradientului biologic de la lumenul intestinal la periferie
Există un gradient biologic puternic pentru fiecare SCFA de la lumenul intestinal la periferie, ceea ce duce la expunerea diferită a celulelor și țesuturilor la SCFA (Fig. 1). Lucrarea seminală la victimele cu moarte subită a fost prima care a evidențiat reducerea semnificativă a butiratului, față de acetat și propionat în epiteliul intestinal și, de asemenea, reducerea semnificativă a propionatului față de acetat în ficat la om. Acest lucru a fost observat, de asemenea, mai recent, cu studii de flux stabil de izotopi la om, unde capacitatea hepatică de a utiliza SCFA echilibrează producția de SCFA intestinale, ducând la producția de propionat splanchnic și butirat nesemnificativ. 30,31 Aceste observații sugerează că rolurile SCFA ar trebui luate în considerare în fiecare tip de celulă sau țesut în cadrul acestui gradient biologic. Interacțiunea dintre utilizarea epitelială și integritate, utilizarea splanșică și disponibilitatea periferică necesită delimitare pentru a determina dacă producția crescută a tuturor SCFA sau creșterea selectivă a SCFA individual la țesuturi specifice, determină unele dintre efectele metabolice observate.
Lumenul intestinal este locul principal de producție, dar gradientul de concentrație cade de la lumen la periferie cu absorbție selectivă de butirat la epiteliu, propionat la ficat și acetat la periferie. Semnificația pentru fiziologia gazdei a acestui gradient biologic este slab înțeleasă.
SCFA și integritatea intestinului
SCFA și homeostazia glucozei
În plus față de semnalul direct derivat din SCFA din intestin există semnale concomitente generate de producția primară de SCFA în lumenul intestinal. Hormonii intestinali produși de celulele enteroendocrine din epiteliul colonic exercită, de asemenea, efecte benefice asupra homeostaziei glucozei. Mecanismele efectelor conduse de hormoni intestinali asupra homeostaziei glucozei au fost revizuite integral în altă parte 53.54 și sunt dincolo de scopul acestei revizuiri. Cu toate acestea, producția de SCFA de către microbiota din lumenul intestinal este un eveniment inițial important pentru semnalul derivat din hormonul intestinal. 55,56
Efectele SCFA asupra metabolismului lipidic
SCFA și reglarea apetitului
SCFA și funcția imunitară
Ficatul găzduiește o serie de tipuri de celule care interacționează prin intermediul moleculelor mici și prin semnalizarea citokinelor imune secundare. Permeabilitatea barierei intestinale este considerată a fi un factor cheie în determinarea încărcăturii pro-inflamatorii care ajunge la ficat. 36 Abrogarea acumulării hepatocitelor de trigliceride și a esterificării cu acizi grași și scăderea oxidării acizilor grași și a reacției la insulină a fost observată într-un model de epuizare a celulelor Kupffer murin, mediat în mare măsură de TNF-α. 88 Date recente sugerează, de asemenea, că butiratul suprimă activitatea TNF-α, IL-6 și mieloperoxidază prin prevenirea activării NF-κΒ în celulele Kupffer. 89 Există puține date cu privire la acetat și propionat, care ar fi prezente la un flux mai mare prin ficat. Deși sunt necesare dovezi suplimentare pentru a stabili rolul SCFA în reglarea inflamației hepatice, direct sau indirect, aceste studii demonstrează importanța axei intestin-ficat în sistemele inflamatorii și metabolice și că SCFA poate juca roluri importante în ambele.
Rolul SCFA se extinde și asupra funcției imune periferice. Un studiu recent a demonstrat că acetatul mediază inflamația articulară într-un model de gută murină prin asamblarea inflammasomului și producția de IL-1β care este parțial dependentă de FFAR2. 90 Un efect protector similar a fost observat recent pentru butirat într-un model de gută cu celule mononucleare din sânge periferic, deși au fost necesare concentrații mari de butirat pentru a produce producția de citokine pro-inflamatorii IL-1β, IL-6, IL-8 și IL- 1β. 91 Luarea în considerare a gradientului biologic pentru expunerea la SCFA pentru diferite tipuri de celule imune poate fi esențială pentru definirea rezultatelor relevante fiziologic în bolile imun-mediate și inflamatorii.
Concluzii și perspective de viitor
SCFA împreună cu alți metaboliți care intră în sistemul portal hepatic sunt transportați rapid în ficat. Rolul semnalizării moleculare pe diferite tipuri de celule hepatice este slab caracterizat. SCFA poate acționa asupra macrofagelor și hepatocitelor rezidente, deși poate exista selectivitate funcțională pentru fiecare SCFA. Hormonii de increție pot acționa și asupra hepatocitelor și a țesuturilor periferice. Impactul general al acestui sistem de semnalizare dual pare a fi menținerea unui ficat sănătos prin reglarea metabolismului hepatic și a inflamației și controlul fluxului FFA derivat din adipos. Efectele periferice ale SCFA par specifice țesutului. SCFA poate regla insulina din pancreas, fluxul de FFA din adipocite, centrele apetitului din creier și poate oferi un combustibil pentru mușchi. Acest rol cu mai multe fațete necesită totuși o investigație suplimentară cu studii bine concepute și controlate la oameni.
Abrevieri
Dezvăluirea potențialelor conflicte de interese
Autorii nu au conflicte de interese de declarat.
Finanțarea
Laboratorul de biochimie a izotopilor stabili de la SUERC este susținut parțial de granturi de la BBSRC (BB/L004259/1, BB/H004815/1, BB/H532091/1, BB/L025418/1) și parteneriatul strategic al guvernului scoțian (RESAS).
- Acizi grași esențiali EFA
- Blogul Acizilor grași pentru activarea produselor de ardere a grăsimilor
- Diferențe critice între suplimentul dietetic și prescripția Acizilor grași Omega-3 O poveste
- Dockside Hotel Apartments London Docklands, sejururi scurte lângă Excel
- Catechine și procianidine în fructe de padure din specii de vaccin și jurnalul lor de activitate antioxidantă