Mark P. Mattson
un Laborator de Neuroștiințe, Institutul Național pentru Îmbătrânire, Baltimore, MD, 21224;
b Departamentul de Neuroștiințe, Școala de Medicină a Universității Johns Hopkins, Baltimore, MD, 21205;
David B. Allison
c Centrul de Cercetare pentru Nutriție și Obezitate, Universitatea din Alabama, la Birmingham, Birmingham, AL, 35294;
Luigi Fontana
d Departamentul de Medicină, Universitatea Washington din St. Louis, St. Louis, MO, 63130;
e Departamentul de Științe Clinice și Experimentale, Universitatea din Brescia, 25123 Brescia, Italia;
f CEINGE Biotechnology Advanced, 80145 Napoli, Italia;
Michelle Harvie
g Centrul de prevenire a cancerului de sân Genesis, Spitalul Universitar South Manchester, Wythenshaw, M23 9LT Manchester, Regatul Unit;
Walter D. Longo
h Institutul de longevitate, Școala de Gerontologie Davis și Departamentul de Științe Biologice, Universitatea din California de Sud, Los Angeles, CA, 90089;
Willy J. Malaisse
și Laboratorul de Hormonologie Experimentală, Universitatea Liberă din Bruxelles, B-1070 Bruxelles, Belgia;
Michael Mosley
j British Broadcasting Corporation, W1A 1AA Londra, Regatul Unit;
Lucia Notterpek
k Departamentul de Neuroștiințe, Colegiul de Medicină, Institutul McKnight Brain, Universitatea din Florida, Gainesville, FL, 32610;
Eric Ravussin
l Centrul de Cercetări Biomedice Pennington, Baton Rouge, LA, 70808;
Frank A. J. L. Scheer
m Harvard Medical School și Brigham and Women’s Hospital, Boston, MA, 02115;
Thomas N. Seyfried
n Departamentul de biologie, Boston College, Chestnut Hill, MA, 02467;
Krista A. Varady
o Departamentul de Kinesiologie și Nutriție, Universitatea din Illinois la Chicago, Chicago, IL, 60612; și
Satchidananda Panda
p Laborator de biologie de reglementare, Institutul Salk pentru Studii Biologice, La Jolla, CA 92037
Contribuțiile autorului: M.P.M., D.B.A., L.F., M.H., V.D.L., W.J.M., M.M., L.N., E.R., F.A.J.L.S., T.N.S., K.A.V. și S.P. a scris ziarul.
Abstract
Deși eforturile majore de cercetare s-au concentrat asupra modului în care componentele specifice ale produselor alimentare afectează sănătatea, se știe relativ puțin despre un aspect mai fundamental al dietei, frecvența și calendarul circadian al meselor și potențialele beneficii ale perioadelor intermitente fără consum de energie sau foarte scăzut. Cel mai frecvent tipar alimentar în societățile moderne, trei mese plus gustări în fiecare zi, este anormal din perspectiva evoluției. Descoperirile emergente din studiile pe modele animale și subiecți umani sugerează că perioadele intermitente de restricționare a energiei de doar 16 ore pot îmbunătăți indicatorii de sănătate și contracara procesele bolii. Mecanismele implică o schimbare metabolică către metabolismul grăsimilor și producerea cetonelor și stimularea răspunsurilor adaptive la stres celular care previn și repară deteriorarea moleculară. Pe măsură ce datele cu privire la frecvența optimă și calendarul meselor se cristalizează, va fi esențial să se dezvolte strategii pentru a încorpora aceste modele de alimentație în politica și practica de îngrijire a sănătății și în stilul de viață al populației.
Considerații evolutive și culturale
Spre deosebire de oamenii moderni și animalele domestice, tiparele de mâncare ale multor mamifere se caracterizează prin aportul de energie intermitent. Carnivorele pot ucide și mânca prada doar de câteva ori pe săptămână sau chiar mai puțin frecvent (3, 4), iar antropoizii vânători-culegători, inclusiv cei care trăiesc astăzi, mănâncă adesea intermitent în funcție de disponibilitatea alimentelor (5, 6). Capacitatea de a funcționa la un nivel ridicat, atât fizic, cât și mental, pe perioade îndelungate fără hrană, ar fi putut avea o importanță fundamentală în istoria noastră evolutivă. Multe adaptări pentru alimentarea intermitentă sunt conservate la mamifere, inclusiv organe pentru absorbția și depozitarea glucozei rapid mobilizabile (depozite de glicogen hepatic) și a substraturilor energetice de lungă durată, cum ar fi acizii grași din țesutul adipos. Adaptările comportamentale care permit achiziționarea și depozitarea alimentelor pătrund în repertoriul comportamental al tuturor speciilor, inclusiv al oamenilor. Într-adevăr, capacitățile cognitive superioare ale oamenilor în comparație cu alte specii au evoluat probabil în scopul dobândirii resurselor alimentare; dovezile sugerează că primele instrumente (7) și limbi (8) au fost inventate pentru a ajuta la achiziționarea de alimente.
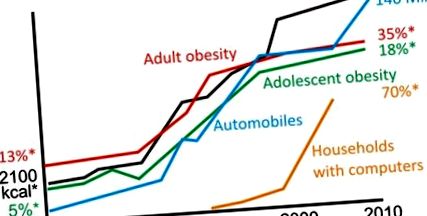
Revoluția agricolă, care a început în urmă cu aproximativ 10.000 de ani, a dus la disponibilitatea constantă pe tot parcursul anului a alimentelor tipice societăților moderne. Strămoșii noștri agrari au adoptat un model de mâncare de trei mese pe zi, probabil pentru că a oferit atât beneficii sociale, cât și practice pentru munca zilnică și programele școlare. Mai recent, în ultimii 50 de ani, produsele alimentare cu densitate calorică ridicată (cereale rafinate, zahăr, uleiuri de gătit, sirop de porumb și așa mai departe) au pătruns în aceste trei mese zilnice (9). Atunci când este suprapus unor stiluri de viață din ce în ce mai sedentare, consumul de mese cu conținut ridicat de energie de mai multe ori în fiecare zi a contribuit în mod plauzibil la apariția obezității și a bolilor conexe ca fiind principalele cauze de morbiditate și mortalitate (Fig. 1). Obezitatea a devenit, de asemenea, o problemă majoră de sănătate la câini și pisici, care sunt adesea hrăniți ad libitum (10) și chiar rozătoarele de laborator pot fi adesea considerate supraalimentate și sedentare (11, 12). Într-adevăr, animalele din sălbăticie și oamenii vânători-culegători rareori, dacă vreodată, suferă de obezitate, diabet și boli cardiovasculare (5).
Marea creștere a obezității este puternic asociată cu aportul zilnic de calorii și transportul care promovează sedentarismul (ref. 84-86; www.earth-policy.org/data_center/C23). * SUA, valoare aproximativă. # Producție auto la nivel mondial.
Ritmuri circadiene, sincronizarea meselor și sănătate
Ritmurile circadiene sunt oscilații auto-susținute de 24 h în comportament, fiziologie și metabolism. Aceste ritmuri au evoluat și permit organismelor să răspundă în mod eficient la schimbarea zilnică previzibilă a luminii: ciclul întunecat și ritmurile rezultate în disponibilitatea alimentelor în natură. Studiile de expresie genică au relevat mai mult de 10% din genele exprimate în orice organ dat prezintă oscilație circadiană (13). Aceste transcrieri ritmice codifică pașii cheie de determinare a ratei în căile neuroendocrine, de semnalizare și metabolice. O astfel de reglare separă temporar procesele celulare incompatibile și optimizează capacitatea celulară și organismală. Deși ceasul circadian este autonom celular și este prezent în majoritatea tipurilor de țesuturi, sistemul circadian este organizat într-un mod ierarhic în care nucleul hipotalamic suprachiasmatic (SCN) funcționează ca ceasul circadian maestru care utilizează atât mecanisme difuzibile, cât și sinaptice pentru orchestrați ritmurile circadiene în organele periferice în faza corespunzătoare. Celulele ganglionare ale retinei fotoreceptive trimit informații de lumină ambientală către SCN prin conexiune monosinaptică pentru a se asigura că sistemul circadian este antrenat la lumina zilnică: ciclu întunecat (14).
Mecanismul care stă la baza efectului benefic al TRF este probabil complex și acționează pe mai multe căi. Episoadele zilnice de post și hrănire declanșează activarea alternativă a proteinei de legare a elementului de răspuns cAMP care răspunde la post (CREB) și a AMP kinazei și hrănirea țintelor mamifere dependente de insulină responsive ale căilor de rapamicină (mTOR) implicate în homeostazia metabolică. În plus, aceste căi afectează și ceasul circadian și îmbunătățesc robustețea oscilației componentelor ceasului și a țintelor din aval (23). În consecință, studiile privind expresia genelor indică faptul că TRF susține ritmicitatea circadiană a mii de transcrieri hepatice (26).
Confluența genomicii și geneticii la șoareci dezvăluie căile de la componentele de bază ale ceasului la metabolismul specific al nutrienților. Receptorii hormonilor nucleari REV-ERB fac parte integrantă din ceasul circadian și reglează direct transcrierea mai multor enzime cheie determinante ale ratei metabolismului acizilor grași și al colesterolului (27). Deși proteinele criptocrom sunt puternice supresoare transcripționale, ele inhibă, de asemenea, semnalizarea AMPc și, astfel, reglează gluconeogeneza mediată de CREB (28). Factorii de transcripție în aval de ceas circadian DBP/TEF/HLF reglează metabolismul xenobiotic (29), iar KLF15 mediază metabolismul azotului (30). Aceste și alte moduri de reglare (31) oferă un cadru mecanicist prin care timpul mesei afectează ceasul circadian și, la rândul său, afectează homeostazia metabolică la mamifere.
Nu numai că faza circadiană influențează răspunsul metabolic la consumul de alimente, consumul de alimente în sine s-a demonstrat recent că este controlat de sistemul circadian endogen, independent de ciclul de somn/veghe și de post/hrănire (32), ajutând probabil la explicarea de ce micul dejun este adesea cea mai mică masă a zilei sau chiar omisă toate împreună.
Mecanisme celulare și moleculare: Insight from Restriction Intermittent Energy and Fasting
În comparație cu cei hrăniți ad libitum, durata de viață a organismelor de la drojdie și viermi, la șoareci și maimuțe poate fi extinsă prin restricția energetică dietetică (33-35). Datele colectate de la persoanele care practică restricții dietetice severe indică faptul că oamenii suferă multe adaptări moleculare, metabolice și fiziologice tipice rozătoarelor CR de lungă durată (36). IER/postul poate preveni și chiar inversa procesele de boală în modele animale de diferite tipuri de cancer, boli cardiovasculare, diabet și tulburări neurodegenerative (2). Aici subliniem pe scurt patru mecanisme generale prin care IER protejează celulele împotriva leziunilor și bolilor.
Răspunsuri adaptive la stres.
Bioenergetica.
O trecere metabolică la ketogeneză, care are loc în timpul posturilor, susține bioenergetica neuronală. Depozitele de glicogen hepatic sunt de obicei epuizate în decurs de 10-12 ore de la post, care este urmat de eliberarea acizilor grași din celulele țesutului adipos în sânge. Acizii grași sunt apoi transportați în celulele ficatului unde sunt oxidați pentru a genera Acetil-CoA. Acetil-CoA este apoi transformat în 3-hidroxi-3-metilgluaryl-CoA, care este la rândul său utilizat pentru a genera cetone acetoacetat și β-hidroxibutirat (β-OHB). Cetonele sunt eliberate în sânge și sunt transportate în diferite țesuturi, inclusiv în creier, unde sunt preluate de neuroni și utilizate pentru a produce acetil-CoA. Acetil-CoA intră în ciclul acidului tricarboxilic (TCA) pentru a genera ATP.
În timp ce IER/postul este benefic și supraalimentarea dăunează multor tipuri de celule normale, invers este adevărat pentru celulele tumorale. Celulele din tumori prezintă anomalii mitocondriale majore și își generează ATP în primul rând din glicoliză, mai degrabă decât din fosforilarea oxidativă (54). Mai mult, tumorile sunt foarte vascularizate și astfel celulele lor au acces la cantități mari de glucoză circulantă. Modelele animale au arătat în mod constant că IER inhibă și chiar inversează creșterea unei game de tumori, inclusiv neuroblastom, cancer de sân și ovarian (55). Trecerea la cetogeneză poate juca un rol important în suprimarea creșterii tumorale prin IER/post, deoarece multe celule tumorale sunt în mare măsură incapabile să utilizeze cetone ca sursă de energie; în consecință, dietele ketogenice pot potența efectele antitumorale ale IER (54). Deși preliminare, studii de caz recente la pacienți umani sugerează potențiale aplicații ale IER în tratamentul unei game de tipuri de cancer, inclusiv sân, ovar, prostată și glioblastom (56, 57). Într-adevăr, teoria evoluției prezice că mutațiile aleatorii colectate vor împiedica celulele tumorale să facă adaptările metabolice necesare la IER (58).
Inflamaţie.
Îmbunătățirea reparării și îndepărtării moleculelor și organelor deteriorate.
Celulele posedă mecanisme dedicate pentru îndepărtarea moleculelor și a organelor deteriorate. Un mecanism implică „marcarea” moleculară a proteinelor deteriorate cu ubiquitină, care le vizează degradarea în proteazom (66). Într-un al doilea mecanism mai elaborat numit autofagie, proteinele, membranele și organele deteriorate și disfuncționale sunt direcționate și degradate în lizozomi (67). S-a demonstrat că aportul de energie și nutrienți (în special aminoacizi) are efecte consistente asupra autofagiei. Când organismele ingerează mese regulate, celulele lor primesc un aport relativ constant de nutrienți și rămân astfel într-un „mod de creștere” în care sinteza proteinelor este robustă și autofagia este suprimată (68). Calea mTOR receptivă la nutrienți reglează negativ autofagia. În consecință, postul inhibă calea mTOR și stimulează autofagia în celulele multor țesuturi, inclusiv ficatul, rinichii și mușchii scheletici (69-71). În acest fel, postul „curăță” celulele de molecule și organite deteriorate.
Șobolanii menținuți pe diete cu restricții energetice prezintă o acumulare redusă de proteine polubiquitinate și dovezi ale autofagiei crescute în nervii periferici în comparație cu șobolanii hrăniți ad libitum (72). Într-un model de șoarece de tip Charcot-Marie-Tooth de tip 1A, o tulburare moștenită caracterizată prin demielinizarea nervilor periferici, IER a îmbunătățit performanța motorie și a redus demielinizarea printr-un mecanism care implică autofagie sporită și acumulare redusă de agregate PMP22 din proteina mielină (73). O caracteristică comună a multor boli cronice majore este acumularea anormală/excesivă de agregate proteice în interiorul și în afara celulelor; exemplele includ α-sinucleina intracelulară în boala Parkinson și β-peptida amiloidă extracelulară și proteina Tau intracelulară în boala Alzheimer (74, 75). În plus față de frecvența meselor, calendarul circadian al meselor este susceptibil să afecteze răspunsurile mașinilor celulare pentru eliminarea proteinelor și a organelor deteriorate (76). Autofagia este reglată într-un ritm diurn în multe tipuri de celule, iar acest ritm poate fi modificat prin modificarea momentului de administrare a alimentelor. Prin urmare, este rezonabil să se ia în considerare faptul că momentul mesei are un impact asupra bolilor care implică autofagie afectată sau insuficientă.
Implicații la nivel de societate
Modele de consum zilnic și săptămânal de alimente. Ilustrația superioară arată cinci modele diferite de consum alimentar pe o perioadă de 24 de ore. R: Consumarea a trei mese mari, plus gustări răspândite pe parcursul unei perioade de veghe de 16 ore; acesta este modelul alimentar obișnuit al consumului de alimente, după care a apărut epidemia de obezitate, diabet și bolile cronice asociate. B - D: Exemple de modele de alimentație cu timp limitat în care alimentele sunt consumate ca trei (B) sau două (C) mese de dimensiuni normale sau trei mese mici (D). E: Completează repede. Exemple de programe de consum săptămânal sunt prezentate în dreapta jos. ER, restricție de energie; IER, restricție de energie intermitentă; TRF, hrănire limitată în timp.
Directii viitoare
Ar fi deosebit de valoros să proiectăm ECA la subiecți umani cu comparații cap la cap a mai multor modele alimentare, cum ar fi cele prezentate în Fig. 3. Odată stabilite tiparele de alimentație care promovează o sănătate optimă, ce se poate face pentru a încuraja, permite și împuternici indivizii să-și modifice alegerile alimentare și modelele alimentare? Implementarea oricăror astfel de modificări va fi o provocare, așa cum sugerează o jumătate de secol de cercetări privind abordările comportamentale pentru controlul greutății. Acestea fiind spuse, domeniul științei comportamentale evoluează continuu, la fel ca și creșterea și calitatea tehnologiei informației mobile, care poate servi la susținerea eforturilor. Sperăm că, în viitor, vom putea ajuta mai bine indivizii să realizeze schimbările sănătoase de comportament dorite.
Mulțumiri
Acest articol încorporează informații dintr-un atelier de lucru despre „Modele de alimentație și boli”, care poate fi vizualizat la videocast.nih.gov/summary.asp?Live=13746&bhcp=1 și a fost susținut de Institutul Național pentru îmbătrânirea programului de cercetare intramurală și Fundația Glenn pentru cercetare medicală. Cercetările relevante din laboratoarele autorilor sunt susținute de suportul intramural NIH (către M.P.M.); Subvenții NIH P30DK056336 (către DBA), P01AG034906 (către VDL), R01NS041012 (către LN), P30DK072476 (către ER), R01DK099512 (către FIȘIERE), R01NS055195 (către TNS), R01HLV (K09) al șaptelea program-cadru al Uniunii Europene MOPACT [mobilizarea potențialului îmbătrânirii active în Europa; FP7-SSH-2012-1 Grant 320333 (către L.F.)]; o subvenție de la Genesis Breast Cancer Prevention, Marea Britanie (către M.H.); și grantul Fundației Belgiene pentru Cercetare Medicală Științifică 3.4520.07 (către W.J.M.).
Note de subsol
Autorii nu declară niciun conflict de interese.
- Frecvența mesei și pierderea în greutate - Există un lucru cum ar fi alimentarea focului metabolic
- Frecvența mesei De câte ori pe zi ar trebui să mănânc Aaptiv
- Frecvența meselor - o prezentare generală Subiecte ScienceDirect
- Momentul meselor poate afecta nivelul colesterolului
- Programarea meselor; Exemplu de plan zilnic de masă