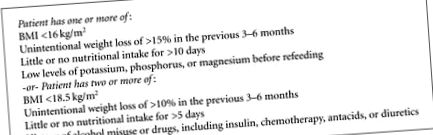Philip S. Mehler
1 Departamentul de Medicină Internă, Denver Health Medical Center, Denver, CO 80204, SUA
Amy B. Winkelman
2 Departamentul Servicii Alimentare și Nutriționale, Centrul Medical pentru Sănătate din Denver, Denver, CO 80204, SUA
Debbie M. Andersen
2 Departamentul Servicii Alimentare și Nutriționale, Centrul Medical pentru Sănătate din Denver, Denver, CO 80204, SUA
Jennifer L. Gaudiani
1 Departamentul de Medicină Internă, Denver Health Medical Center, Denver, CO 80204, SUA
Abstract
Restabilirea greutății este crucială pentru tratamentul cu succes al anorexiei nervoase. Fără aceasta, pacienții se pot confrunta cu complicații medicale grave sau chiar letale ale foametei severe. Cu toate acestea, procesul de reabilitare nutrițională poate fi, de asemenea, riscant pentru pacient. Sindromul de realimentare, o problemă a schimbărilor de electroliți și lichide, poate provoca invaliditate permanentă sau chiar deces. Este esențial să identificați pacienții cu risc, să îi monitorizați cu atenție și să inițiați un program de reabilitare nutrițională care să aibă ca scop evitarea sindromului de realimentare. O inițiere judicioasă și lentă a aportului caloric, necesită un control zilnic pentru a răspunde unor entități precum inflamația ficatului și hipoglicemia care pot complica transformarea organismului de la o stare catabolică la una anabolică. În plus, reabilitarea nutrițională ar trebui să țină seama de caracteristicile clinice unice pentru acești pacienți, cum ar fi gastropareza și tranzitul colonic încetinit, astfel încât să poată fi luate măsuri pentru ameliorarea disconforturilor fizice ale restaurării greutății. Metodele adjuvante de realimentare, cum ar fi utilizarea nutriției enterale sau parenterale, pot juca un rol mic, dar important într-un grup selectat de pacienți care nu poate tolera singură reabilitarea nutrițională orală.
1. Fundal
Realimentarea pacientului anorectic este esențială pentru obținerea unui rezultat de tratament de succes. Judecând după rezultatele studiilor din întreaga lume, majoritatea experților sunt de acord că nu se poate trata în mod eficient anorexia nervoasă fără a restabili mai întâi greutatea corporală. Este, de asemenea, clar că, fără un efort concertat de realimentare, nu poate avea loc nici o psihoterapie semnificativă, din cauza deficitelor cognitive induse de foame. Cu toate acestea, restaurarea greutății poate fi una dintre cele mai provocatoare și frustrante părți ale procesului de recuperare pentru mulți pacienți cu anorexie nervoasă.
În mod tradițional, centrele care tratează pacienții care au grade moderate și severe de anorexie nervoasă au folosit o combinație de tehnici comportamentale, restructurare cognitivă și un program structurat progresiv de aport caloric oral, pentru a atinge obiectivul restabilirii greutății. Diferite tipuri de hrană gastrică și nutriție parenterală totală (TPN) pot fi indicate rareori pentru cazuri mai refractare. TPN este o procedură specializată și trebuie întreprinsă numai atunci când este necesar din punct de vedere medical și de către un clinician cu experiență, cu sprijinul unui personal cu experiență în asistență medicală și nutrițională. Clinicienii care îngrijesc acești pacienți trebuie să fie conștienți de arta procesului de realimentare, având în vedere multitudinea de avertismente clinice și biochimice potențiale care se pot dezvolta.
Atunci când un pacient este pregătit să înceapă procesul de realimentare, trebuie să existe, de la început, o încercare serioasă de a ajunge la un acord între îngrijitor, dietetician și pacient cu privire la care va fi greutatea țintă. De asemenea, petrecerea timpului educând un pacient cu anorexie nervoasă despre metabolism și modul în care acesta se poate schimba în timpul procesului de refacere a greutății poate preveni dificultățile viitoare și reduce stresul pentru pacient. În general, creșterea în greutate până la 10% din IBW este un obiectiv acceptabil, indiferent de modul de realimentare. Unii consideră o „greutate sănătoasă” ca fiind greutatea la care a avut loc menstruația normală în trecut. Cu toate acestea, dacă amenoreea persistă, poate fi necesar să se realizeze efectiv IBW, sau chiar puțin peste aceasta. Eliberarea pacienților înainte de a atinge o greutate normală minimă este asociată cu o rată crescută de readmisie [2, 3]. Mulți practicanți vor admite un pacient la spital pentru tratament internat și restaurare nutrițională atunci când greutatea pacientului este cu peste 30% sub IBW. Acest lucru este atât pentru a minimiza morbiditatea în primele etape ale realimentării, cât și pentru că rata complicațiilor severe pare să crească semnificativ la aceste greutăți mici.
2. Sindromul de realimentare
Liniile directoare NICE pentru identificarea pacienților cu risc crescut de sindrom de realimentare.
Mecanismul potențialului colaps cardiovascular care apare odată cu sindromul de realimentare este multifactorial. În primul rând, masa redusă a inimii care însoțește pierderea în greutate face dificilă inimii să facă față creșterii volumului total de sânge circulator observat la reîncărcare. Rezultatul final al acestui lucru poate fi insuficiența cardiacă. Chiar dacă masa inimii revine la normal cu creșterea în greutate, primele câteva săptămâni de realimentare necesită o atenție deosebită asupra stării cardiovasculare a unui pacient anorectic până la apariția acestui proces de normalizare. Studiile asupra anorexiei nervoase au arătat o scădere a debitului cardiac ca urmare a atrofiei mușchiului cardiac care însoțește pierderea în greutate nesănătoasă [7].
În al doilea rând, modificările nivelurilor serice de fosfor, precum și potasiu și magneziu sunt variabile cheie în sindromul de realimentare. Mecanismul prin care se dezvoltă un nivel scăzut de fosfor (hipofosfatemie) în timpul alimentării se datorează în principal conținutului de glucoză al substratului alimentar. Sarcina de glucoză crește eliberarea insulinei, care la rândul său produce schimbări de fosfat și potasiu în spațiul intracelular. Există, de asemenea, o încorporare a fosfatului în țesuturile nou sintetizate în timpul alimentării. Nivelurile scăzute de fosfat rezultate sunt însoțite de epuizarea substanței chimice cu energie ridicată, adenozin trifosfat (ATP), care afectează proprietățile contractile ale inimii și poate evolua în insuficiență cardiacă congestivă. Hipofosfatemia indusă de realimentare poate duce, de asemenea, la oboseală musculară diafragmatică și insuficiență respiratorie. Alte sechele ale hipofosfatemiei induse de realimentare includ disfuncția globulelor roșii și albe, leziuni ale mușchilor scheletici (rabdomioliză) și convulsii. Rabdomioliza este diagnosticată prin găsirea unui nivel anormal de ridicat al enzimei musculare, creatinin fosfokinază (CPK), la un simplu test de sânge. Nivelurile scăzute de potasiu și magneziu seric pot provoca, de asemenea, iritabilitate cardiacă și aritmii, împreună cu slăbiciune a mușchilor scheletici [8].
3. Sfaturi practice pentru realimentare
Deși este clar important, în special pentru pacienții spitalizați, să experimentați un grad semnificativ de creștere în greutate pentru a maximiza recuperarea, nu se cunoaște intervenția dietetică optimă pentru a efectua creșterea în greutate. A existat o lipsă distinctă și surprinzătoare de cercetări privind intervențiile nutriționale în anorexia nervoasă. După prima sau două săptămâni de spitalizare internă, obiectivul obișnuit este creșterea în greutate de 2-3 lb/săptămână. În timp ce unii pacienți ajung la spital în profunzime de volum epuizat, alții, mai ales dacă au suferit repletie intravenoasă agresivă sau realimentare parenterală totală în timpul unei spitalizări anterioare recente, pot ajunge cu până la douăzeci de kilograme în plus de edem. Chiar și cu inițierea judicioasă și lentă a aportului caloric, pacienții cu cele mai mari compromisuri medicale pot câștiga o anumită greutate de edem inițial și apoi vor auto-diureza această greutate pe măsură ce greutatea lor adevărată începe să crească, în timp ce alții trebuie să piardă toată greutatea edemului preexistent înainte de greutatea lor începe să se ridice într-un mod sănătos. Acest lucru poate face dificilă interpretarea schimbării greutății în primele câteva săptămâni de spitalizare.
Câteva reguli generale simple de urmat sunt: (1) TEE nu trebuie să depășească niciodată de două ori BEE, (2) aportul caloric ar trebui să depășească rar 70-80 kcal pe kilogram de greutate corporală sau 35-40 kcal/lb, (3) cu pacient anorectic sever, începeți o dietă de la 20 la 25 kcal pe kilogram, (4) aportul de proteine nu trebuie să depășească 1,5 până la 1,7 grame pe kilogram de greutate corporală și este, în general, cuprins între 1 și 1,5 grame, (5) dacă TPN sau se utilizează hrăniri enterale, aportul de carbohidrați nu trebuie să depășească 7 mg/kg/min, (6) creșterea în greutate ar trebui să fie în intervalul de două până la trei kilograme pe săptămână. Bărbații ating, în general, vârful la 4.000 kcal/zi, iar femelele la 3.500 kcal/zi. Toate abordările necesită monitorizare clinică și de laborator vigilentă și individualizarea unui plan dietetic, în funcție de rata creșterii în greutate și de evoluția de laborator și clinică a pacientului.
În prezent, pe majoritatea unităților cu tulburări alimentare, aportul caloric este crescut încet. Aceste creșteri ar trebui să fie întotdeauna ghidate de modelul real de creștere în greutate al pacientului față de obiectivul standard de două până la trei kilograme pe săptămână. Aportul caloric trebuie modificat din cauza modificărilor REE în timpul alimentării cu anorexie nervoasă, care va avea un impact asupra creșterii în greutate. REE este adesea mai scăzută la pacienții cu anorexie nervoasă la începutul procesului de realimentare decât în etapele ulterioare [10, 11]. Este posibil ca aceste modificări să contribuie la dificultatea creșterii în greutate susținute în cursul ultimelor etape de realimentare în rândul pacienților cu anorexie nervoasă [12]. Cerințele calorice pentru refacerea greutății la pacienții cu anorexie nervoasă sunt cel mai bine determinate prin monitorizarea ratei de creștere în greutate a unei persoane. Având în vedere acest proces dinamic, necesitățile calorice trebuie să fie recalculate dacă creșterea în greutate nu se realizează așa cum era de așteptat în timpul procesului de realimentare sau dacă se iau în considerare sursele potențiale de pierdere în greutate, cum ar fi exercițiile sub acoperire sau alte moduri de purjare. Recalcularea REE cu calorimetrie indirectă poate fi rezonabilă ori de câte ori se manifestă acest scenariu clinic.
În cele din urmă, pe măsură ce procesul de realimentare progresează și se realizează IBW, pot fi necesare temporar niveluri ridicate de aport caloric (70-80 kcal/kg) pentru a promova creșterea în greutate continuă. Recent s-a elucidat că realimentarea unui pacient cu anorexie nervoasă poate fi asociată cu o creștere efectivă a REE în timpul procesului de creștere în greutate. Deși mecanismul acestui fenomen este în prezent necunoscut, implicațiile sale clinice sunt destul de clare: pot fi necesare diete neobișnuit de bogate în calorii pentru a asigura creșterea în greutate continuă spre sfârșitul procesului de refacere a greutății. Un platou în rata dorită de realizare a greutății țintă a pacientului poate fi observat din cauza subestimării necesităților calorice în timpul etapelor târzii de refacere a greutății datorită modificării menționate anterior a valorii REE. Strategia optimă de tratament ar trebui să se bazeze pe monitorizarea regulată a modelului de creștere în greutate al unui individ și ajustarea planului alimentar din cauza acestor variații individuale inerente. Toate aceste principii se aplică indiferent dacă sunt folosite hrănirile orale obișnuite sau se folosește o metodă alternativă, mai puțin utilizată, cum ar fi nutriția parenterală totală (TPN) sau hrana enterală.
4. Complicații potențiale
Din punct de vedere clinic, ratele de creștere în greutate mai mari de două până la trei kilograme pe săptămână nu sunt, de obicei, sănătoase din punct de vedere nutrițional și pot reprezenta retenție de lichid edematos sau conținutul intestinal reținut de constipație. În afară de acest ghid numeric pentru creșterea în greutate, există parametri clinici care merită să fie urmăriți îndeaproape. Mai exact, semnele vitale contribuie la informații utile zilnice. Indivizii anorectici sunt în general bradicardici (ritmul cardiac 100 bătăi/minut), prezența unui ritm cardiac crescut, chiar dacă doar în intervalul de ritm cardiac 80-90, în timpul alimentării, poate fi un vestitor al sindromului de realimentare și al compromisului cardiac. Astfel, chiar dacă acești pacienți nu sunt tehnic tahicardici, o creștere bruscă susținută a pulsului la mai mult de 80-90 merită evaluată, având în vedere frecvența cardiacă tipică inițială a indivizilor anorectici de 50 până la 60 de bătăi pe minut. Astfel, monitorizarea zilnică a semnelor vitale de câteva ori pe zi este crucială în primele câteva săptămâni ale procesului de realimentare.
În plus, verificarea prezenței edemului în zona gleznei și a tibiei este, de asemenea, o practică utilă în primele etape de realimentare; prezența sa poate fi un semn de rău augur al sindromului de realimentare. Cu toate acestea, poate apărea și ca o complicație minoră, deoarece în primele etape ale realimentării, secreția de insulină crește în mod normal. Insulina induce retenția de sodiu prin creșterea reabsorbției renale tubulare de sodiu [13]. Prin urmare, dietele cu conținut scăzut de sodiu ar trebui utilizate ca parte a planului nutrițional. Prezența ralelor la examenul pulmonar sau dovezi ale presiunilor venoase jugulare crescute sunt mai puțin frecvente, dar dacă există, poate implica o insuficiență cardiacă adevărată. Oricare dintre aceste constatări clinice merită o evaluare medicală amănunțită, luând în considerare scăderea posibilă a ratei de realimentare. În plus, din cauza întârzierii golirii stomacului și a timpului prelungit de tranzit al colonului constatat în stadiile severe ale anorexiei nervoase, acești pacienți se plâng adesea de balonare abdominală și constipație. Un regim intestinal, cu o cantitate judicioasă de fibre și o hidratare adecvată, poate ajuta la ameliorarea acestor simptome în timpul procesului de realimentare timpurie.
O multitudine de posibile aberații de lichide și electroliți pot apărea în timpul procesului de realimentare, în special în segmentul mai sever al populației anorectice. Pe măsură ce corpul trece de la o stare catabolică la o stare anabolică, potasiul, fosforul și magneziul sunt încorporate în țesutul muscular nou sintetizat și sunt utilizate pentru metabolismul intermediar, care poate provoca niveluri serice scăzute, și anume, hipokaliemie, hipofosfatemie și hipomagnezemie. După cum s-a discutat mai sus, fosforul este electrolitul cheie în sindromul de realimentare [14]. Monitorizarea frecventă a valorilor chimice ale sângelui pacientului (potasiu, fosfor, magneziu, sodiu și glucoză) poate evita aceste probleme. La începutul procesului de realimentare, verificarea valorilor chimice ale serului în fiecare zi sau în fiecare zi este un plan rezonabil. Acest lucru poate fi avansat până la două săptămâni, odată ce pacientul s-a îngrășat în mod constant și dacă profilul sângelui a rămas relativ stabil. În cele din urmă, cu creșterea în greutate continuă și cu rezultate stabile de laborator, acest lucru poate fi modificat în continuare pentru a fi monitorizat mai puțin frecvent. Cu toate acestea, accentul major ar trebui pus pe nivelurile de fosfor seric, deoarece alimentarea cu hipofosfatemie este principala cauză chimică a sindromului de realimentare.
Alte complicații metabolice pot fi întâlnite în timpul procesului de realimentare. În timpul realimentării pot fi observate creșteri ușoare ale enzimelor hepatice. Acestea sunt mai frecvente la acei pacienți cărora li se administrează enteral sau cu TPN. În general, anomaliile sunt observate după primele câteva săptămâni de realimentare. Aspartatul aminotransferază (AST) și alanina aminotransferaza (ALT) cresc mai întâi, urmate de fosfatază alcalină și apoi de bilirubină. De obicei, aceste anomalii au o semnificație clinică redusă și se rezolvă cu o încetinire a ratei procesului de realimentare. S-au sugerat multe ipoteze cu privire la etiologia acestor anomalii; multe dovezi indică calorii excesive de dextroză care provoacă acumularea de grăsimi în celulele hepatice, cunoscută sub numele de steatoză hepatică. Uneori creșterile pot fi mai pronunțate (de peste trei ori normale) și necesită consultarea cu un dietetician pentru a reduce caloriile carbohidraților-dextrozei.
Deficitul de tiamină în perioada de reabilitare acută poate provoca fie insuficiență cardiacă congestivă („beriberi umezi”), fie encefalopatie Wernicke („beriberi uscați”), care se caracterizează printr-o stare confuzională acută, cu anomalii oculare, ataxie, hipotermie și chiar coma [ 15, 16]. S-a raportat, de asemenea, mielinoliza pontină centrală ca o complicație a realimentării și a hiponatremiei [17]. Atrofia mucoasei intestinale și insuficiența pancreatică pot provoca diaree severă în timpul alimentării timpurii [16].
În cele din urmă, hipoglicemia a fost asociată cu anorexia, legată de rezervele hepatice de glicogen epuizate și de substraturile de gluconeogeneză. Încărcăturile mari de glucoză conținute în protocoalele de realimentare agresive stimulează cantități substanțiale de eliberare de insulină din pancreas, care nu pot fi compensate de rezervele hepatice epuizate de glicogen. Aceste creșteri de insulină postprandiale provoacă hipoglicemie postprandială. Cu toate acestea, pacienții cu malnutriție extremă au adesea și hipoglicemie de post. Medicii trebuie să fie întotdeauna conștienți de acest risc de hipoglicemie la începutul reîncărcării, mai ales dacă se utilizează calea parenterală sau enterală și trebuie întreruptă brusc. Încetarea bruscă involuntară sau intenționată a TPN sau a alimentelor enterale la orice pacient poate duce la hipoglicemie periculoasă.
5. Moduri alternative de realimentare
- Ghiduri nutriționale și cadre alimentare fermentate
- Reabilitarea nutrițională în Bangladesh - importanța zincului The American Journal of Clinical
- Ghiduri nutriționale pentru programele de prânz școlar Un sondaj al școlilor islamice și recomandări
- Ghiduri nutriționale pentru sportivele de sex feminin Cheia musculo-scheletică
- Mazare porumbei Fapte, beneficii pentru sănătate și valoare nutrițională