Abstract
fundal
Hidrolizat de proteine din cartof, APPH este un potențial ingredient dietetic anti-obezitate. Deoarece obezitatea duce la deteriorarea funcției hepatice și a bolilor hepatice asociate, în acest studiu a fost investigat efectul APPH asupra dietei bogate în grăsimi (HFD) asociate afectărilor hepatice.
Metode
Hamsterii masculi de șase săptămâni au fost separați aleatoriu în șase grupuri (n = 8) ca martor, HFD (HFD hrănit obez), L-APPH (HFD + 15 mg/kg/zi de APPH), M-APPH (HFD + 30 mg/kg/zi), H-APPH (HFD + 75 mg/kg/zi de APPH) și PB (HFD + 500 mg/kg/zi de probucol). Hamsterii alimentați cu HFD au fost administrați cu APPH 50 de zile prin gavaj oral. Animalele au fost eutanasiate și numărul de nuclei apoptotici din țesutul hepatic a fost determinat prin colorarea TUNEL, iar amploarea fibrozei interstițiale a fost determinată prin colorarea tricromului Masson. Modularea evenimentelor moleculare asociate apoptozei și fibrozei a fost elucidată din analiza Western blot a extractelor totale de proteine.
Rezultate
Hamsterii hrăniți cu o dietă bogată în grăsimi au prezentat simptome de afectare a ficatului, măsurate din markeri serici, cum ar fi nivelurile de alanină aminotransferază și aspartat aminotransferază. Cu toate acestea, o suplimentare de 50 de zile de APPH a ameliorat efectele efectelor HFD. HFD a modulat, de asemenea, expresia proteinelor de supraviețuire și apoptoză în ficatul de hamster. Mai mult, grupurile HFD au prezentat niveluri ridicate de markeri de fibroză în ficat. Creșterea fibrozei și a apoptozei a fost corelată cu creșterea nivelului de kinaze extracelulare fosforilate cu semnal reglat (pERK1/2), relevând un rol potențial al ERK în afectarea hepatică mediată de HFD. Cu toate acestea, tratamentul cu APPH a redus considerabil efectul HFD asupra markerilor apoptozei și fibrozei și a oferit protecție hepato.
Concluzie
Prin urmare, APPH poate fi considerat un agent terapeutic eficient pentru ameliorarea leziunilor hepatice legate de dieta bogată în grăsimi.
fundal
Obezitatea este o problemă gravă de sănătate publică asociată cu boli cronice de îngrijorare, cum ar fi diabetul de tip II, bolile cardiovasculare, rezistența la insulină, afecțiunile ficatului gras, accident vascular cerebral, artrită și astm. Prevalența obezității crește atât în țările dezvoltate, cât și în țările în curs de dezvoltare, unde obezitatea la o vârstă fragedă devine un fenomen obișnuit. Conform estimărilor OMS, prevalența globală a adulților supraponderali este mai mare de 1 miliard și aproximativ 300 de milioane dintre aceștia sunt obezi [1,2,3,4,5]. O dietă bogată în grăsimi (HFD) care conține niveluri ridicate de lipide este un factor cauzal major pentru complicațiile hepatice, cum ar fi hipercolesterolemia, steatohepatita, inflamația, apoptoza și fibroza [6,7,8,9,10]. Cu toate acestea, mecanismele moleculare din spatele patogenității asociate cu HFD rămân neclare și, prin urmare, o strategie terapeutică eficientă de contracarare nu este încă disponibilă.
Ficatul joacă un rol esențial în menținerea metabolismului lipidic prin controlul lipogenezei, lipolizei, gluconeogenezei și glicolizei. Ficatul controlează mai mult de 10.000 de reacții biochimice la un moment dat, ceea ce ajută la homeostazia metabolică normală și la depozitarea carbohidraților, lipidelor, vitaminelor și mineralelor [11, 12]. Obezitatea este una dintre cele mai frecvente afecțiuni asociate cu tulburări hepatice, cum ar fi steatoza hepatică, boli hepatice grase nealcoolice și progresul ulterior la steatohepatită. Aportul de HFD modifică semnificativ evenimentele moleculare și funcția ficatului, care se reflectă cu o modulație considerabilă în markerii funcționali ai ficatului [11].
Mai multe studii care au implicat oameni obezi și modele animale induse de dietă au raportat pe larg despre diferite efecte adverse ale HFD [13,14,15,16,17]. Hamsterul Golden Sirian este un model animal utilizat pe scară largă pentru metabolismul lipoproteinelor și este foarte predispus la obezitate și tulburări asociate [18]. La o dietă bogată în grăsimi, hamsterii prezintă o creștere semnificativă a greutății corporale începând cu a patra săptămână de tratament și continuă să câștige o creștere exponențială cel puțin până la a 12-a săptămână [18]. APPH este un hidrolizat alcalazic al fracției de proteine din cartofi care posedă stimularea lipolizei cu potențial eficient anti-obezitate [19]. Cu toate acestea, efectul APPH asupra dietei hepatice induse de dieta bogată în grăsimi (HFD) și fibroză este incert.
În timp ce modelele de șobolani și șoareci prezintă rezistență la apariția hiperglicemiei Hamsterii aurii sirieni sunt predispuși la obezitate [20]. Pe o dietă bogată în colesterol, hamsterii dezvoltă cu ușurință hipercolesterolemie și hipertrigliceridemie, în plus, HFD induce cu ușurință obezitate și boli ale ficatului gras la hamsteri [18, 21]. Pentru a studia efectele hepato-protectoare ale APPH, hamsterii sirieni de aur masculi au fost hrăniți cu HFD pentru o perioadă de 80 de zile și s-a descoperit că prezintă manifestări de leziuni hepatice. Cu toate acestea, hamsterii alimentați cu HFD, administrați cu doze diferite de APPH timp de 50 de zile, au prezentat o îmbunătățire considerabilă a simptomelor. Nivelurile de ALT (alanină aminotransferază) și AST (aspartat aminotransferază) s-au dovedit a fi crescute la hamsterii obezi, însă administrarea de APPH a redus considerabil nivelurile serice de ALT și AST. Proteinele implicate în apoptoză și fibroză s-au văzut, de asemenea, reduse semnificativ în țesuturile hepatice ale hamsterilor obezi administrați de APPH. Rezultatele noastre arată că aportul prelungit de APPH poate atenua apoptoza hepatică indusă de HFD și fibroza la hamsteri. Administrarea de APPH poate fi deci considerată ca un potențial agent terapeutic pentru ameliorarea leziunilor hepatice legate de HFD.
Metode
Pregătirea APPH
Pregătirea, purificarea și caracterizarea APPH au fost efectuate așa cum sa raportat anterior. Compoziția și caracteristicile APPH au fost, de asemenea, verificate pentru a fi în concordanță cu cele raportate anterior [22]. Pe scurt, proteina din cartof (Han-Sient Corporation, Taipei, Taiwan) și enzima alcalse au fost amestecate (raport 25:10) pentru a obține un hidrolizat proteic cu 81% proteină. APPH a fost caracterizat prin HPLC cu fază inversă și prin MS/MS/TIC așa cum sa menționat în raportul anterior [22].
Experimente pe animale
Determinarea markerilor serici
Pentru analiza serică, probele de sânge au fost extrase de la hamsteri și centrifugate la 2000 rpm timp de 10 min, iar nivelurile de ALT și AST au fost măsurate folosind kituri de testare disponibile în comerț (Abcam, Cambridge, Marea Britanie).
Extracția proteinelor din probele de țesut
Secțiunile de țesut hepatic au fost omogenizate în tampon de liză (100 mg/ml) conținând Tris, EDTA, 2-mercaptoetanol, 10% glicerol, inhibitor de protează și inhibitor de fosfatază (pH = 7,4). Supernatanții care conțin proteine solubile au fost colectate prin centrifugarea omogenatului la 12.000 g timp de 40 min.
Analiza Western blot
Concentrația de proteine a probelor a fost determinată utilizând metoda de testare a proteinelor Lowry. Proteinele au fost separate prin electroforeză pe gel de dodecil sulfat de sodiu - poliacrilamidă (SDS-PAGE) și ulterior au fost transferate în membranele PVDF (GE Healthcare Life Sciences, Pittsburgh, PA, SUA). Membranele au fost blocate utilizând 3% albumină serică bovină (BSA) în tampon TBS și apoi hibridizate cu anticorpi primari (Santa Cruz Biotechnology, Santa Cruz, CA, SUA). După o spălare adecvată cu tampon TBS, membranele au fost hibridizate cu anticorpi secundari marcați cu peroxidază de hrean și pete au fost vizualizate cu ECL într-un sistem de detectare a chemiluminescenței Fujifilm LAS-3000 (GE Healthcare Life Sciences).
Colorarea țesuturilor
Colorarea cu tricrom a lui Masson pentru determinarea fibrozei hepatice și testul de DUTP Nick End Labeling (TUNEL) mediat de Deoxinucleotidă Transferază terminală pentru determinarea apoptozei au fost efectuate pe țesuturile încorporate în parafină, după cum sa menționat anterior [22]. Pe scurt, lamelele de țesut au fost depilate și rehidratate prin scăderea concentrației de alcool și colorate cu vopsea tricromă a lui Masson. Pentru testul TUNEL secțiunile au fost tratate cu proteinază K urmată de soluție de permeablizare și apoi incubate în reactiv TUNEL (Roche Applied Science, Indianapolis, IN, SUA) timp de 60 min la RT. Secțiunile au fost spălate în PBS cel puțin de două ori între fiecare etapă reușită. Secțiunile au fost fotografiate în mod corespunzător cu camera Olympus DP74 (Olympus, Tokyo, Japonia) montată pe un microscop (BX53, Olympus). Secțiunile TUNEL au fost fotografiate sub fluorescență pentru a detecta nucleele pozitive TUNEL în verde și nucleele colorate DAPI în albastru.
analize statistice
Rezultatele prezentate sunt mediile ± SD obținute din trei experimente independente. Analiza statistică a fost efectuată folosind analiza ANOVA unidirecțională a variantelor.
Rezultate
Administrarea APPH suprimă apoptoza și fibroza indusă de HFD
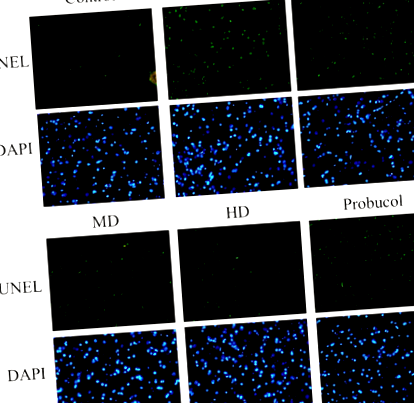
Colorarea TUNEL pe secțiunile de țesut hepatic a arătat o creștere a numărului de celule TUNEL pozitive în grupurile de șobolani HFD. Cu toate acestea, administrarea de doze mici, moderate și mari de APPH a suprimat în mod eficient apoptoza, așa cum se observă din reducerea numărului de nuclee apoptotice colorate în verde (Fig. 1). Efectul administrării APPH asupra apoptozei induse de HFD a fost, de asemenea, considerat a fi superior celui al probucolului. Colorarea cu tricrom a lui Masson a secțiunilor de țesut hepatic a arătat că HFD la hamsteri a declanșat fibroză hepatică care a fost în mod substanțial suprimată la hamsterii tratați cu APPH așa cum se observă din reducerea acumulării lor de colagen (Fig. 2).
Efectul APPH asupra apoptozei hepatice. Rezultatele testului TUNEL arată nuclei apoptotici (verzi) printre nucleele totale (albastru) la hamsterii de control, hamsterii alimentați cu HFD (HFD), hamsterii alimentați cu HFD tratați cu doză mică de APPH (L-APPH), hamsterii alimentați cu HFD tratați cu doză moderată de APPH (M-APPH), hamsteri alimentați cu HFD tratați cu doză mare de APPH (H-APPH) și hamsteri alimentați cu HFD tratați cu probucol
Efectul APPH asupra nivelurilor markerilor de leziuni hepatice
Nivelurile de aminotransferaze serice, inclusiv ALT și AST în grupul HFD au crescut semnificativ în comparație cu grupurile martor. Cu toate acestea, nivelurile au rămas scăzute în grupurile de hamsteri administrați de APPH, indicând o reducere a leziunilor hepatice induse de HFD (Tabelul 1).
Administrarea APPH atenuează apoptoza hepatică și îmbunătățește proteinele legate de supraviețuire
Analiza expresiei proteinelor prin western blot a arătat că hrănirea HFD la hamsteri a reglementat în jos proteinele de supraviețuire Akt și a reglat în sus proteinele apoptotice, cum ar fi caspaza 3 și Bad. Hamsterii cărora li s-au furnizat niveluri scăzute, moderate sau ridicate de APPH au prezentat niveluri suprimate de Bad și caspază 3 (Fig. 3).
Administrarea APPH reglează MMP2 și MMP9
Hamsterii care s-au hrănit cu HFD au prezentat niveluri ridicate de MMP2 și MMP9 în ficat, o creștere a acestor MMP în ficat corelându-se în general cu fibroza hepatică. Cu toate acestea, nivelurile au fost semnificativ reduse atunci când au fost tratate cu APPH, dezvăluind efectele protectoare dezvoltate în grupurile de tratament împotriva fibrozei hepatice (Fig. 4).
Efectul APPH asupra expresiei kinazei MAPK
Hrănirea HFD la hamsteri a dus la o creștere a MAPK-urilor fosforilate, cum ar fi pP38 și pERK. APPH a suprimat semnificativ expresia pERK și a influențat nivelurile de pP38 (Fig. 5). Cu toate acestea, probucolul a prezentat un efect moderat în reducerea efectului HFD în semnalizarea P38 indicând faptul că probucolul acționează prin influențarea căilor multiple.
Discuţie
Obezitatea este în general asociată cu un dezechilibru în consumul și consumul de energie și provoacă o povară substanțială asupra sănătății, deoarece este legată de patogeneza diferitelor boli comune, cum ar fi diabetul de tip II, bolile cardiovasculare și NAFLD [23,24,25].
Ficatul este un organ vital pentru metabolism, detoxifiere și pentru reglarea răspunsurilor imune. Prin urmare, ficatul este susceptibil de rănire după expunerea la diverse stresuri și ca răspuns la rănire, noua matrice extracelulară este sintetizată ca un proces de vindecare. Reglarea ECM este guvernată de producție și proteoliză și este crucială pentru menținerea homeostazei structurale și funcționale a ficatului. Mai mulți factori, cum ar fi MMP-urile, joacă un rol major în menținerea echilibrului dintre geneza fibroasă și liza fibroasă, iar dereglarea lor duce la fibroza hepatică. MMP-urile țesutului hepatic joacă un rol crucial în fibrogeneză. Dintre MMP-urile cunoscute, doar câteva se găsesc în mod normal în țesutul hepatic. MMP-2, care este greu de detectat la rozătoare în condiții normale, este exprimat de celule stelate hepatice ca răspuns la leziuni hepatice. MMP-2 pentru că este un factor autocrin în celulele stelate hepatice pentru proliferare și migrare îmbunătățește fibroza hepatică atunci când este supraexprimată [26].
Studiul nostru anterior a arătat că administrarea APPH suprimă în mod eficient apoptoza indusă de HFD la șobolanii în vârstă. Cu toate acestea, acumularea de colagen hepatic indusă de HFD nu este foarte importantă la șobolanii în vârstă [22]. La modelele de îmbătrânire, procesul de fibroliză este adesea afectat și, prin urmare, are ca rezultat acumularea excesivă de factori ECM și, prin urmare, duce la fibroză hepatică [27]. Prin urmare, pentru a autentifica efectele fibrolizei induse de APPH, este esențial să se evalueze efectele acestora la șobolani tineri. Rezultatele din prezentul studiu arată că administrarea APPH are ca rezultat suprimarea MMP-2 și MMP-9 și, prin urmare, suprimă efectele fibrozei într-o manieră dependentă de doză, după cum se vede din colorarea cu tricrom a lui Masson.
Aminotransferazele serice sunt considerate ca indicatori importanți ai afectării ficatului [28]. De obicei, activitatea ALT în ficat este de aproximativ 3000 de ori mai mare decât cea din ser. Cu toate acestea, în timpul leziunii hepatice, ALT este eliberat în ser, determinând creșterea nivelului seric al ALT [28]. În timp ce ALT se găsește în cantități mari în citosolul hepatocitelor, AST este prezent la niveluri substanțiale într-o mare varietate de țesuturi și este mai mare în rinichi, inimă și mușchi scheletic decât în ficat. Creșterea activității AST indică modificări ale potențialului membranei hepatocelulare, necrozei celulare și inflamației [29, 30]. Datele noastre arată că nivelurile atât ale AST, cât și ale ALT au fost semnificativ crescute în proteinele serice ale hamsterilor hrăniți cu HFD. Rezultatele indică faptul că alimentarea cu HFD a deteriorat funcția ficatului și a afectat sănătatea generală a animalului. Între timp, administrarea APPH la hamsteri a redus considerabil nivelurile de ALT și AST și arată o funcție hepatică îmbunătățită și starea generală de sănătate a hamsterilor alimentați cu HFD.
Membrii familiei Bcl-2 de proteine-Bcl-2 și Bad sunt markeri bine cunoscuți ai apoptozei; în timp ce Bcl-2 este o proteină anti-apoptotică, Bad este pro-apoptotic [31]. Rezultatele noastre demonstrează că markerii apoptozei intrinseci și extrinseci care au fost mai mari la hamsterii din grupul HFD s-au dovedit a fi reglementați la administrarea APPH. APPH a suprimat, de asemenea, nivelurile de Bcl-2 și nivelurile de proteine Bax reglementate în sus în țesutul hepatic al hamsterilor alimentați cu HFD. Prin urmare, rezultatele relevă potențialul anti-apoptotic al APPH împotriva leziunilor hepatice induse de HFD.
Calea de semnalizare PI3K/Akt este un mecanism crucial de supraviețuire care contracarează evenimentele apoptotice din majoritatea celulelor [32]. Pentru a determina dacă efectele benefice ale APPH asupra apoptozei hepatice induse de HFD la hamsteri implică mecanismul PI3K/Akt, au fost analizate nivelurile formei active (fosforilate) de Akt (p-Akt) și Akt total.
Diferite dovezi sugerează că semnalizarea MAPK este implicată în apoptoza intrinsecă mediată de mitocondrie [33]. În studiul de față, nivelul p38 fosforilat a fost modificat semnificativ la hamsterii din grupul HFD; APPH nu a prezentat niciun efect ameliorant semnificativ. Cu toate acestea, kinaza extracelulară cu reglare a semnalului (ERK), care a fost extrem de exprimată în hamsterii alimentați cu HFD, a fost reglementată semnificativ la hamsterii tratați cu APPH. Acest lucru sugerează un rol proeminent al ERK în apoptoza indusă de HFD. Mai mult, tratamentul cu APPH a restabilit complet fosforilarea Akt care a fost suprimată prin alimentarea cu HFD. Rezultatele sugerează astfel că efectul anti-apoptotic asociat administrării APPH este mediat prin inactivarea mecanismului ERK și activarea semnalizării PI3K/Akt într-un mod dependent de doză.
Apoptoza și evenimentele asociate determină migrarea celulelor stelate către regiunea apoptozei pentru a înghiți corpurile apoptotice din ficat. Stelele hepatice din locul afectării țesuturilor implică depunerea matricei extracelulare care este asociată și cu vindecarea rănilor [34]. Dereglarea în procesul de vindecare are ca rezultat formarea cicatricilor care poate fi supusă în continuare progresiei fibrozei hepatice. Creșterea nivelului și activității MMP este unul dintre evenimentele caracteristice asociate cu un astfel de proces de vindecare a rănilor. Într-un model de șobolan cu fibroză hepatică indusă de ligarea căilor biliare, s-a demonstrat că activitățile MMP-2 și MMP-9 cresc în 2 zile după ligare, prin urmare, MMP-2 și MMP-9 sunt considerate a fi markeri adecvați pentru debutul ficatului fibroză [34, 35]. Rezultatele arată creșterea nivelurilor hepatice de MMP-2 și MMP-9 la hamsterii din grupul HFD, dar nivelurile s-au dovedit a fi reglementate la hamsterul administrat de APPH.
Concluzie
În acest studiu, potențialul APPH de a depăși apoptoza și fibroza indusă de HFD în ficatul hamsterilor alimentați cu HFD a fost verificat cu doze mici, moderate și mari de APPH. Administrarea APPH a arătat efecte mai bune împotriva leziunilor hepatice în comparație cu probucol și, prin urmare, leziunile provocate de HFD în ficat pot fi inversate cu administrarea APPH.
Disponibilitatea datelor și a materialelor
Seturile de date utilizate și/sau analizate în timpul studiului actual sunt disponibile de la autorul corespunzător, la o cerere rezonabilă.
- Reddit - infertilitate - Caută; dieta bogata in proteine; experiențe pentru prevenirea OHSS
- PDF AVANTAJUL O DIETĂ RIDICĂ CU PROTEINE ÎN TRATAMENTUL HIPOGLICEMIEI SPONTANE Preliminar
- Dieta cu proteine Lista articolelor cu impact ridicat Videoclipuri din reviste PPts
- Povestea Ultima actualizare a dietelor cu conținut ridicat de proteine Meniul de pierdere în greutate Pastile dietetice - Managementul HazMat
- Q; O sesiune de două săptămâni dieta cartofilor; Krocks în bucătărie