Abstract
fundal
Pentru a determina dacă scăderea în greutate este semnificativ asociată cu întreruperea tratamentului pentru hipertensiunea intracraniană idiopatică
Metode
Notele a 36 de pacienți cu hipertensiune intracraniană idiopatică sub control periodic timp de cel puțin 12 luni de către un singur neuro-oftalmolog au fost revizuite retrospectiv. Greutatea a fost înregistrată la fiecare evaluare și s-a recomandat pierderea în greutate. Tratamentul a fost ajustat în funcție de simptome, funcția vizuală, inclusiv câmpurile vizuale și aspectul discului optic. Pacienții au fost împărțiți în funcție de durata de urmărire continuă, apoi subdivizați dacă au fost sau nu în tratament la cea mai recentă revizuire și dacă s-a realizat pierderea în greutate comparativ cu prezentarea. Analiza supraviețuirii a fost efectuată pentru a evalua probabilitatea de a rămâne în tratament după pierderea în greutate.
Rezultate
Considerând pacienții ca 3 grupuri, cei cu urmărire de cel puțin 12 luni (n = 36), cei cu urmărire de cel puțin 18 luni (n = 24) și cei cu urmărire de 24 de luni sau mai mult (n = 19) )), numai grupul cu 24 de luni sau mai mult de urmărire a demonstrat o asociere semnificativă între pierderea în greutate și oprirea tratamentului sistemic (testul exact al lui Fisher, p = 0,04). Analiza supraviețuirii a demonstrat că probabilitatea de a fi la tratament la 5 ani după ce a câștigat în greutate a fost de 0,63 și a pierdut în greutate a fost de 0,38 (test log rank, p = 0,04). Rezultatele sugerează că indicele de masă corporală absolută final este mai important decât modificarea indicelui de masă corporală pentru pacienții care opresc tratamentul (Mann Whitney U, p = 0,05).
Concluzie
Acesta este primul studiu care demonstrează că pierderea în greutate este asociată cu întreruperea tratamentului. Spre deosebire de studiile anterioare, rezultatele noastre sugerează că indicele de masă corporală absolută final este mai important pentru oprirea tratamentului decât o reducere proporțională a greutății.
fundal
Hipertensiunea intracraniană idiopatică (IIH) este asociată cu un indice de masă corporală crescut (IMC) [1, 2]. Creșterea recentă în greutate la prezentare și IMC mai mare de 40 sunt predictive pentru o deficiență vizuală mai mare [3-5]. Scăderea în greutate, prin dietă sau chirurgie gastrică, este asociată cu normalizarea presiunii lichidului seros central (LCR) și îmbunătățirea papiloedemului [1, 6-9]. Deși acestea sunt măsuri rezonabile pe termen scurt ale bolii de ameliorare, beneficiul pe termen lung nu a fost încă demonstrat.
Monitorizarea activității bolii în IIH necesită evaluarea mai multor factori. Deși presiunea LCR este parametrul principal, monitorizarea presiunii intracraniene a arătat că presiunea LCR fluctuează foarte mult pe parcursul zilei în IIH [10] astfel încât puncția lombară oferă doar informații limitate despre controlul bolii [3]. Papilloedemul este o măsură secundară importantă, dar evaluarea discului optic, chiar și prin scanarea oftalmoscopiei cu laser, nu diferențiază neapărat între rezolvarea papilloedemului și atrofia optică secundară [11]. Funcția vizuală, în special câmpurile vizuale, este un parametru vital, dar este predispusă la testarea variabilității și, în general, poate determina doar dacă există progresia bolii, nu rezolvarea. Evaluarea simptomelor, în special a durerilor de cap, este supusă unor factori confuzi, astfel încât persistența lor să nu se coreleze neapărat cu activitatea bolii. Pentru a evita aceste dificultăți, punctul final ales de acest studiu a fost decizia unui singur neuro-oftalmolog, bazată pe o evaluare generală a acestor diferiți factori (cu excepția greutății pacientului), cu privire la necesitatea continuării tratamentului. Un beneficiu special este că rezultatele oferă informații ușor de transmis pacienților cu privire la valoarea pierderii în greutate în IIH.
Metode
Notele de caz au fost revizuite la pacienții cu diagnostic de IIH care îndeplinesc criteriile de diagnostic standard [12] identificate dintr-o bază de date de pacienți gestionată de un singur neuro-oftalmolog din februarie 1998. Urmărirea minimă necesară pentru includere a fost de 12 luni. Aprobarea etică pentru acest studiu a fost acordată de King's College Hospital Research Ethics Committee. Cercetările au fost efectuate în conformitate cu Declarația de la Helsinki.
Simptomele, în special cefaleea, tinitusul și tulburările vizuale, în special obscurcările vizuale tranzitorii, acuitățile vizuale, câmpurile vizuale prin Humphrey® 24-2 sau 30-2 computerizate sau perimetria Goldmann, aspectul discului optic și greutatea au fost înregistrate la fiecare vizită la clinică. Măsurătorile de greutate au fost efectuate de către o asistentă medicală folosind cântare manuale, dar fără un protocol privind cantitatea de îmbrăcăminte pe care pacientul ar trebui să o poarte.
Scăderea în greutate a fost recomandată fiecărui pacient, urmărind o reducere inițială cu 5% a greutății în decurs de 3 luni. Nu s-au dat sfaturi specifice cu privire la metoda pierderii în greutate, altele decât reducerea aportului de calorii și creșterea exercițiului. Trimiterea la un dietetician a fost aranjată dacă a fost solicitată sau nu a reușit să slăbească. Deși nu poate fi exclusă o influență asupra deciziilor de tratament, greutatea nu a fost utilizată ca factor în determinarea tratamentului. Acesta a fost utilizat ca factor de consiliere a pacienților cu prognostic probabil.
Tratamentul, determinat de simptome, funcția vizuală și aspectul discului optic, a fost în principal acetazolamidă, de obicei începând cu 500 mg/zi crescând la 1 g/zi și ocazional până la 1,5 g/zi. Furosemid 20-40 mg/zi sau dacă durerile de cap erau supărătoare topiramatul crescând treptat la 200 mg/zi au fost utilizate dacă a existat intoleranță, lipsă de eficacitate sau contraindicație la acetazolamidă. În general, durerile de cap au fost tratate cu paracetamol (acetaminofen), aspirină sau antiinflamatoare nesteroidiene (AINS). Opiaceele și analgezicele care conțin cofeină au fost evitate sau întrerupte ori de câte ori a fost posibil. Tratamentul chirurgical a fost întreprins dacă a existat un risc semnificativ de pierdere progresivă a vederii, în ciuda tratamentului medical, fie din lipsa de eficacitate, intoleranță sau neconformitate. Shuntul lumbo-peritoneal a fost opțiunea preferată, cu excepția cazului în care amigdalele cerebeloase au fost relativ scăzute, caz în care s-a efectuat șuntul ventriculoperitoneal. Fenestrarea învelișului nervului optic a fost efectuată dacă nu a existat durere de cap asociată sau pacientul a refuzat un shunt de LCR.
Am aplicat 2 criterii de excludere pentru revizuire: 1 pentru sarcină și 1 pentru intervenția chirurgicală anterioară. Pacientele care au fost însărcinate la prezentare sau au avut o sarcină înregistrată în note la mai puțin de 1 an după oprirea tratamentului sistemic au fost excluși, deoarece ar exista motive întemeiate să sugereze că sarcina a influențat cursul tratamentului. În ceea ce privește intervenția chirurgicală, au fost excluși pacienții care au avut o procedură pentru IIH în timpul urmăririi care a dus la întreruperea tratamentului. Cu toate acestea, cei care au avut o procedură de gestionare a IIH cu mulți ani înainte de a se prezenta la clinica noastră sau cei a căror tratament sistemic a continuat neschimbat înainte și după procedura lor au fost incluși.
Rezultate
Au fost recuperate notele a 70 de pacienți care s-au prezentat secvențial la practica de neuro-oftalmologie a unui singur consultant între februarie 1998 și martie 2003. 41 de pacienți cu IIH au fost eligibili pentru incluziune cu urmărire de 12 luni sau mai mare. Toți pacienții au îndeplinit criteriile Dandy modificate, cu cauze secundare ale creșterii presiunii intracraniene excluse folosind investigații adecvate.
3 pacienți au avut intervenții chirurgicale (toate șunturi lumbo-peritoneale) care au dus la întreruperea tratamentului sistemic și au fost excluși. 2 pacienți au fost incluși cu o intervenție chirurgicală. 1 a avut o fenestrație a tecii nervului optic în 1992 și a fost prezentată în 1999 și 1 a avut o fenestrație a tecii nervului optic în perioada de urmărire, dar tratamentul medical a rămas neschimbat înainte și după operație. Au fost excluse 2 pacienți care au rămas însărcinate în decurs de 12 luni de la întreruperea tratamentului. Au fost incluse 2 paciente care au rămas însărcinate în timpul perioadei de urmărire, dar sarcina a fost înregistrată în note 18 luni sau mai mult după oprirea tratamentului sistemic. Prin urmare, presupunem că cele 2 evenimente nu au legătură. Prin urmare, 36 de pacienți au fost incluși în analiză, 35 de femei și 1 bărbat. Vârsta medie la prezentare a fost de 31,6 ani (abaterea standard = 10,1 ani) și IMC mediu la prezentare a fost de 36,6 kg/m2 (abaterea standard = 7,5 kg/m2). Durata medie de urmărire a fost de 30 de luni (deviație standard = 16,3 luni). Un pacient a avut greutăți, dar nu înălțime. Prin urmare, ea este inclusă în tabele încrucișate, dar nu în statisticile care necesită IMC.
Tabelele încrucișate sunt prezentate în tabelul 1 cu valorile p corespunzătoare din testele exacte ale lui Fisher. Tabelul încrucișat pentru 12 luni sau mai mult de urmărire conține toți cei 36 de pacienți. 24 dintre acești pacienți au urmărit 18 luni sau mai mult și 19 dintre acești pacienți au urmărit 24 de luni sau mai mult și au fost încrucișați corespunzător. Nu au existat pacienți cu IMC identici la prima și ultima recenzie.
Nu trebuie să existe nicio diferență statistic semnificativă între pacienții care părăsesc analiza la fiecare moment și cei rămași sau rezultatele vor fi distorsionate. Am împărțit pacienții în 3 grupuri (diferite de cele utilizate pentru tabelare încrucișată): pacienți care au părăsit analiza înainte de punctul de urmărire de 18 luni (Grupa A: 12 pacienți), pacienți cu urmărire cuprinsă între 18 și 23 de luni inclusiv, adică plecarea între punctele de urmărire de 18 și 24 de luni (grupul B: 5 pacienți) și pacienții cu urmărire de 24 de luni sau mai mare (grupul C: 19 pacienți). Utilizând testele U Mann-Whitney, nu a existat nicio diferență în distribuțiile IMC la prezentare atunci când s-a comparat Grupul C cu Grupul A (p = 0,14) sau Grupul B (p = 0,41). În mod similar, nu a existat nicio diferență semnificativă între cele 3 grupuri la 12 luni de urmărire (grupa A vs grupa C: p = 0,09, grupa B vs grupa C: p = 0,91) și nu a existat nicio diferență semnificativă între grupul B și C la 18 luni următoare -up (p = 0,73).
De asemenea, am împărțit pacienții în toți cei aflați în tratament la ultima lor revizuire (n = 21) la toți cei care nu au fost tratați la ultima revizuire (n = 16) pentru a ne asigura că cele două grupuri erau altfel comparabile. Rezultatele sunt prezentate în tabelul 2. Nu există nicio diferență statistic semnificativă între grupuri în ceea ce privește vârsta, presiunea de deschidere, durata de urmărire sau IMC la prezentare.
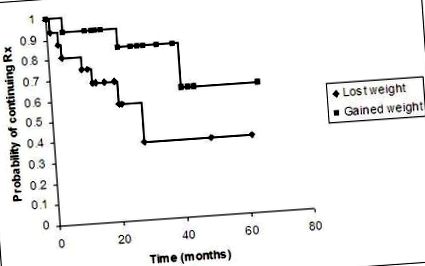
Analiza supraviețuirii pentru pacienți a fost demonstrată în figura 1. Deoarece punctul final al analizei a fost oprirea tratamentului, au fost excluși pacienții care nu au fost niciodată în tratament sau care au fost urmăriți pentru o perioadă înainte de începerea tratamentului (5 din 36 de pacienți). Am împărțit ceilalți 31 de pacienți în grupuri în greutate și în greutate slăbită, ignorând starea de tratament a pacientului la ultima revizuire. În grupul cu greutate crescută, 6 pacienți au urmărit mai puțin de 24 de luni și 9 pacienți au urmărit 24 de luni sau mai mult. În grupul cu greutate pierdută, 13 pacienți au urmărit mai puțin de 24 de luni și 3 pacienți au urmărit 24 de luni sau mai mult. Analiza supraviețuirii demonstrează că probabilitatea de a fi în tratament la 5 ani de urmărire după ce s-a îngrășat este de 0,63, în timp ce probabilitatea de a fi slăbit este de 0,38. Semnificația testării diferenței dintre cele 2 curbe cu un test log rank returnează p = 0,04.
Analiza supraviețuirii care demonstrează probabilitatea de a fi în tratament după ce s-a îngrășat și probabilitatea de a fi în tratament după ce a slăbit în timp. Punctul final al analizei a fost oprirea tratamentului.
Putem trage deducții asupra cantității de pierdere în greutate necesară pentru a opri tratamentul dacă luăm în considerare doar pacienții care au slăbit (18 din totalul de 36 de pacienți, excluzând pacientul cu greutăți, dar nu IMC: a se vedea tabelul 1) și le comparăm pe cele la tratament la urmărirea cea mai recentă (9 pacienți) față de cei care nu au primit tratament la cea mai recentă urmărire (9 pacienți). Datele sunt prezentate în tabelul 3. Nu există nicio diferență semnificativă între cei aflați în tratament și cei care nu sunt tratați în ceea ce privește greutatea finală în kilograme (Mann Whitney U, p = 0,22) sau greutatea pierdută în kilograme (Mann Whitney U, p = 0,19). În mod similar, nu există nicio diferență semnificativă între cele 2 grupuri atunci când se compară schimbarea IMC între primele și ultimele recenzii (Mann Whitney U, p = 0,26). Cu toate acestea, diferența dintre grupuri este semnificativă atunci când se compară IMC-urile finale (Mann Whitney U, p = 0,05). IMC-ul mediu final din grupul rămas în tratament la ultima revizuire a fost de 37,6 kg/m 2 (interval de încredere de 95%: 30,6 kg/m 2, 44,7 kg/m 2), în timp ce IMC-ul mediu final al grupului care nu a fost tratat în cele din urmă analiza a fost de 30,2 kg/m 2 (interval de încredere de 95%: 25,2 kg/m 2, 35,2 kg/m 2)
discutie si concluzie
Rezultatele noastre demonstrează o asociere între pierderea în greutate și oprirea tratamentului sistemic, dar numai după 24 de luni de urmărire. Rezultatele sugerează că grupurile de pacienți care părăsesc analiza statistică în fiecare moment sunt reprezentative pentru grup în ansamblu în ceea ce privește IMC-urile de bază și modificarea IMC-urilor în timp. Singura diferență semnificativă dintre grupuri la fiecare moment din datele colectate este, prin urmare, durata de urmărire și, în consecință, cantitatea de greutate pierdută. Diferența dintre grupurile de slăbire și creștere în greutate este susținută în continuare de analiza supraviețuirii, cu o probabilitate semnificativ mai mică de a fi la tratament la următorii 5 ani după ce a pierdut în greutate. Spre deosebire de studiile anterioare, rezultatele sugerează că mai degrabă decât o cantitate medie de scădere în greutate asociată cu îmbunătățirea, IMC-ul absolut final este mai important pentru pacienții care încetează tratamentul.
Trebuie să oferim o ipoteză pentru motivul pentru care au fost necesare 24 de luni de urmărire pentru grupul nostru de slăbire. Presupunem că respectarea protocolului nostru de control al greutății durează 24 de luni pentru ca o proporție semnificativă dintre pacienții noștri să piardă în greutate și să se oprească tratamentul. Prin urmare, deși durata de timp necesară va fi probabil diferită pentru diferite departamente, acest lucru nu anulează sugestia că pierderea în greutate oferă beneficii continue în ceea ce privește rămânerea în afara tratamentului, cu efectul cumulativ al pierderii constante în greutate care se manifestă ca o semnificație statistică crescândă în timp atât pentru testele exacte ale Fisher, cât și pentru analiza supraviețuirii. Acesta nu este doar un exemplu de urmărire prelungită care duce la întreruperea inevitabilă a tratamentului sau la remisiunea spontană a bolii cu 24 de luni pentru că, în acest caz, nu ar trebui să existe nicio diferență între greutatea câștigată și grupurile pierdute în greutate la Punct de 24 de luni. De asemenea, observăm că, deoarece acesta este un studiu necontrolat, nu suntem în măsură să comentăm mai departe cu privire la istoricul natural al bolii.
Din cauza problemelor din trecut cu monitorizarea IIH în mod obiectiv, sugerăm că întreruperea tratamentului sistemic este o măsură robustă de îmbunătățire a stării clinice generale, cu condiția ca deciziile privind tratamentul pacientului să fie luate în mod constant, independent de greutatea lor actuală, ca în acest studiu. Deși legătura fiziopatologică dintre masa corporală și riscul de a dezvolta IIH demonstrată epidemiologic rămâne neclară, sperăm că studiul nostru va contribui cu dovezi utile la dezbaterea privind beneficiile pierderii în greutate pentru pacienții cu IIH.
Referințe
Coopersmith MJ, Gamell L, Turbin R, Peck V, Spiegel P, Wall M: Efectele pierderii în greutate asupra evoluției hipertensiunii intracraniene idiopatice la femei. Neurologie. 1998, 50: 1094-1098.
Durcan FJ, Corbett JJ, Wall M: Incidența pseudotumorului cerebral. Studii de populație în Iowa și Louisiana. Arch Neurol. 1988, 45: 875-877.
Zidul G, George D: Hipertensiune intracraniană idiopatică. Creier. 1991, 114: 155-180. 10.1093/brain/114.2.1112.
Rowe FJ, Sarkies NJ: Relația dintre obezitate și hipertensiune intracraniană idiopatică. Int J Obezitate. 1999, 23: 54-59. 10.1038/sj.ijo.0800758.
Daniels AB, Liu GT, Volpe NJ, Galetta SL, Moster ML, Newman NJ, Biousse V, Lee AG, Wall M, Kardon R, Acierno MD, Corbett JJ, Maguire MG, Balcer LJ: Profiluri de obezitate, creștere în greutate și calitatea vieții în hipertensiunea intracraniană idiopatică (pseudotumor cerebri). Sunt J Oftalmol. 2007, 143: 635-41. 10.1016/j.ajo.2006.12.040.
Sugerman HJ, Felton WL, Salvant JB, Sismais A, Kellum JM: Efectele pierderii în greutate induse chirurgical asupra hipertensiunii intracraniene idiopatice în obezitatea morbidă. Neurologie. 1995, 45: 1655-1659.
Newborg B: Pseudotumor cerebru tratat prin orez/dietă de reducere. Arch Intern Med. 1974, 133: 802-807. 10.1001/archinte.133.5.802.
Amaral JF, Tsiaris W, Morgan T, Thompson WR: inversarea hipertensiunii intracraniene benigne prin pierderea în greutate indusă chirurgical. Arch Surg. 1987, 122: 946-949.
Johnson LN, Krohel GB, Madsen RW, March GA: Rolul pierderii în greutate și al acetazolamidei în tratamentul hipertensiunii intracraniene idiopatice (pseudotumor cerebri). Oftalmologie. 1998, 105: 2313-2317. 10.1016/S0161-6420 (98) 91234-9.
Johnson I, Paterson A: Hipertensiune intracraniană benignă. II. Presiunea și circulația LCR. Creier. 1974, 97: 301-312. 10.1093/brain/97.1.301.
Mullholland DA, Craig JJ, Rankin SJA: Utilizarea scanării oftalmoscopiei cu laser pentru a monitoriza edemul papillo în hipertensiunea intracraniană idiopatică. Br J Oftalmol. 1998, 82: 1301-1305.
Friedman DI, Jacobson DM: Criterii de diagnostic pentru hipertensiunea intracraniană idiopatică. Neurologie. 2002, 59: 1492-1495. 10.1001/archneur.59.9.1492.
Frisén L: Umflarea capului nervului optic: o schemă de stadializare. J Neurol Neurosurg Psihiatrie. 1982, 45: 13-18.
- Hipertensiunea intracraniană idiopatică National Eye Institute
- Cum să slăbești rapid 15 sfaturi pentru o slăbire sigură și eficientă
- Clienții de pierdere în greutate din LA pot fi eligibili pentru rambursări
- Gulaş; carne de vită, porc și multe altele; Câte calorii are tocană laboratoare de slăbit
- Ameliorarea gutei prin schimbarea metabolică - PHD Pierderea în greutate