Imprimarea hormonală este un proces fiziologic care are o funcție importantă la un nivel foarte scăzut de filogenie la unicelulari, 79,80 și la mamifere este necesar pentru maturarea receptorilor, adică pentru ajustarea conexiunii receptor - hormon la exterior situația mamei.
Termeni asociați:
- Receptor hormonal
- Tamoxifen
- Celule de germeni
- Receptor Eicosanoid
- Enzime
- Metilarea ADN-ului
- Insulină
- Metilare
- Epigenetica
- Semnalizare celulară
Descărcați în format PDF
Despre această pagină
Amprentare hormonală transgenerațională în tetrahimenele unicelulare
Rolul căilor de semnalizare și al factorilor conexi în provocarea amprentării
Imprimarea hormonală depinde de integritatea căilor de semnalizare care sunt prezente și funcționează în Tetrahymena. Imprimarea insulinei modifică reglarea guanilat ciclazei dependentă de calmodulină, accelerând descompunerea cGMP prin fosfodiesterază. Fluorurile activatoare ale proteinelor G influențează amprentarea hormonală pozitiv sau negativ în funcție de structura lor. Capacitatea de legare a insulinei prezintă un paralelism cu fluctuațiile nivelurilor de calciu intracelular liber. Substanțe precum TMB8, EDTA, NiCl2 și La (NO3) 3 interferează cu imprimarea hormonală, influențând legarea hormonală (insulină, TSH), ceea ce arată că reglarea intactă a Ca 2+ este o condiție de bază în imprimarea normală. 55-57 Tratamentul cu NaF nu permite dezvoltarea imprimării insulinei. 58 Inhibitorii și activatorii activității tirozin kinazei influențează, de asemenea, imprimarea. 59 Cu toate acestea, substanțele care influențează creșterea celulară, cum ar fi actinomicina D, colchicina și metilamina, nu împiedică imprimarea hormonală. 60
Moleculele care influențează metabolismul fosfolipidelor afectează, de asemenea, imprimarea hormonilor. 61–63 Imprimarea insulinei mărește enorm activitatea fosfolipazei D (PLD) în timpul efectului; cu toate acestea, acest lucru nu se întâmplă în celulele imprimate anterior. 64 Aceasta înseamnă că imprimarea modifică transducția semnalului în PLD. Inhibitorii sintezei glicoproteinelor influențează, de asemenea, imprimarea insulinei. 65
Hormonii polipeptidici fără legătură structurală, atunci când sunt administrați împreună, neutralizează reciproc efectul, în timp ce hormonii înrudiți (TSH - FSH) îl pot amplifica sau deprima.
S-a constatat că o schimbare drastică a fluidității membranei, cauzată de răcire și reîncălzire, reduce efectul imprimării, iar tratamentul simultan cu ergosterol și răcire îl elimină complet. Perturbanții de membrană, cum ar fi etanolul, anestezicele locale, cum ar fi procaina și dibucaina, precum și endotoxina, deprimă sau elimină imprimarea.
Interiorizarea lipozomilor de tip fosfatidilcolină reduce amprenta, în timp ce lipozomii de tip sfingomielină o sporesc. Dacă componenta zaharidă a receptorului de insulină este supusă unui tratament periodic, legarea și imprimarea insulinei este diminuată. Decilierea celulelor previne imprimarea insulinei - a fost necesară o regenerare a ciliilor timp de 3 ore pentru a relua eficacitatea tratamentului. ADN-ul asociat membranelor poate avea, de asemenea, un rol în imprimare, deoarece tratamentul cu DNază a împiedicat imprimarea insulinei. 66 Inhibarea endocitozei și reciclarea de către dinitrofenol sau Tris, precum și degradarea lizozomală de către clorochină, au inhibat imprimarea hormonală de către insulină.
Deși AMPc are un rol în transmiterea efectelor hormonale în Tetrahymena, creșterea artificială a nivelului AMPc inhibă provocarea imprimării sau poate avea ca rezultat o imprimare falsă.
Efectele transgeneraționale ale amprentării hormonale perinatale
Abstract
Imprimarea hormonală perinatală este un proces fiziologic necesar pentru finalizarea maturării receptorilor hormonali. Cu toate acestea, în această perioadă critică de dezvoltare, receptorii nu sunt capabili să discrimineze moleculele țintă reale de cele înrudite, astfel încât analogii hormonali, hormonii asociați, medicamentele și contaminanții din mediu, cum ar fi perturbatorii endocrini, provoacă amprente defectuoase cu substanțe biochimice și de viață consecințe funcționale. Efectele epigenetice ale amprentării hormonale sunt moștenite de la celulă la celulă și de la organism la organism. Deoarece imprimarea nu depinde de vârstă, ci depinde de starea de dezvoltare, apare și imprimarea tardivă (în principal în linii celulare diferențiate continuu). Principala sursă de imprimare târzie este poluarea aerului, a alimentelor și a apei, alături de imprimarea medicamentoasă, toate transmise transgenerațional. Se discută despre consecințele prezente și viitoare.
Hormoni, dispoziție și afectare
Sarah L. Berga, Yolanda R. Smith, în Handbook of Neuroendocrinology, 2012
Orientare sexuală
Măsura în care orientarea sexuală este conferită de amprentarea hormonală sau de expuneri rămâne un subiect controversat. Rahmen 87 a sugerat că există modificări ale circuitelor neuronale care reflectă o interacțiune a factorilor genetici, hormonali și comportamentali. Studiile la om sunt dificil de realizat. Cu toate acestea, Savic și colegii săi au folosit paradigme de neuroimagistică pentru a demonstra că feromonii masculi și feminini determină activarea diferențială a SNC în regiunile creierului care prezintă afectarea și libidoul la bărbați și femei, 31 și că neurocircuitul diferă între bărbații homosexuali, bărbații heterosexuali, femeile homosexuale și femeile heterosexuale. . 88 De asemenea, bărbații homosexuali reacționează la feromoni masculini, în timp ce bărbații heterosexuali nu, iar femeile homosexuale prezintă modele de activare diferite față de femeile heterosexuale. 89.90 Pe de altă parte, femeile expuse in utero la androgeni prezintă modele de activare similare cu cele ale femeilor heterosexuale fără astfel de expuneri. 91 Deși amploarea plasticității neurobiologice din acest circuit neuronal a primit puțină atenție investigativă, este clar că steroizii, în special cei care sunt convertiți în feromoni, inclusiv testosteronul și estradiolul, prezintă influențe activatoare care conduc orientarea sexuală și libidoul.
Toxicitatea dezvoltării hidrocarburilor policiclice aromatice
Darryl B. Hood,. Anthony E. Archibong, în Reproductive and Developmental Toxicology, 2011
Rolul imprimării b (a) p în dezvoltarea neonatală
În contextul toxicității pentru dezvoltare a B (a) P, amprenta hormonală merită menționată. Amprentarea hormonală este un fenomen care are loc atunci când receptorii se maturizează și ating capacitatea maximă de legare, orchestrând astfel producția de hormoni ai celulei și diferite funcții care se bazează exclusiv pe receptori și hormoni. La majoritatea mamiferelor, imprimarea hormonală are loc perinatal și controlează sistemele receptor - semnal - transducție și sinteza hormonală pe viață. Multe substanțe toxice din mediu sunt capabile să se lege de receptori, provocând amprentarea defectuoasă în perioadele critice de dezvoltare, rezultând consecințe morfologice, biochimice, funcționale sau comportamentale pe tot parcursul vieții (Csaba, 2008). Benzo (a) pirenul este un astfel de toxic pentru mediu și un perturbator endocrin cunoscut (Archibong și colab., 2002, 2008; Inyang și colab., 2003; Ramesh și colab., 2008).
S-a raportat că Benzo (a) pirenul imprime greșit receptorii timici ai glucocorticoizilor indiferent de stadiul vieții, reducând sever capacitatea lor de legare (Csaba și Inczefi-Gonda, 1984). De asemenea, s-a demonstrat că acest toxic influențează capacitatea de legare a receptorilor uterini (Csaba și Inczefi-Gonda, 1993) și comportamentul sexual al șobolanilor (Csaba și colab., 1993) după imprimarea neonatală. Ceea ce este mai interesant și mai deranjant este raportul că tratamentul neonatal B (a) P are, de asemenea, un efect transgenerațional (Csaba și Inczefi-Gonda, 1998). Acest raport a documentat că capacitatea de legare a receptorilor receptorilor glucocorticoizi timici a fost dependentă de sex. În timp ce densitatea receptorilor la bărbați a fost redusă până la generația F2, la femele această reducere a fost observată doar la generația F1 a animalelor tratate.
Mai mult, Tekes și colab. (2007) au arătat că un singur tratament intramuscular cu 20 μg/kg B (a) P la un șobolan mascul nou-născut (24 h postpartum) a dus la o creștere semnificativă a nivelurilor de serotonină în striat, dar o scădere semnificativă a trunchiului cerebral, a cortexului și a cortexului. hipocampus de șobolani adulți (de 12 săptămâni). Aceste studii cer, de asemenea, răspunsuri la întrebările dacă efectele de imprimare ale B (a) P sunt directe (la nivel de receptor) sau indirecte, cauzate ca o consecință a defectelor receptorului. Deoarece se știe că există multe conexiuni funcționale/reglatoare între hormonii steroizi și sinteza serotoninei (Tekes și colab., 2007), studii suplimentare sunt justificate pentru a elucida mecanismul de imprimare transgenerațională în ceea ce privește substanțele toxice de mediu, cum ar fi HAP, care sunt neurotoxicanți și endocrini perturbatoare.
Epigenetica transgenerațională
Efecte epigenetice asupra mediului asupra descendenților
Substanțele chimice care afectează endocrinele sunt o componentă importantă a substanțelor toxice care pot modifica semnele epigenetice ale liniei germinale și pot afecta fenotipul descendenților. Există multe substanțe chimice care afectează sistemul endocrin, incluzând, dar fără a se limita la acestea, categoriile largi de medicamente, produse chimice alimentare și substanțe chimice în multe produse de uz casnic, așa cum este detaliat în capitolul 18. Mai mult, există dovezi că efectele expunerii la substanțe chimice care perturbă endocrinul se pot extinde la mai multe generații și ar putea crește riscul de boli la om. Deși este clar că multe substanțe chimice care afectează endocrinul pot exercita efecte epigenetice transgeneraționale, acest lucru nu a fost observat în toate sistemele studiate și elucidarea factorilor care influențează eficacitatea acestor toxici pentru impactul eredității epigenetice generaționale va fi un obiectiv important pentru investigații viitoare.
Există faze critice de dezvoltare care sunt de mare importanță pentru manifestarea moștenirii epigenetice transgeneraționale, iar perioada perinatală se numără printre aceste faze cruciale. În această fază, amprentarea hormonală sau impactul hormonilor asupra expresiei epigenetice este predominantă și poate duce la modificări fenotipice la descendenți, precum și la generațiile ulterioare. În special, efectele amprentării perinatale pot fi pe tot parcursul vieții și un exemplu în acest sens, așa cum este descris în capitolul 19, sunt efectele amprentării perinatale ale insulinei. Un singur tratament al nou-născutului cu insulină poate duce la imprimarea hormonală la șobolani care afectează capacitatea de legare a receptorilor în timpul maturității. În generația F1 au fost observate și efectele amprentării hormonale, indicând efecte transgeneraționale (capitolul 19). Există multe alte exemple de imprimare perinatală care implică compuși precum nicotină și endorfine, iar elucidarea transmiterii epigenetice a acestor compuși, precum și multe altele vor contribui probabil în mod semnificativ la înțelegerea moștenirii transgeneraționale și a rolului crucial al perioadei perinatale de dezvoltare. în ceea ce privește expunerile la mediu.
Un punct important al capitolului 20, contribuit de Hoile și colab. este plasticitatea modificărilor epigenetice induse de factorii de mediu. Ei subliniază că niciun studiu axat pe sistemul mamiferelor nu a demonstrat încă că fenotipurile moștenite induse de factorii de mediu trec neschimbate generațiilor ulterioare. De fapt, ambele provocări de mediu pe termen scurt și lung conduc la grade diferite de gradații fenotipice care creează un gradient de efecte moștenite, iar variația acestor gradienți depinde, în mare parte, de provocarea specifică de mediu. Autorii sugerează că există o încercare de a menține un fenotip preferat, că acest lucru poate fi depășit prin expuneri selectate și că procesele non-genomice pot fi importante pentru diversitatea fenotipică. Ajustarea generațională a organismelor la medii noi poate fi un mod important de variație între generații și sunt necesare analize suplimentare ale mecanismelor epigenetice care contribuie la acest fenomen intrigant.
Gene și obezitate
III Programare fetală și epigenetică
Originile programate pentru făt sau ipoteze ale bolii adulte afirmă că factorii de mediu și stilul de viață matern, în special nutriția, acționează în viața timpurie pentru a determina riscurile de apariție a bolilor metabolice, inclusiv evenimente cardiovasculare, rezistența la insulină și creșterea excesivă în greutate în etapele ulterioare ale vieții. 60 Aceste relații dintre bolile adulte și starea nutrițională perinatală au fost identificate inițial prin strategii epidemiologice, dar confirmate și caracterizate în continuare în experimente pe animale și pot fi parțial explicate prin mecanisme epigenetice. 16 Într-adevăr, nutriția maternă poate programa epigenetic embrionul cu modele de expresie genică care persistă la maturitate și pot contribui la apariția caracteristicilor tipice ale sindromului metabolic, cum ar fi hipertensiunea, diabetul de tip 2, hiperlipemia și excesul de greutate sau obezitatea. 61
Ipoteza economisitoare a fenotipului a propus că, atunci când mediul fetal este dezechilibrat nutrițional prin exces sau deficiență, un răspuns adaptativ prioritizează funcțiile organelor cheie în detrimentul organelor mai puțin relevante din punct de vedere metabolic. 62 Această ipoteză este în concordanță cu existența putativă a „ferestrelor” fetale și embrionare temporale către un mediu intrauterin suboptim despre care se crede că predispune la viitoare consecințe adverse în căile metabolice specifice. În acest context, termenul de plasticitate metabolică descrie interacțiunile dintre schimbarea condițiilor nutriționale in utero și rezultatele ulterioare ale sănătății care pot persista pentru mai multe generații. Aceste efecte sunt cel puțin parțial mediate prin procese epigenetice care pot modifica riscul obezității mai târziu în viață. 60
Mecanismele prin care țesuturile specifice ar putea fi afectate permanent ca urmare a deficiențelor nutriționale includ modificări epigenetice în reglarea genelor, variații în structura organelor și numărul sau dimensiunea celulelor, procese de apoptoză, selecția clonală a liniilor celulare specifice, imprimarea hormonală și diferențierea metabolică. 63
În acest context, relația dintre greutatea la naștere și adipozitate, măsurată în copilărie și vârstă adultă, este în general pozitivă, dar unele investigații au raportat o asociere în formă de J sau chiar o U între greutatea la naștere și obezitatea adultului, cu o tendință mai mare la adipozitatea centrală la greutăți scăzute la naștere, în special atunci când sunt urmate de abundență nutrițională în mediul postnatal. 64
Având în vedere că nutriția timpurie poate influența modificările covalente ale ADN-ului și ale histonelor de bază, cercetările actuale se concentrează pe procesele epigenetice care sunt sensibile la reglarea nutrițională la începutul vieții. Astfel, există dovezi convingătoare din culturile de embrioni in vitro că statutul de metilare a genelor imprimate genomic, incluzând factorul de creștere de tip insulină 2 (Igf2), histocompatibilitatea 1 (H1) și receptorul factorului de creștere de tip insulină 2 (Igf2r), este afectate de condițiile de incubație nutrițională și că labilitatea epigenetică se poate extinde până la perioada postnatală timpurie la rozătoare. 63 Suplimentarea dietilară a donatorului de metil poate preveni, de asemenea, amplificarea transgenerațională a adipozității la șoarecii predispuși la obezitate. Experimente pionierate au demonstrat că dietele materne îmbogățite în donatori de metil, precum colină, folat sau metionină, pot duce la modificări epigenetice în expresia genelor la făt, cu impact permanent asupra controlului apetitului și a homeostaziei energetice, care poate fi transmisă de la o generație la alta. 65
Condițiile și stilurile de viață ale părinților, în special obezitatea maternă, foametea în perioadele perinatale, utilizarea suplimentelor nutritive sau a alcoolului sau abuzul de droguri, precum și administrarea agenților terapeutici în această perioadă critică, pot modifica procesele epigenetice cu impact asupra embrionului, a placentei., și creșterea fetală, organogeneza sau punctele de reglare pentru funcțiile sistemului care afectează adipozitatea. 66 Toate aceste interacțiuni mediu-epigenetice au consecințe potențiale asupra sănătății și compoziției corpului generațiilor următoare și următoare prin afectarea reglării genelor mediată epigenetic.
În acest context, cercetătorii au descoperit că sugarii femeilor cu diabet zaharat gestațional au avut măsurători și adipozitate semnificativ mai mari ale pielii și că copiii expuși la malnutriție acută la începutul sarcinii pot avea mai multe șanse să fie obezi în viața ulterioară. 72 Într-adevăr, o serie de experimente au sugerat posibilitatea eredității epigenetice indusă de o dietă bogată în grăsimi, deoarece descendenții mamelor hrănite cu un regim hiperlipidic au avut hiperinsulemie și hiperglicemie, precum și expresii crescute ale genelor LPL și leptină. 73 Aceste descoperiri susțin ideea că semnele epigenetice nu sunt neapărat șterse între generații și că reprogramarea epigenetică ar putea avea loc în timpul gametogenezei și embriogenezei timpurii care afectează expresia genelor, mai ales atunci când sunt influențate de factorii de mediu și nutriționali (Fig. 1). Astfel, s-a sugerat că unele situri metilate supraviețuiesc și apoi sunt reproduse de DNMT atunci când celula se divide, iar acest cod epigenetic este transmis împreună cu histonele asociate. 74
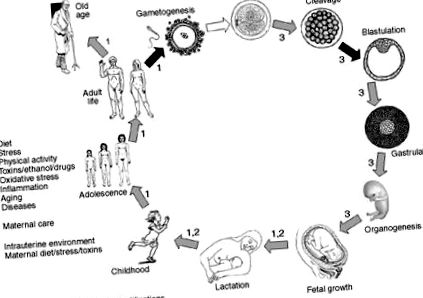
FIG. 1. Perioade de viață în care au fost raportate procese de metilare a ADN-ului. Ștergerea amprentelor de metilare se observă aproape exclusiv în două etape: celulele germinale primordiale și dezvoltarea blastocistului. Îngrijirea mamei, îmbătrânirea și factorii de mediu, cum ar fi componentele dietetice, toxinele și medicamentele, inflamația și, poate, activitatea fizică, ar putea regla procesele de metilare în diferite perioade ale vieții.
Mai mult, s-a emis ipoteza că imprimarea genomică sau moștenirea, în funcție de informațiile epigenetice specifice părinților, pot constitui un mod de a concura pentru resurse în timpul sarcinii, așa cum se afirmă în teoria rudeniei. 75 De exemplu, sindromul Prader-Willi, frecvent asociat cu hiperfagia care duce la obezitate morbidă, este cauzat de subexprimarea genelor la 15q11-q13 care sunt exprimate în mod normal atunci când sunt derivate paternal. Expresia acestor gene imprimate este reglementată de metilarea insulelor CpG în promotorii lor, ale căror marcaje sunt reproduse stabil în timpul diviziunii celulare, dar sunt inversate atunci când sunt moștenite printr-un individ de sex opus. 76
- Maalox - o prezentare generală Subiecte ScienceDirect
- Brânză cu conținut scăzut de grăsimi - o prezentare generală Subiecte ScienceDirect
- Alimentele pentru sugari - o prezentare generală Subiecte ScienceDirect
- Malting - o prezentare generală Subiecte ScienceDirect
- Sarea iodată - o prezentare generală Subiecte ScienceDirect