MJ Devlin
1 Centrul pentru Studii Ortopedice Avansate, Centrul Medical Beth Israel Deaconess și Școala Medicală Harvard, Boston, MA 02215
ML Bouxsein
1 Centrul pentru Studii Ortopedice Avansate, Centrul Medical Beth Israel Deaconess și Școala Medicală Harvard, Boston, MA 02215
Abstract
INTRODUCERE
Începând cu observația că indivizii născuți cu greutate mică la naștere prezintă un risc crescut de boli cardiovasculare [1], există dovezi în creștere că nutriția timpurie influențează sănătatea postnatală. Atât greutatea scăzută la naștere [2-10], cât și greutatea ridicată la naștere [11-14] sunt asociate cu funcția reproductivă și imună redusă și cu o probabilitate semnificativ mai mare de obezitate, ateroscleroză, diabet de tip II și sindromul metabolic la vârsta adultă [15], sugerând că o nutriție slabă intrauterină ar putea fi un factor de risc pentru boala metabolică a adulților [16-17] (Figura 1). De exemplu, copiii femeilor însărcinate în timpul iernii olandeze a foamei din 1944-1945 au avut o incidență crescută a obezității, hiperlipidemiei și aterosclerozei dacă mamele lor au fost afectate de foamete în primul trimestru; rate mai mari de boli pulmonare și renale dacă în timpul celui de-al doilea trimestru; și toleranță redusă la glucoză dacă în timpul celui de-al treilea trimestru de sarcină [18-20]. În comparație, copiii mamelor obeze sau cei născuți mari pentru vârsta gestațională prezintă, de asemenea, un risc crescut de a dezvolta sindromul metabolic în comparație cu copiii născuți la greutatea normală la naștere din mame cu greutate normală, mai ales dacă mamele lor au avut și diabet zaharat gestațional [13]. .
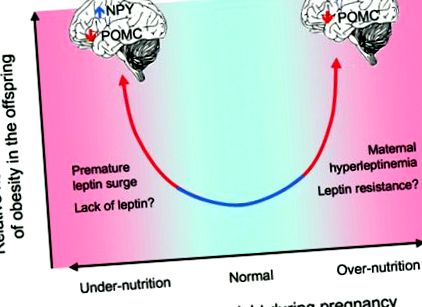
Relația dintre nutriția perinatală și boala metabolică postnatală poate fi în formă de U, cu un risc mai mare de dereglare metabolică atât în subnutriția, cât și în supranutriția perinatală (adaptat din Figura 1 în Grattan, D. R. Endocrinology 2008; 149: 5345-5347).
Deși există un anumit sprijin pentru fiecare dintre aceste ipoteze, ideea că modificările metabolice induse de programarea de dezvoltare perinatală sunt adaptative este ea însăși o ipoteză. După cum subliniază Ellison și Jasienska [31], astfel de răspunsuri de dezvoltare pot fi adaptări, dar pot rezulta și din constrângeri sau modificări patologice ale fiziologiei normale. Astfel, noțiunea că o trăsătură dată este o adaptare este o ipoteză care trebuie testată împotriva ipotezelor alternative că trăsătura a apărut prin patologie sau constrângere. Cea mai riguroasă abordare pentru discriminarea dintre aceste alternative este de a dezvolta predicții falsificabile pentru fiecare ipoteză - adaptare, patologie sau constrângere - care poate fi evaluată în raport cu datele [31]. De exemplu, ne-am putea aștepta la diferite modele de modificări ale dimensiunii corpului descendenților, masei osoase și compoziției corpului ca răspuns la restricția calorică maternă, în funcție de faptul dacă acest răspuns este o adaptare la restricția de energie postnatală, rezultatul unei constrângeri asupra energiei intrauterine. care este eliberat după naștere sau produsul întreruperii patologice permanente a proceselor de creștere (Tabelul 1).
Restricția calorică maternă și dieta maternă bogată în grăsimi pot induce modificări similare în masa osoasă a descendenților prin programarea modificată a circuitelor de hrănire hipotalamică ventromedială, adipozitatea postnatală și activitatea potențial crescută a sistemului nervos simpatic care induce pierderea osoasă. Modificările leptinei periferice pot, de asemenea, să deturneze celulele stem mezenchimale endostale de la osteoblast la linia de adipocite, crescând grăsimea măduvei și scăzând masa osoasă.
COMPOZIȚIA CORPULUI MATERNAL, DIETA ȘI MASA DE OASE PENTRU CĂTRE
Subnutriție
Subnutriția fetală, rezultată din restricția calorică maternă sau din anomaliile placentare care restricționează aportul de sânge fetal, este legată de scăderea masei osoase. Depozitele scăzute de grăsime maternă și exercițiile materne viguroase sunt, de asemenea, asociate cu o masă osoasă neonatală mai mică la om [5], iar sugarii născuți mici pentru vârsta gestațională (SGA) au markeri de fluctuație osoasă mai mici vs. sugari mai mari [55]. Aceste diferențe persistă la vârsta adultă, deoarece indivizii care s-au născut la o greutate foarte mică la naștere au DMO mai mică la antebraț [56] și la coloana lombară și gâtul femural [57] comparativ cu adulții născuți cu greutăți mai mari la naștere. Cu toate acestea, ca și în cazul asocierii generale dintre greutatea la naștere și masa osoasă a adulților descrisă mai sus, efectul greutății scăzute la naștere asupra masei osoase poate reflecta condițiile postnatale și/sau masa corporală redusă a adulților. De exemplu, adulții născuți prematur au DMO mai scăzută vs. adulți născuți la termen complet, dar DMO este adecvată pentru statura lor mai scurtă [58]. În mod similar, greutatea scăzută la naștere este asociată cu pubertatea timpurie la om [59], care poate reduce dimensiunea și masa osoasă a adulților prin încheierea prematură a creșterii scheletice.
Supranutriția
La modelele animale, diabetul matern la șobolani este asociat cu un conținut redus de calciu și o mineralizare scheletică întârziată vs. comenzi [77]. Dieta maternă cu conținut ridicat de grăsimi este frecvent utilizată pentru a induce sindromul metabolic la descendenții rozătoarelor [78-79], deși există date contradictorii privind dacă obezitatea maternă trebuie să fie prezentă înainte de sarcină pentru a induce un fenotip metabolic [80] sau dacă efectele acestuia sunt similare indiferent dacă dieta este pe termen lung sau se limitează la sarcină și alăptare [47]. La șoareci, descendenții barajelor expuse la diete bogate în grăsimi sunt mai scurți, cu masa osoasă totală corporală mai mică în ziua 19 a fătului [81]. Descendenții mamelor hrănite cu o dietă bogată în grăsimi care sunt înțărcați în aceeași dietă bogată în grăsimi au o adipozitate mai mare a măduvei, o masă corporală mai mare și femurele mai scurte, cu dimensiuni ale secțiunii transversale mai mari la vârsta de 30 de săptămâni [82]. Cu toate acestea, nu este clar dacă aceste diferențe vor rămâne după ajustarea pentru greutatea corporală mai mare. În total, în timp ce studiile efectuate pe animale arată în mod constant că dieta maternă bogată în grăsimi duce la un risc crescut de tulburări metabolice la descendenți, efectele asupra sănătății scheletului sunt mai puțin clare.
Aportul de micronutrienți
Aportul matern de micronutrienți poate afecta, de asemenea, sănătatea oaselor descendenților, deși datele sunt dificil de interpretat din mai multe motive. În primul rând, definiția nivelurilor de vitamina D materne „adecvate” în timpul sarcinii rămâne controversată [83]. În al doilea rând, în timp ce unele studii raportează o asociere a nivelurilor de vitamina D la sugari și BMC [84-85], altele nu, chiar și în cazul deficitului de vitamina D extrem. De exemplu, în absența suplimentelor de vitamina D, BMC total al corpului este mai mare la născuții de vară decât la sugarii coreeni născuți în timpul iernii [86]; în SUA, unde suplimentarea cu vitamina D este mai frecventă, BMC este de fapt mai mare la naștere vs. sugari născuți în vară [87-89]. Pe de altă parte, sugarii cu deficit de 1-alfa-hidroxilază sau mutații ale receptorilor de vitamina D, care nu pot sintetiza sau lega vitamina D, au fenotipuri scheletice normale la naștere și pot fi tratați cu calciu, ocolind în totalitate vitamina D și sugerând că nu este esențială. pentru mineralizarea osoasă normală [90]. Astfel, deși s-a raportat că descendenții mamelor cu niveluri de 25-hidroxivitamină D 50 nM/L în timpul sarcinii [91], nu este clar că această asociere implică programarea dezvoltării.
Asocierile dintre sănătatea oaselor postnatale și expunerea intrauterină la alți micronutrienți sunt la fel de modeste. Pentru calciu, un studiu realizat în Gambia nu a raportat nicio diferență în BMC a întregului corp în primul an de viață la sugarii cu suplimente vs. femei nesuplimentate [92]. Cu toate acestea, la femeile din India, aportul de calciu matern în timpul sarcinii este asociat cu o DMO mai mare a descendenților la vârsta de 6 ani [93]. În cele din urmă, în Studiul longitudinal Avon al părinților și copiilor (ALSPAC), consumul matern de magneziu, potasiu și folat în timpul sarcinii este asociat pozitiv cu proprietățile osoase la vârsta de 9 ani, deși numai acesta din urmă rămâne semnificativ după ajustarea dimensiunii corpului [94]. ].
Pentru a rezuma, aceste studii demonstrează că perturbațiile aportului caloric matern și/sau ale compoziției dietetice a macronutrienților în timpul gestației și alăptării au efecte durabile asupra achiziției și întreținerii scheletului descendenților, în special la modelele animale. Cu toate acestea, măsura în care aceste modificări apar prin programare de dezvoltare perinatală sau prin perinatal discordant vs. creșterea somatică postnatală rămâne de determinat, în special la om. Cu toate acestea, atunci când datele umane și animale sunt luate împreună, ceea ce este frapant este că orice dezechilibru din dieta maternă - prea puține calorii, prea multe grăsimi, prea puține proteine - pare să se modifice masa osoasă postnatală și microarhitectură. Expunerea perinatală la restricție de calorii sau la o dietă cu conținut scăzut de proteine este dăunătoare atât pentru osul cortical cât și pentru osul trabecular, în timp ce expunerea la o dietă bogată în grăsimi pare să aibă efecte pozitive și negative complexe asupra diferitelor aspecte ale microarhitecturii trabeculare și corticale, deși sunt necesare mai multe date.
MECANISME CARE POATE SUBTIENE RĂSPUNSUL SCHELETAL LA NUTRIȚIA PERINATALĂ ALTERATĂ
Programarea perinatală a nivelurilor hormonale
În supranutriția maternă, mecanismele implicate în programarea dezvoltării sunt mai puțin clare. În modelele de rozătoare, s-a sugerat că hiperleptinemia neonatală modifică expresia receptorilor de leptină și contribuie la rezistența selectivă a leptinei în nucleul arcuat al hipotalamusului, așa cum se vede în hiperleptinemia postnatală [15]. S-a demonstrat, de asemenea, că dieta bogată în grăsimi promovează creșterea neuronilor care exprimă peptide orexigenice la șobolani [123], care ar putea crește masa de grăsime și, în consecință, nivelul de leptină. Creșterea aportului de grăsimi de către barajele de șobolan în timpul sarcinii târzii și alăptării este asociată cu o masă mai mare de grăsime pentru descendenți și niveluri de leptină la înțărcare, dar niveluri mai scăzute de leptină decât controalele ulterioare [124].
Din păcate, existența și momentul creșterii leptinei perinatale la oameni rămân neclare, deși se pare că nivelurile de leptină fetală sunt ridicate chiar înainte de naștere și scad în prima săptămână de viață. Ceea ce este clar este că subnutriția sau supranutriția perinatală modifică nivelurile de leptină postnatală. Sugarii care se nasc mari pentru vârsta gestațională (LGA) au niveluri de leptină mai mari decât cele normale [125-126], care persistă până în copilărie [127]. În schimb, copiii născuți mici pentru vârsta gestațională (SGA) au niveluri anormal de scăzute de leptină la naștere [128-129] și în copilărie [130]. Mai mult, nivelurile de leptină din laptele matern variază în funcție de dieta maternă și s-a sugerat chiar că această variație - și absența leptinei în formulele pentru sugari - poate contribui la efectul protector al alăptării asupra obezității postnatale [131-132]. Cu toate acestea, posibilele ramificații ale nivelurilor de leptină la achiziționarea scheletului sunt neclare. În timp ce unele studii raportează o asociere pozitivă între dimensiunea scheletului neonatal, densitatea minerală osoasă și nivelurile de leptină din sângele cordonului ombilical [133], altele nu găsesc o astfel de asociere [69].
În timp ce conceptul de programare perinatală a osului este unul interesant, au fost necesare mai multe date pentru a stabili dacă modificările scheletice induse de dieta maternă implică programarea leptinei sau a altor hormoni și pentru a înțelege modul în care interacțiunile nivelurilor de leptină în nivelurile perinatale, lactaționale, și intervalele de timp după înțărcare afectează achiziția și întreținerea scheletului postnatal.
Modificări epigenetice
Modificările epigenetice în expresia genelor, cum ar fi modificarea metilării ADN, au fost implicate într-o gamă largă de boli umane, de la cancer [140] la alergie și astm [141] până la funcția genelor specifice, inclusiv gena receptorului glucocorticoid [142]. Având în vedere potențialul enorm al acestui mecanism de a explica modul în care influențele perinatale ar putea provoca modificări pe tot parcursul vieții în fiziologia descendenților, interesul pentru efectele epigenetice potențiale ale dietei materne asupra masei osoase a descendenților este ridicat. Deși această cercetare se află în stadiile incipiente, există câteva indicii tentante. De exemplu, expunerea la foamete perinatală, ca în iarna olandeză a foamei, a fost asociată cu metilarea modificată a genei IGF2 la vârsta adultă [143], care ar putea influența și masa osoasă.
Printre cele mai interesante observații este că modificările induse de o dietă bogată în grăsimi pot persista pentru mai multe generații prin intermediul mecanismelor epigenetice. Patru generații de șoareci crescuți continuu cu o dietă bogată în grăsimi prezintă o creștere progresivă a masei grase, în ciuda modificărilor în aportul de alimente, împreună cu modificări în expresia genelor, inclusiv factorul 3 de stimulare a coloniei (cunoscut și ca factor de stimulare a coloniei de granulocite) și Nocturnin [149]. Atât șoarecii masculi, cât și femelele expuse la maternitate cu conținut ridicat de grăsimi și/sau supraalimentare în timpul alăptării pot transmite sensibilitate redusă la insulină și lungime corporală crescută descendenților lor prin moștenirea epigenetică [150-151].
Aceste studii oferă un șablon pentru înțelegerea modului în care dieta perinatală ar putea influența metabolismul descendenților și ilustrează importanța mecanismelor epigenetice în moderarea dintre individ și mediu. Marile provocări viitoare vor fi să stabilim dacă reglarea epigenetică are efecte directe asupra masei osoase și microarhitecturii descendenților și dacă modificările epigenetice dăunătoare ar putea fi modificate postnatal pentru a reduce riscul de boală.
ÎNTREBĂRI ȘI DIRECȚII VIITOARE RĂSPUNS
Dieta perinatală maternă poate influența masa osoasă a descendenților prin programarea perinatală a nivelului de leptină, mecanisme epigenetice, cum ar fi metilarea ADN-ului sau alte tipuri de imprimare genomică, sau alte mecanisme, cum ar fi efectele directe asupra diferențierii celulare osoase, proliferării sau expresiei genetice. Ar fi deosebit de utile mai multe date despre natura creșterii leptinei perinatale la om, precum și o mai bună înțelegere a modului în care creșterea leptinei perinatale influențează masa osoasă. Un alt domeniu cheie pentru cercetările viitoare este observația că efectele dietei materne variază în perioada de gestație și alăptare, în special în ceea ce privește dezvoltarea neuronală și programarea circuitelor de hrănire. De exemplu, restricția calorică maternă la șobolani numai în timpul gestației, urmată de o creștere rapidă a recuperării în timpul alăptării, este asociată cu obezitatea și hiperleptinemia, în timp ce descendenții mamelor a căror restricție calorică a continuat prin alăptare nu prezintă aceste anomalii [152]. Înțelegerea importanței relative a dietei în timpul gestației vs. lactația în stabilirea masei osoase postnatale poate arunca o lumină asupra mecanismelor implicate.
În cele din urmă, ipoteza că programarea perinatală a dezvoltării fenotipurilor scheletice este adaptivă ar trebui evaluată într-un cadru riguros de testare a ipotezelor care consideră patologia și constrângerea ca alternative la adaptare [31]. Odată ce mecanismele care stau la baza acestor răspunsuri de dezvoltare au fost stabilite, următorul obiectiv va fi dezvoltarea de strategii pentru îmbunătățirea masei osoase și reducerea riscului de osteoporoză la persoanele afectate.
Mulțumiri
Finanțarea pentru acest proiect a fost asigurată de NIH F32HD060419, T32DK007028 și RC1AR058389.
Note de subsol
Declinarea responsabilității editorului: Acesta este un fișier PDF al unui manuscris neditat care a fost acceptat spre publicare. Ca serviciu pentru clienții noștri, oferim această versiune timpurie a manuscrisului. Manuscrisul va fi supus copierii, compunerii și revizuirii dovezilor rezultate înainte de a fi publicat în forma sa finală citabilă. Vă rugăm să rețineți că, în timpul procesului de producție, pot fi descoperite erori care ar putea afecta conținutul și că toate responsabilitățile legale care se aplică jurnalului se referă.
- Influența polimorfismului genetic Revista de nutriție Oxford Academic
- Master în Nutrition Simmons University
- Master of Science în Nutriție la NSU
- Healing Diets Nutrition Diploma I School of Natural Medicine Int l
- Vindecarea simptomelor intestinale incomode (cauzate de SIBO) cu nutriție personalizată; Hrănește sănătatea;