Filippo Fassio
1 Unitate de alergie și imunologie clinică, Azienda Usl Toscana Centro, Ospedale San Giovanni di Dio, 50143 Firenze, Italia
Maria Sole Facioni
2 AILI - Associazione Italiana Latto-Intolleranti Onlus, 55100 Lucca, Italia; ti.iliaenoizaicossa@etnediserp
Fabio Guagnini
3 Allergy Therapeutics Italia, via IV Novembre 76, 20190 Milano, Italia; ti.orebil@iningaugf
Abstract
1. Introducere
Laptele este o componentă fundamentală a dietei umane, iar valoarea sa nutrițională a fost cheltuită cu o mie de ani de utilizare constantă în nutriția umană [1]. Este un tip specific de hrană unic mamiferelor, care este singura hrană pentru sugarii de mamifere din primele luni de viață.
Laptele, pe lângă proteine, grăsimi, vitamine și minerale, conține carbohidrați compuși din lactoză și alte oligozaharide importante care susțin dezvoltarea bacteriilor probiotice, în special a bifidobacteriilor, în intestinul sugarului, pentru a proteja tractul gastro-intestinal al copilului de infecții. Cu toate acestea, este și un aliment complet pentru adulți, deoarece îi lipsesc doar anumite vitamine și fier [1].
Cu toate acestea, nu toată lumea poate tolera acest tip de mâncare, mai ales la vârsta adultă. Intoleranța la lactoză este o afecțiune clinică cunoscută încă de pe vremea lui Hipocrate (460-370 î.e.n.) și Galen (129-200 CE), care au observat că unii indivizi au prezentat simptome de boli gastrointestinale după ce au băut lapte [2,3]. Cu toate acestea, tocmai în ultimii 50 de ani intoleranța la lactoză a fost recunoscută și analizată științific [2].
În prezent, intoleranța la lactoză este definită ca un sindrom clinic caracterizat prin durere și distensie abdominală, flatulență și diaree care apare după consumul de lactoză; aceasta trebuie distinsă de maldigestia lactozei (digestia ineficientă a lactozei din cauza deficitului de lactază) și malabsorbția, care pot fi și condiții subclinice [3].
2. Mecanismul molecular al mal digestiei și malabsorbției lactozei
Laptele conține un anumit tip de zahăr: lactoza. Lactoza este o dizaharidă care se găsește numai în laptele de mamifer și în derivații săi, deoarece este sintetizată în glanda mamară de sistemul lactozei sintetază, care leagă o moleculă de D-galactoză de o moleculă de D-glucoză cu o legătură glicozidică β-1,4 [1].
Lactoza este o dizaharidă atât de obișnuită în alimentația umană încât uităm adesea cât de „exotic” este un compus; în afară de produsele lactate, îl putem găsi doar la specii de plante extrem de rare [4].
Din punct de vedere biochimic, metabolismul lactozei prezintă unele particularități interesante; galactoziltransferaza umană (subunitatea A a lactozei sintetaze) nu are suficientă afinitate pentru glucoză pentru a permite sinteza lactozei. Are nevoie de subunitatea B pentru ca enzima să accepte glucoza și la femei; trebuie să apară ajustări hormonale (creșterea prolactinei și scăderea progesteronului) pentru a permite sinteza lactozei [4].
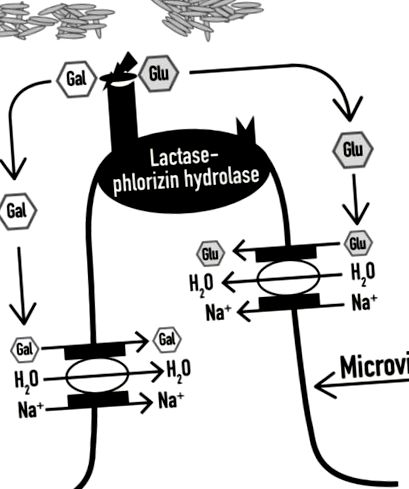
Digestia lactozei are nevoie de o enzimă specializată, denumită în mod obișnuit lactază. Lactaza este o β-galactozidază care poate fi găsită pe suprafața superioară a enterocitelor de pe microvilii intestinului subțire și este exprimată la maxim în jejunul mediu (unde concentrația bacteriană este scăzută și, prin urmare, are loc o fermentație mică). Hidrolizează o moleculă de lactoză în două monozaharide, glucoza și galactoza, care, după digestie, sunt absorbite rapid de enterocite și apoi utilizate; glucoza este utilizată ca sursă de energie, în timp ce galactoza este utilizată ca parte a glicoproteinelor și glicolipidelor (Figura 1) [1]. În cazul deficitului de lactază, dizaharida nu este digerată corect (maldigestie de lactoză) și, prin urmare, nu poate fi absorbită într-o formă nedigerată (malabsorbție a lactozei) și este fermentată de microbiota intestinală.
În prezența unei cantități adecvate de lactază, lactoza este hidrolizată în galactoză (Gal) și glucoză (Glu), care sunt absorbite rapid în fluxul sanguin, împreună cu molecule H2O (modificate din [5]).
Expresia lactazei este programată să se schimbe în timp; deja în a opta săptămână de gestație, lactaza este prezentă pe toată membrana mucoasă a intestinului subțire; apoi, activitatea sa crește până la a 34-a săptămână și atinge apogeul la naștere [6]. După primele câteva luni de viață, activitatea lactazei începe să scadă, uneori până când dispare. La om, o parte considerabilă a populației menține activitatea lactazei la vârsta adultă, în timp ce la alte mamifere, menținerea activității lactazei este neobișnuită [6].
Într-adevăr, domesticirea bovinelor a promovat laptele ca produs alimentar pentru hrana adulților. Acest lucru a fost posibil doar prin doi factori cheie suplimentari, și anume, domesticirea concomitentă a bacteriilor lactice, care fermentează lactoza nedigerabilă în acid lactic ușor de absorbit și mutația la persistența lactazei la adulți din societățile lactate [4]. Acest ultim fenomen s-a produs mai ales la populațiile nord-europene și la moștenitorii acestora, care au o rată foarte scăzută de intoleranță la lactoză în comparație cu populațiile sud-europene sau asiatice [7].
Trebuie subliniat faptul că, din punct de vedere funcțional, pentru o digestie adecvată a lactozei, este suficientă prezența a 50% din activitatea normală a lactazei [1].
3. Context genetic și biochimic
Din punct de vedere zoologic, mamiferele se disting prin două trăsături tipice, prezența firelor de păr, care asigură izolație termică și producția de lapte [8].
Clasificarea mamiferelor în sine se referă de fapt la glanda mamară. Alăptarea are multe avantaje în comparație cu alte metode de hrănire, deoarece laptele este un fel de aliment care s-a dezvoltat pentru a oferi cel mai bun sprijin nutrițional sugarului [4].
Enzima intestinului subțire lactază (numită și lactază-florizin hidrolază) este formată din 1927 aminoacizi, este codificată de gena lactază (LCT) pe firul scurt al cromozomului 2 (2q.21-22) [9] și are două activități enzimatice: o activitate lactază hidrolază și o activitate florizin hidrolază. Lactaza este responsabilă de hidroliza lactozei în glucoză și galactoză, care poate fi apoi absorbită peste epiteliul intestinal (Figura 1). Activitatea lactazei clivează și alte substraturi (celobioză, celotrioză, celotetroză și, într-o anumită măsură, celuloză), în timp ce activitatea florizin hidrolazei împarte beta-glicozidele cu lanțuri alchil hidrofobe mari [7].
În populațiile caucaziene, persistența sau non-persistența exprimării lactazei este strict asociată cu polimorfismul nucleotidic unic (SNP) C/T -13910 situat în amonte de gena codificatoare LCT (rs4988235) (Figura 2) [10]. Acest polimorfism apare în variantele CC, CT sau TT [11]. S-a demonstrat că la caucazieni, varianta CC este excelentă ca predictor al declinului lactazei intestinale și, prin urmare, este asociată cu hipolactazie, în timp ce genotipul TT este un predictor al persistenței activității lactazei. Prezența genotipului CT se caracterizează prin prezența nivelurilor intermediare de exprimare a lactazei, care sunt de obicei adecvate pentru digestia lactozei. Deoarece malabsorbția lactozei este o afecțiune recesivă, un genotip heterozigot trebuie considerat un rezultat negativ al testului [10]. S-a demonstrat că majoritatea ARNm lactazei prezente la indivizii heterozigoți cu activitate lactază persistentă provine dintr-o singură alelă, ceea ce este în concordanță cu starea lor heterozigotă. Acest rezultat este foarte informativ, deoarece demonstrează în mod clar că hipolactazia de tip adult este cauzată de o silențiere transcripțională cu acțiune cis a genei lactazei și că alelele individuale ale lactazei sunt reglate independent [12].
Unele dintre cele mai importante polimorfisme nucleotidice unice din gena lactazei (modificate din [13]).
Există alte polimorfisme care au fost identificate în gena LCT și în regiunile înconjurătoare, cum ar fi G/A -22018, care este legată de mai mult de 95% din non-persistența activității lactazei în populația finlandeză, dar testele de rutină sunt încă nu este disponibil pe scară largă pentru aceste variante [9].
Pe de altă parte, persistența lactazei este mediată de mai multe polimorfisme la diferite populații (G -13915 în Arabia Saudită și G -14010, G -13915 și G -13907 în triburile africane); astfel, persistența lactazei pare să se fi dezvoltat independent în diferite zone ale lumii în timpul evoluției umane (Figura 2) [6].
Enzima lactază este oprită într-o etapă de dezvoltare precis temporizată. În acest fel, malabsorbția lactozei este utilă în promovarea înțărcării la tineri și a ovulației la mamă, iar sistemul lactoză-lactază poate regla astfel distanța optimă la naștere la mamiferele terestre [4].
4. Hipolactazie, mal digestie la lactoză, malabsorbție și intoleranță
Termenul de hipolactazie se referă la deficiența enzimei lactază; acest lucru duce la malabsorbția lactozei, care este definită ca o digestie ineficientă a dizaharidei, care, la rândul său, poate duce la intoleranță la lactoză, o afecțiune clinică definită ca prezența simptomelor gastro-intestinale datorită malabsorbției lactozei (Tabelul 1) [3,14 ].
tabelul 1
Definiția hipolactaziei, a non-persistenței lactazei, a malabsorbției la lactoză și a intoleranței la lactoză (modificată din [14]).
| Hipolactazia | Orice deficiență a enzimei lactază |
| Non-persistența lactazei | Aceasta este considerată condiția „de tip sălbatic”, deoarece majoritatea indivizilor au redus activitatea lactazei la limita jejunală după înțărcare. La o minoritate de oameni, un nivel ridicat de activitate al enzimei lactază este prezent până la vârsta adultă (fenotip de persistență a lactazei) |
| Maldigestie de lactoză | Digestie ineficientă a lactozei, din cauza deficitului de lactază (fie persistența lactazei, fie alte afecțiuni intestinale) |
| Malabsorbția lactozei | Absorbție ineficientă a lactozei, din cauza mal digestiei lactozei, deoarece lactoza nu poate fi absorbită sub formă nedigerată |
| Intoleranță la lactoză | Simptome gastrointestinale datorate malabsorbției lactozei |
Deficitul de lactază există ca:
Deficitul congenital de lactază (alactasia), care este extrem de rar, se datorează moștenirii a 2 alele defecte ale genei LCT. Copilul poate suferi de diaree apoasă după ce a fost hrănit cu lapte matern sau alimente care conțin lapte și poate deveni o afecțiune severă, deoarece lipsa de ingrediente nutritive poate duce la întârzieri de creștere, deshidratare și alcaloză; sugarii cu deficit congenital de lactază nu se așteptau să supraviețuiască înainte de secolul al XX-lea, când înlocuitorii de lapte adecvați fără lactoză nu erau ușor accesibili [15]
Deficitul primar de lactază (hipolactazia de tip adult) este cauzat de non-persistența lactazei, nivelurile de enzime scăzând progresiv începând cu vârsta de 2-5 ani, în funcție de etnie [15]
Hipolactazia secundară implică pierderea enzimei lactazei din cauza altor afecțiuni clinice care afectează tractul intestinal. Deoarece această enzimă se găsește pe vârful vilei duodenale, toate condițiile patologice care implică microviliții pot duce la reducerea lactazei. Odată rezolvată problema principală, produsele care conțin lactoză pot fi adesea consumate normal. Condițiile clinice care duc la hipolactazie secundară includ [5,15,16]:
boli inflamatorii intestinale (boala Crohn, colită ulcerativă)
enterită bacteriană sau virală (de exemplu, rotavirus) și boală parazitară (de exemplu, giardioză, criptosporidioză)
unele tratamente farmacologice (kanamicină, neomicină, polimicină, tetraciclină, colchicină și alte medicamente chimioterapeutice)
unele afecțiuni post-chirurgicale, cum ar fi sindromul buclei stagnante sau sindromul intestinului scurt
5. Epidemiologia intoleranței la lactoză
Non-persistența enzimei lactazei determinată genetic are o prevalență variabilă, care depinde puternic de grupul etnic, deoarece este mult mai răspândită în populația sud-europeană decât în populația nord-europeană.
În nordul Europei Centrale, fenotipul de non-persistență al lactazei se găsește între 2% și 20% din populația generală, în timp ce reprezintă aproximativ 40% din populația țărilor mediteraneene (este cel mai frecvent în Italia, unde se găsește, în medie, la 56% din populație și unde se estimează că atinge vârfuri de până la 70% în unele regiuni), 65-75% într-o mare parte a Africii și până la peste 90% în Asia [17, 18]. Cu toate acestea, numai persoanele cu lactază nepersistentă prezintă simptome de intoleranță la lactoză și semne clinice [14].
Cu toate acestea, în mod surprinzător, având în vedere prevalența ridicată a deficitului de lactoză la vârsta adultă, chiar și acum, intoleranța la lactoză reprezintă o problemă sub-diagnosticată, care este adesea examinată după o întârziere marcată în comparație cu debutul simptomelor. Acest fapt este și mai surprinzător dacă este comparat cu atenția acordată altor afecțiuni care implică reacții adverse la alimente, cum ar fi boala celiacă și alergiile alimentare, care afectează cumulativ doar 5% din populația adultă în ansamblu.
6. Manifestări clinice
După cum sa menționat deja, o deficiență a enzimei lactază duce la malabsorbție a lactozei, deoarece dizaharida nu poate fi absorbită într-o formă nedigerată și este fermentată prin microbiota intestinală [5]. Acest lucru, la rândul său, duce la dezvoltarea simptomelor care constituie starea clinică a intoleranței la lactoză.
La persoanele cu intoleranță la lactoză, simptomele pot fi fie gastrointestinale, fie extraintestinale (Tabelul 2) [3].
masa 2
Cele mai frecvent raportate simptome legate de intestin și sistemice la pacienții cu intoleranță la lactoză (modificat din [3]).
Deoarece simptomele, atât gastrointestinale, cât și sistemice, pot apărea la câteva ore după consumul de alimente care conțin lactoză și deoarece există o distribuție largă a produselor care conțin lactoză (chiar și produse care nu sunt lactate, deoarece lactoza este utilizată ca aditiv alimentar în diferite produse), pacientul cu intoleranță la lactoză nu este întotdeauna capabil să coreleze debutul acestor simptome cu ingestia de lactoză [19].
Mai mult, pragul de toleranță la lactoză variază semnificativ în rândul pacienților și este dependent de mai mulți factori, inclusiv doza de lactoză consumată, expresia reziduală a lactazei, matricea alimentară (ingestia cu alte componente dietetice), timpul de tranzit intestinal și compoziția microbiomului enteric [6] . Deși expresia lactazei nu este reglată suplimentar prin ingestia de lactoză, s-a raportat că aportul regulat chiar și de cantități mici de lactoză poate îmbunătăți toleranța prin adaptarea florei intestinale [20].
7. Diagnosticul
Inițial, diagnosticul de hipolactazie la vârsta adultă se baza pe măsurarea glicemiei serice la 30 de minute după consumul a 50 g lactoză; dacă lactoza a fost digerată și, prin urmare, absorbită, s-a putut observa o creștere a indicelui glicemic la peste 20 mg/100 ml.
Ulterior, a fost dezvoltată măsurarea activității enzimatice în fragmente bioptice ale membranei mucoase a intestinului subțire. Cu toate acestea, în prezent, această tehnică este rar utilizată datorită impactului invaziv și costului ridicat, precum și a faptului că poate fi influențată de distribuția neregulată a lactazei în membrana mucoasă a intestinului subțire [12].
Testul de respirație cu hidrogen (HBT) după administrarea orală de lactoză este considerat în prezent standardul de aur pentru diagnosticul de intoleranță la lactoză datorită sensibilității și specificității sale ridicate, simplității și non-invazivității sale și costului său redus. Se bazează pe măsurarea cantității de hidrogen expirat și recoltat în probe la fiecare 30 de minute după administrarea orală de lactoză (de obicei 25 g, corespunzând la aproximativ 500 ml de lapte). Lactoza neabsorbită din colon este fermentată prin microbiota intestinală cu producția consecventă de hidrogen, care este parțial excretat prin sistemul respirator. HBT este pozitiv atunci când nivelul de hidrogen din aerul expirat este cu cel puțin 20 de părți pe milion mai mare decât valoarea inițială.
În studiile anterioare, HBT a arătat o sensibilitate de 76-100% și o specificitate de 90-100% [21,22].
Cu toate acestea, trebuie luate în considerare rezultatele fals negative datorate lipsei producției de hidrogen de către flora bacteriană colică sau administrarea recentă de antibiotice și, de asemenea, rezultatele fals pozitive datorate prezenței creșterii bacteriene a intestinului subțire (SIBO). Pentru a crește precizia testului, se recomandă evitarea antibioticelor în cele patru săptămâni precedente, consumarea carbohidraților complecși în ziua precedentă și abținerea fumatului și a activității fizice în ziua testului. Acordarea atenției la o creștere rapidă a hidrogenului (în primele 90 de minute de la începutul HBT) poate ajuta la identificarea pacienților cu SIBO [23].
Prezența simptomelor subiective în timpul HBT poate fi utilă pentru confirmarea diagnosticului, dar nu poate înlocui HBT, deoarece atunci când este considerată singură, prezența simptomelor are sensibilitate și specificitate scăzute pentru diagnosticul de intoleranță la lactoză [6]; în același timp, unii pacienți nu își asociază simptomele de intoleranță la lactoză cu aportul de lactoză sau - în multe cazuri - cu orice fel de alimente [24].
Pentru un diagnostic diferențial între hipolactazia primară și secundară, este necesară determinarea prezenței SNP C/T -13910; în populația caucaziană, prezența acestui polimorfism poate fi utilizată și în intoleranța la lactoză în scopuri diagnostice, deoarece a demonstrat sensibilitate marcată (97%) și specificitate (95%) comparativ cu cele ale HBT [25].
Din acest motiv, acest tip de test efectuat pe celulele de clivaj ale mucoasei bucale obținut printr-un tampon simplu (sau chiar cu un test de sânge) poate fi considerat o alternativă la testul de respirație care necesită mult timp și mai dificil la pacienții cu tract gastrointestinal. simptome după consumul de alimente care conțin lactoză [25].
O comparație a testelor de diagnostic pentru intoleranță la lactoză/malabsorbție este prezentată în Tabelul 3 .
Tabelul 3
Compararea caracteristicilor testelor disponibile în prezent pentru evaluarea malabsorbției/intoleranței la lactoză (modificat din [6]).
- MS Nikolay Nekrasov Itinerar, poziția actuală, revizuirea navei CruiseMapper
- Intoleranță la lactoză și alergie la proteinele din lapte SpringerLink
- Joel Marion; s 14 zile Keto Challenge - Contra pro; O revizuire cuprinzătoare a resursei dietetice ketogene
- Intoleranță la lactoză (holistică) PeaceHealth
- Intoleranță la lactoză American Gastroenterological Association