Anna Lynnyk
1 Institutul de Fizică al Academiei Cehe de Științe, Praga, 18221, Republica Cehă
Maria Lunova
1 Institutul de Fizică al Academiei Cehe de Științe, Praga, 18221, Republica Cehă
2 Institutul de Medicină Clinică și Experimentală (IKEM), Praga, 14021, Republica Cehă
Milan Jirsa
2 Institutul de Medicină Clinică și Experimentală (IKEM), Praga, 14021, Republica Cehă
Daria Egorova
3 Universitatea ITMO, St. Petersburg, 197101, Rusia
Andrei Kulikov
3 Universitatea ITMO, St. Petersburg, 197101, Rusia
Šárka Kubinová
1 Institutul de Fizică al Academiei Cehe de Științe, Praga, 18221, Republica Cehă
4 Institutul de Medicină Experimentală din Academia Cehă de Științe, Praga, 14220, Republica Cehă
Oleg Lunov
1 Institutul de Fizică al Academiei Cehe de Științe, Praga, 18221, Republica Cehă
Alexandr Dejneka
1 Institutul de Fizică al Academiei Cehe de Științe, Praga, 18221, Republica Cehă
Abstract
Iradierea cu lumină roșie cu laser de mică putere a fost recunoscută ca un instrument promițător într-o mare varietate de aplicații biomedicale. Cu toate acestea, o înțelegere profundă a mecanismelor moleculare din spatele efectelor celulare induse de laser rămâne o provocare semnificativă. Aici, am investigat mecanismele implicate în procesul morții în linia celulară hepatică umană Huh7 la o iradiere cu laser. Am decuplat căi distincte de moarte celulară vizate de iradieri cu laser de diferite puteri. Datele noastre demonstrează că iradierea cu doză mare a laserului a prezentat cele mai ridicate niveluri de producție totală de specii reactive de oxigen, ducând la necroza asociată ciclofilinei D prin tranziția permeabilității mitocondriale. Dimpotrivă, iradierea cu doză mică a laserului a dus la acumularea nucleară de superoxid și execuția apoptozei. Descoperirile noastre oferă o nouă perspectivă asupra răspunsurilor celulare induse de laser și dezvăluie căi distincte de moarte celulară declanșate de iradierea cu laser. Legătura observată între depolarizarea mitocondriilor și declanșarea ROS ar putea fi un fenomen fundamental în răspunsurile celulare induse de laser.
1. Introducere
2. Materiale și metode
Proiectarea și caracterizarea sistemului laser
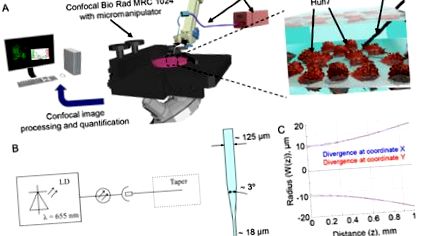
Caracterizarea sistemului laser. (A) Configurare experimentală. (B) Schema sistemului laser. LD - diode laser. (C) Divergența fasciculului laser.
Cultură de celule
Linia celulară de carcinom hepatocelular uman Huh7 obținută din Colecția Japoneză de Bioresurse de Cercetare (JCRB) au fost cultivate în mediu EMEM (American Type Culture Collection, ATCC) suplimentat cu 10% ser fetal de vițel (FCS) conform recomandărilor furnizorului. Culturile au fost păstrate într-o atmosferă umidificată de 5% CO2 la 37 ° C și mediul a fost schimbat de două ori pe săptămână.
Tratamentul cu laser
Celulele Huh7 au fost însămânțate în vase de 35 mm pentru culturi de țesuturi IBIDI (IBIDI, München, Germania) cu 24 de ore înainte de iradierea cu laser. În funcție de experiment, celulele au fost etichetate fie înainte de iradiere cu laser, fie imediat după. Poziționarea conectorilor optici în cea mai apropiată celulă a fost efectuată utilizând un micromanipulator Eppendorf (5171, Eppendorf, Wesseling-Berzdorf, Germania) care a fost conectat la un microscop Nikon Diaphot 200 (Nikon, Tokyo, Japonia) (Fig. 1 (A )). Conectorii optici au fost sterilizați cu etanol 75% înainte de poziționarea către celule.
Produse chimice
Au fost utilizate următoarele sonde fluorescente: ROS Cellular/Superoxide Detection Assay Kit (Abcam, Cambridge, Marea Britanie) pentru a detecta generarea de ROS și superoxid; și acetoximetilester de calceină (calceină-AM, 1 μM) și homidimer de etidiu (EthD-1, 4 μM) pentru a monitoriza viabilitatea celulară; JC-1 (2 μM) pentru a monitoriza potențialul membranei mitocondriale și VAD-FMK conjugat la FITC (FITC-VAD-FMK) pentru a detecta activarea caspazei-3. Calcein-AM, homodimerul de etidiu și sondele JC-1 au fost achiziționate de la Thermo Fisher Scientific. Kit-ul de testare celular ROS/Superoxide Detection Assay și FITC-VAD-FMK au fost achiziționate de la Abcam. Pentru a investiga în mod specific ROS mitocondrial, celulele au fost încărcate cu roșu MitoTracker CM-H2XRos (formă redusă de roșu MitoTracker; 0,5 μM; Thermo Fisher Scientific) prin incubarea lor timp de 15 minute. Pata de acid nucleic fluorescent verde SYTO 13 cu permeabilitate celulară (5 μM; Thermo Fisher Scientific) a fost utilizată pentru a marca nucleul. Timpul optim de incubație pentru fiecare sondă a fost determinat experimental.
Au fost utilizați următorii reactivi: ciclosporina A (CsA, 10 uM) pentru a inhiba tranziția permeabilității mitocondriale; necrostatină-1 (Nec-1, 10 uM) ca inhibitor puternic și selectiv al necroptozei; N-acetil-L-cisteină (NAC, 5 mM) pentru eliminarea ROS; staurosporină (STS, 2 μM) ca inductor cunoscut al apoptozei; piocianină (200 μM) ca inductor cunoscut al ROS. Necrostatina-1, ciclosporina A și N-acetil-L-cisteina au fost achiziționate de la Sigma-Aldrich. Staurosporina și piocianina au fost cumpărate de la Abcam. CellMask Deep Red achiziționat de la Thermo Fisher Scientific a fost utilizat pentru colorarea membranei plasmatice.
Măsurarea viabilității celulare
Viabilitatea celulei a fost analizată prin trusă fluorescentă de testare a celulelor vii/moarte (Thermo Fisher Scientific). Acest test de viabilitate a celulelor de fluorescență în două culori se bazează pe capacitatea calceinei AM de a fi reținută în celulele vii, inducând o fluorescență verde uniformă intensă și EthD-1 pentru a lega nucleele celulelor deteriorate, producând astfel o fluorescență roșie aprinsă în celulele moarte. [29]. Pentru analiza cursului temporizat, celulele Huh7 au fost însămânțate în vase de 35 mm de cultură de țesuturi IBIDI (IBIDI, München, Germania) cu 24 de ore înainte de etichetare. Celulele au fost colorate cu calceină-AM (1 μM) și EthD-1 (4 μM) timp de 30 de minute. După marcare, celulele au fost expuse la lumina laserului. Ulterior, imaginile au fost capturate folosind microscopul confocal cu scanare laser Bio-Rad MRC-1024 (Bio-Rad, Cambridge, MA) timp de 50 de minute cu un interval de 2 minute între imagini. Software-ul ImageJ (NIH) a fost utilizat pentru procesarea imaginilor. Intensitatea fluorescenței ambelor coloranți a fost măsurată la punctele de timp respective și a fost normalizată la fluorescența totală la 30 de minute după încărcarea colorantului. Pentru a confirma validitatea colorării vii/moarte au fost, de asemenea, tratați cu etanol 10% timp de 10 min și imagistica ulterioară (datele nu sunt prezentate).
Detectarea speciilor de oxigen reactiv intracelular (ROS)
Testul apoptozei
Apoptoza a fost evaluată prin colorarea anexinei V/iodură de propidiu. Celulele au fost tratate cu diferite fluențe de iradiere a laserului timp de 40 de minute. Expresia fosfatidilserinei, ca semn precoce al apoptozei, a fost determinată prin analiza microscopică cu fluorescență prin legarea anexinei V marcată cu izotiocianat de fluoresceină (Sigma-Aldrich); iodura de propidiu (PI) a fost utilizată pentru a diferenția celulele necrotice. NucRed a fost folosit ca colorare nucleară (Thermo Fisher Scientific). Imaginile de fluorescență au fost înregistrate folosind un microscop confocal cu scanare laser Bio-Rad MRC-1024 (Bio-Rad, Cambridge, MA). Software-ul ImageJ (NIH, Bethesda, MD) a fost utilizat pentru procesarea imaginilor și cuantificarea micrografiei fluorescente. Fluorescența PI și anexina V au fost calculate prin normalizarea fluorescenței celulare totale corectate (CTCF) din întreaga zonă de interes până la fluorescența medie a regiunii. Intensitatea medie CTCF netă a unui pixel din regiunea de interes a fost calculată pentru fiecare imagine utilizând o metodă descrisă anterior [35].
Testul activității Caspase-3
Ca parametru de apoptoză, activarea caspazei-3 a fost detectată utilizând inhibitorul caspazei-3 VAD-FMK conjugat la FITC (FITC-VAD-FMK) ca marker. FITC-VAD-FMK este permeabil la celule, netoxic și se leagă ireversibil de caspazele activate din celulele apoptotice. După 40 de minute după iradierea cu laser, celulele au fost încărcate cu FITC-VAD-FMK (Abcam, Cambridge, Marea Britanie) conform instrucțiunilor producătorului. După colorare, celulele au fost fotografiate folosind un microscop epifluorescent IM-2FL (Microscoape optice, Ponteranica (BG), Italia). Intensitatea fluorescenței a fost măsurată utilizând software-ul ImageJ (NIH). Ca martor pozitiv, celulele au fost tratate cu staurosporină 2 μM timp de 3 ore.
Cuantificarea potențialului membranei mitocondriale
Detectarea speciilor de oxigen reactiv mitocondrial (Mito-ROS)
Microscopia confocală a culturii celulare a fost efectuată folosind un microscop Nikon Diaphot 200 (Nikon, Tokyo, Japonia) în combinație cu sistemul de imagistică cu scanare laser confocal Bio Rad MRC-1024 (Bio-Rad, Cambridge, MA). Celulele au fost încărcate cu 5 SYM SYTO 13 verde (Ex: 490 nm, Em: 516 nm) și 0,5 µM MitoTracker roșu CM-H2XRos (Ex: 579 nm, Em: 599 nm) timp de 15 minute la 37 ° C în întuneric, și apoi iradiat cu laser de 1 mW timp de 40 de minute. Software-ul ImageJ (NIH) a fost utilizat pentru procesarea imaginilor și cuantificarea micrografică fluorescentă. Intensitatea fluorescenței celulare a fost calculată prin normalizarea fluorescenței celulare totale corectate (CTCF) din întreaga zonă de interes la fluorescența medie a celulei unice. Intensitatea medie CTCF netă a unui pixel din regiunea de interes a fost calculată pentru fiecare imagine utilizând o metodă descrisă anterior [38].
Microscopie confocală
Microscopul Nikon Diaphot 200 (Nikon, Tokyo, Japonia) în combinație cu sistemul de imagini cu scanare laser confocal Bio Rad MRC-1024 (Bio-Rad, Cambridge, MA) au fost utilizate în această lucrare pentru vizualizarea celulelor. Micromanipulatorul Eppendorf 5171 (Eppendorf, Wesseling-Berzdorf, Germania), conectat la microscopul Nikon Diaphot 200 (Nikon, Tokyo, Japonia), a fost utilizat pentru poziționarea precisă a conicității. Imaginile de fluorescență au fost realizate odată cu achiziționarea software-ului Lasersharp 2000 v5.2 (BioRad, Hercules, CA). Software-ul ImageJ (NIH) a fost utilizat pentru procesarea și cuantificarea imaginilor.
analize statistice
Deteriorarea acută cu laser a liniei celulare Huh7
Pentru a determina efectul iradierii cu laser asupra viabilității celulare am folosit setul de viabilitate/citotoxicitate LIVE/DEAD, care este un test rapid și ușor în două culori pentru a determina viabilitatea celulelor [29, 45]. Această analiză discriminează rapid celulele vii de cele moarte prin colorarea simultană cu calceina-fluorescentă verde-AM pentru a indica activitatea esterazei intracelulare și a homidimer-1 de etidiu fluorescent roșu pentru a indica pierderea integrității membranei plasmatice [29, 45]. În conformitate cu rapoartele anterioare, iradierea cu laser roșu a afectat semnificativ viabilitatea Huh7 în primele 40 de minute de expunere (Fig. 2 (A)). Deteriorarea celulelor cauzate de expunerea la laser a arătat o zonă tipică de deteriorare roșie (celule moarte). Important, doar iradierea continuă cu laser roșu a indus toxicitate acută a celulelor Huh7, în timp ce configurarea imaginii nu a afectat viabilitatea celulelor de control (Fig. 2 (A), (Vizualizare 1), (Vizualizare 2). La o putere mai mică, lumina laserului s-a dovedit a fi să fie mai puțin citotoxic pentru Huh7 (Fig. 2 (B)). În general, fasciculul laser într-o soluție apoasă datorită divergenței era de aproximativ
40 microni (Fig. 1C). Mai multe celule au fost iradiate simultan. Astfel, am analizat cu atenție distribuția neuniformă a intensității laserului de la ieșirea fibrei (Fig. 2 (C)). Celulele din diferite zone din interiorul punctului laser au experimentat iradiere diferită, ceea ce a dus la un răspuns celular neuniform (Fig. 2 (C)). Într-adevăr, după
S-a produs o saturație de 30 de minute și toate celulele iradiate la fața laserului au avut aproximativ aceeași stare de deteriorare a celulei (Vizualizare 2). Aceste experimente cinetice au fost cruciale pentru a afla un interval de timp adecvat pentru analiza ulterioară a evenimentelor moleculare declanșate de iradierea cu laser.
Tratamentul cu doze mari cu laser induce necroza celulelor Huh7
Având în vedere faptul că hepatocitele au un număr mare de mitocondrii și mitocondriile joacă un rol crucial atât în moartea celulară necrotică, cât și în cea apoptotică [24, 25], am emis ipoteza că s-ar putea comuta între tipuri distincte de moarte celulară folosind iradiere cu laser roșu. Pe baza acestor considerații, am explorat inducerea morții celulelor necrotice la o putere laser mare, adică 1 mW.
În primul rând, am investigat dacă toxicitatea celulară indusă de laser de mare putere este determinată de o posibilă creștere a temperaturii. Am suplimentat mediul de creștere al celulelor Huh7 cu glicerol 1 M. S-a demonstrat în mod repetat că adăugarea de glicerol la mediu protejează celulele de moartea provocată de căldură [46, 47]. Într-adevăr, suplimentarea cu glicerol 1 M nu a protejat de citotoxicitatea acută indusă de laser (Fig. 4 (A)). Dimpotrivă, glicerina a fost eficientă în protejarea morții celulare indusă de încălzirea la 45 ° C (Fig. 4 (A)). Aceste date sugerează că citotoxicitatea acută indusă de laser nu este legată de efectele de încălzire macroscopice. Rezultatele noastre confirmă alte studii publicate anterior care arată că o astfel de putere laser (și densitate de putere) este puțin probabil să inducă vreo deteriorare termică a celulelor [3, 42]. Mai mult, am măsurat coeficientul de absorbție al sistemului tampon fiziologic. Coeficientul de absorbție a fost 0,03598 1/cm la 655 nm lungime de undă. Datorită coeficientului de absorbție atât de mic, se poate concluziona că soluția tampon este încălzită într-o măsură minimă de o astfel de radiație laser. Prin urmare, putem exclude efectul încălzirii locale ca efect potențial al iradierii cu laser asupra celulelor vii.
Iradierea cu laser cu doză mare (1 mW) induce moartea celulelor necrotice ale celulelor Huh7. (A) Viabilitatea celulei a fost detectată de setul de testare a celulelor vii/moarte fluorescente Thermo Fisher Scientific. Mediul de creștere complet cu glicerol 1 M a fost folosit ca termoprotector. Celulele au fost imaginate și analizate ca în Fig. 2. Datele sunt exprimate ca medii ± SEM (n = 3), ** P ### P Fig. 4 (B)). În schimb, o creștere concomitentă a permeabilității membranei, așa cum se arată prin excluderea iodurii de propidiu (Fig. 4 (B)), a fost efectul predominant. Într-adevăr, colorarea dublă a anexinei V-PI a sugerat că iradierea cu laser a indus moartea celulelor apoptotice sau necrotice în stadiul târziu (Fig. 4 (B)). În plus, pentru a confirma că iradierea cu laser (1 mW) nu induce apoptoza, am efectuat testul de activitate caspază-3 (Fig. 4C). Caspaza-3 este un călău al apoptozei, iar activarea acestuia constituie modificări morfologice ireversibile caracteristice procesului apoptotic, cum ar fi degradarea ADN-ului, condensarea cromatinei și sângerarea membranei [48]. Analiza activării caspazei-3 în celulele tratate cu laser cu fluență ridicată a arătat că iradierea cu laser nu a indus moartea celulelor apoptotice în Huh7 (Fig. 4 (C)). Este demn de remarcat aici că tratamentul cu staurosporină (un bine-cunoscut compus care induce apoptoza) a dus la activarea caspazei-3 (Fig. 4 (C)) și translocarea fosfatidilserinei la prospectul membranei celulare externe (Fig. 4 (B)) .
Tratamentul cu doză mică cu laser are ca rezultat apoptoza celulelor Huh7
Pentru a valida în continuare posibilitatea declanșării diferitelor cascade biochimice prin aceeași iradiere a luminii laser, ne-am concentrat asupra răspunsurilor celulare declanșate de iradierea cu laser de mică putere, adică 46 µW. Analiza Huh7 tratată cu laser cu putere redusă a confirmat expresia anexinei V pe membrana celulară înainte de creșterea permeabilității membranei celulare (Fig. 5 (A)). În plus, analiza activării caspazei 3 în celulele tratate cu laser de 46 µW a arătat că, într-adevăr, o doză mai mică de iradiere cu laser a indus moartea celulelor apoptotice, ceea ce a fost evident deja la 30 de minute după expunerea la laser (Fig. 5 (B)). Important, o doză mai mică de iradiere cu laser a dus la disiparea treptată a potențialului membranei mitocondriale, care a fost semnificativ mai mică în comparație cu o doză mare de iradiere cu laser, după cum se evaluează prin colorarea JC-1 (Fig. 5 (C)).
Important, la iradierea cu doză mică a laserului există o acumulare semnificativ mai mare de anion superoxid în nucleul celulei (Fig. 7 (A, B)) în comparație cu iradierea cu doză mare. În măsura în care acumularea de superoxizi nucleari este responsabilă pentru rupturile de ADN dublu-catene [63] și astfel de rupturi duc la executarea apoptozei [64], devine evident de ce diferite doze de iradiere cu laser declanșează căi biochimice distincte de moarte celulară. Mai mult, în ultimii ani a devenit din ce în ce mai clar că modificările oxidative și reductive sunt limitate într-un mod spațio-temporal [77]. Prin urmare, diferite doze de iradiere cu laser au ca rezultat o compartimentare intracelulară a ROS care, la rândul său, poate duce la inițierea unor cascade biochimice distincte.
5. Concluzii
Pe scurt, am demonstrat că tratamentul celular cu diferite doze de iradiere cu laser a dus la activarea semnalizării biochimice distincte care declanșează căile de moarte celulară. Prin urmare, citotoxicitatea terapiilor pe bază de laser roșu ar trebui luată în considerare cu atenție în practica clinică. Mai mult, am arătat că ROS N-acetil-L-cisteină scavenger a redus citotoxicitatea cauzată de producția de ROS indusă de iradierea cu laser. Acest lucru indică faptul că suplimentarea alimentară cu antioxidanți ar putea fi o strategie adecvată pentru a reduce daunele oxidative induse de lumina laserului.
- Sindromul de activare a mastocitelor (partea 3) Rolul nutriției și stresului - Pentru o pace digestivă a
- ACTIVITATEA HIPOGLICEMICĂ ȘI HIPOLIPIDEMICĂ A ARGININEI CARE CONȚINE FRUNZE DE EXPRIM IN INSULINĂ
- Performanțe umane maxime Pastile diuretice de apă Xpel
- Compoziția nutrițională a cărnii și rolul nutritiv în dieta umană - ScienceDirect
- Am trăit pe pragul sărăciei