Yuze Wang
Departamentul de Ortopedie, al doilea spital al Universității medicale Shanxi, 382 Wuyi Road, Taiyuan, 030001 Republica Populară Chineză Shanxi
Lei Wei
Departamentul de Ortopedie, al doilea spital al Universității medicale Shanxi, 382 Wuyi Road, Taiyuan, 030001 Republica Populară Chineză Shanxi
Departamentul de Ortopedie, Școala Medicală Warren Alpert a Universității Brown/Spitalul Rhode Island, Suite 402A, 1 Hoppin Street, Providence, RI 02903 SUA
Lingyuan Zeng
Departamentul de Ortopedie, al doilea spital al Universității medicale Shanxi, 382 Wuyi Road, Taiyuan, 030001 Republica Populară Chineză Shanxi
Dongdong He
Departamentul de Ortopedie, al doilea spital al Universității medicale Shanxi, 382 Wuyi Road, Taiyuan, 030001 Republica Populară Chineză Shanxi
Xiaochun Wei
Departamentul de Ortopedie, Al doilea spital al Universității medicale Shanxi, 382 Wuyi Road, Taiyuan, 030001 Republica Populară Chineză Shanxi
Laboratorul cheie Shanxi pentru repararea leziunilor osoase și ale țesuturilor moi, 382 Wuyi Road, Taiyuan, 030001 Republica Populară Chineză Shanxi
Date asociate
Abstract
Scop
Pentru a determina importanța lichidului sinovial (SF) sau a măduvei osoase subcondrale (BM) ca surse nutritive în degenerescența cartilajului.
Metode
Iepurii masculi în vârstă de nouăzeci și cinci de luni au fost împărțiți aleatoriu în 5 grupe în funcție de sursele de nutriție: SFBM-ambele; Numai BM; Numai SF; None-SFBM; și mufă gratuită (fără restricții). Nutriția la dopuri osteocondrale cilindrice de 4 mm, create pe trohlea femurului distal, a fost obstrucționată de capacul din clorură de polivinil (PVC). Modificările cartilajului au fost evaluate după 4, 8 și 12 săptămâni prin histologie, imunohistochimie și PCR în timp real.
Rezultate
Cartilajul din grupul numai cu BM a suferit cele mai mari daune, urmat de grupurile None-SFBM și SF-only. Apoptoza a fost crescută numai în grupurile BM și None-SFBM, comparativ cu altele. Cartilajul a fost semnificativ mai subțire în toate punctele de timp în grupurile numai BM și None-SFBM în comparație cu SFBM-ambele și cu mufa Free, în timp ce în grupul numai SF, această diferență a apărut după 8 săptămâni. Comparativ cu SFBM-ambele și cu plugul liber, expresia mARN-urilor de colagen II și aggrecan în toate grupurile a fost scăzută, dar MMP-3 a crescut, respectiv.
Concluzie
Datele noastre indică faptul că nutriția derivată din SF este sursa dominantă de hrană pentru structura și funcția cartilajului adult. Deteriorarea cartilajului este observată atunci când singura sursă nutritivă este BM.
Material suplimentar electronic
Versiunea online a acestui articol (doi: 10.1007/s00167-012-1977-7) conține materiale suplimentare, care sunt disponibile utilizatorilor autorizați.
Introducere
Cartilajul articular este un țesut avascular [15] hrănit de două căi potențiale: difuzie din vasele osoase subcondrale și difuzie din lichidul sinovial. Importanța relativă a acestor căi este controversată [12]. Dovezile colectate au indicat că deficiențele în nutriția cartilajului ar putea fi unul dintre principalele motive pentru degenerarea acestui țesut [10, 14, 15, 25]. Studiile autoradiografice și de trasare la animale au indicat că, deși cartilajul articular imatur poate fi hrănit atât pe căile sinoviale, cât și pe cele subcondrale, cartilajul articular la animalele mature își derivă nutriția exclusiv din lichidul sinovial, din cauza barierei calcificate cu diviziunea subcondrală [21-23] . În afară de acestea, studiile la om efectuate de Maroudas și Bullough [20] au furnizat dovezi care indică faptul că doar la specimenele umane imature substanțele moleculare solubile ar putea pătrunde din cavitatea măduvei în cartilaj. Cu toate acestea, Greenwald și Haynes [9] au folosit tehnologie fluorescentă și trasatoare netoxică pentru a vizualiza mișcarea sângelui în capul femural uman și au observat că substanțele fluorescente din măduva osoasă ar putea pătrunde în țesuturile cartilajului la omul adult [1, 2, 9] .
În timp ce aceste studii sugerează că cartilajul articular poate fi hrănit atât prin căile măduvei osoase subcondrale, cât și pe cele sinoviale, importanța relativă a acestor două căi rămâne incertă. Ipoteza noastră este că atât căile de nutriție din măduva osoasă subcondrală, cât și lichidul sinovial joacă un rol critic în menținerea homeostaziei și funcției cartilajului normal la adulți. Scopul acestui studiu a fost de a determina relația dintre căile nutriționale și degenerarea cartilajului articular. Pentru a determina care dintre căile de nutriție (măduva osoasă subcondrală sau lichid sinovial) joacă un rol critic în menținerea homeostaziei și funcției cartilajului normal la adulți, am lipsit nutriția cartilajului articular numai de SF, BM, sau ambele SFBM, folosind un capac din PVC. Efectele privării de nutriție au fost evaluate în diferite momente de timp prin tomografie brută, analize histologice, imunohistochimie și PCR în timp real.
Materiale și metode
Model animal
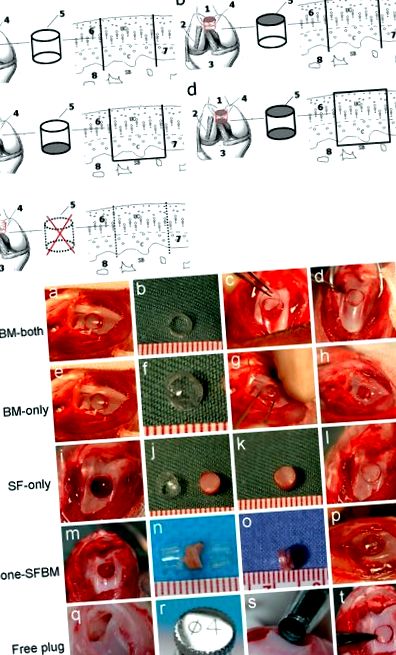
A Diagrama modelului animal. A SFBM-ambele grup (menținerea nutriției atât din SF cât și din BM cu tubul din PVC deschis la ambele capete); b Grup doar BM (nutriție numai BM, cu tubul din PVC blocat la capătul lichidului sinovial); c Grup numai pentru SF (nutriție numai pentru SF, cu tubul din PVC blocat la capătul măduvei osoase); d Grupul None-SFBM (nutriție obstrucționată atât din SF, cât și din BM prin blocarea ambelor capete ale tubului din PVC); e Grup de dopuri gratuite (acces nutrițional nerestricționat prin înlocuirea dopului osteocondral fără a-l înconjura într-un tub din PVC); 1. Femur. 2. Ligament colateral lateral. 3. Tibia. 4. Trohlea femurală. 5. Pahar sau tub din PVC. 6. Cartilaj superficial. 7. Stratul calcificat. 8. Osul subcondral. B Intervenții chirurgicale la animale
A Aspect macroscopic. B Scorul brut a arătat o creștere semnificativă a deteriorării cartilajului în grupurile numai BM și None-SFBM la 4, 8 și 12 săptămâni după operație. Medianele ± Intercartilă (M ± QR) stea P 0,82) și analiza grafică Bland - Altman (în intervalul sau mai mic de ± 1,96 deviație standard), respectiv.
Imuno-histochimie
S-au folosit doar probe de 4 săptămâni pentru colorarea colagenului de tip II (Histostain-SP Kits, Zymed, Carlsbad, CA Cat. # 95-9943) și PCR în timp real, din cauza probelor de cartilaj de 8 și 12 săptămâni fiind prea deteriorate pentru aceste analize, în special în grupul numai cu BM. Secțiunile au fost incubate cu un șoarece monoclonal Ab împotriva colagenului de tip II (20μg/mL; Cat. # Cp18 Calbiochem, Japonia), la 4 ° C peste noapte. Secțiunile de control negativ au fost incubate cu control izotip (25μg/mL; Cat. # MAB002 R&D Systems, Inc., Minneapolis, MN) în 0,01 M PBS. Ulterior, secțiunile au fost tratate secvențial cu anticorp secundar biotinilat gata de utilizare și conjugat streptavidină-peroxidă, urmat de dezvoltare standardizată în DAB. Fotografia a fost realizată cu Olympus BX51.
Analiza TUNEL
Apoptoza a fost examinată folosind kitul de detectare Apop Tag Peroxidase In Situ, conform instrucțiunilor producătorului (nr. Cat. 11684817910; Roche Diagnostics, Basel, Elveția). Secțiunile au fost evaluate de doi observatori orbi folosind un microscop Olympus BX51 la o mărire de 400 ×. Procentul de condrocite colorate pozitiv a fost calculat prin numărarea numărului de celule colorate pozitiv și negativ în fiecare lamă.
PCR în timp real
Probele de cartilaj înghețat (0,5 g) au fost zdrobite la pulbere folosind un mortar și un pistil (n = 3, 6 îmbinări de pe ambele părți). ARN-ul total a fost izolat folosind reactivul Trizol (15596-026, INVITROGEN, Carlsbad, Carlsbad, SUA). Un total de micrograme de ARN a fost transcris invers cu iScript ™ cDNA Synthesis Kit (K1642, FERMENTAS, MARYLAND, SUA). Amplificarea cantitativă în timp real a PCR a fost efectuată utilizând kitul QuantiTect SYBR Green PCR (K0251, FERMENTAS, MARYLAND, SUA). Nivelurile de ARNm au fost normalizate la GAPDH și calculul valorilor ARNm a fost efectuat așa cum s-a descris anterior [29-32]. Valorile pragului de ciclu (Ct) pentru GAPDH și cea a probelor au fost măsurate și calculate utilizând software de calculator (IQ50, Bio-Rad, SUA). Nivelurile relative de transcriere au fost calculate ca x = 2 −ΔΔCt, în care ΔΔCt = ΔE - ΔC și ΔE = Ctexp - CtGAPDH; ΔC = Ctctl - CtG. Exemplele de secvențe utilizate pentru RT-PCR au fost după cum urmează: Col-2 înainte 5'-ACACTGCCAACGTCCAGATG-3 'și invers 5'-GTGAT GTTCTGGGAGCCCTC-3' (> D83228); AGG înainte 5'-TCTACCGCTGTGAGGTGAT GC-3 'și invers 5'-TTCACCACGACCTCCAAGG-3' (> L38480); MMP-13 înainte 5'-ACACCGGATCTGCCAAGAGA-3 'și invers 5'-CTGGAGAACGTGATTGGAGT CA-3' (001082037); GAPDH înainte 5'-GGTGAAGGTCGGAGTGAACG-3 'și invers 5'-AGTTAAAAGCAGCCCTGGTGA-3' (> L23961).
analize statistice
tabelul 1
Grup diferit Scor brut în 4, 8 și 12 săptămâni după operație (M ± QR)
| 4 | 0,0 ± 1,0 | 1,5 ± 1,3 * | 0,5 ± 1,0 | 2,0 ± 1,0 *, ▲ | 0,0 ± 1,0 |
| 8 | 0,0 ± 1,0 | 4,0 ± 1,3 *, ▲ | 1,0 ± 1,3 | 3,5 ± 1,3 *, ▲ | 0,5 ± 1,0 |
| 12 | 1,0 ± 1,0 | 5,5 ± 1,0 *, ▲ | 1,0 ± 2,0 | 4,0 ± 2,3 *, ▲ | 1,0 ± 1,3 |
* P ▲ P 3 A). După cum a fost evaluat de scorul Mankin, cele mai mari leziuni ale cartilajului s-au găsit atât în BM doar (14,0 ± 1,0, P 3 B; Tabelul 2) la 12 săptămâni.
* P # P ## P 3 D-a, b). Cartilajul calcificat a dispărut și cartilajul cu grosime totală s-a pierdut la 12 săptămâni. În unele zone, cartilajul rezidual a fost înconjurat de țesut fibrilal și măduvă osoasă (Fig. 3 D-c).
Imunohistochimie (IHC) a colagenului de tip II
S-a observat o colorare puternică de colagen de tip II în grupurile SFBM-ambele și cu plugul liber. Cu toate acestea, colorarea de colagen de tip II a fost semnificativ mai scăzută în grupurile numai cu BM, urmată de creșteri moderate ale colorării în grupurile None-SFBM și SF-only. Toate grupurile numai BM, None-SFBM și numai SF au colorat mai puțin pentru colagenul de tip II decât grupurile SFBM-atât și Free plug (Fig. 4 A).
Tabelul 4
Procentul de condrocite apoptotice la 4, 8 și 12 săptămâni în diferite grupuri (medie ± SD)
| 4 | 3,1 ± 0,8 | 39,1 ± 12,6 **, ## | 5,3 ± 1,8 | 40,6 ± 6,4 **, ## | 3,0 ± 1,2 |
| 8 | 3,7 ± 1,7 | 58,5 ± 15,5 **, ## | 16,0 ± 4,1 ** | 52,1 ± 10,0 **, ## | 5,1 ± 2,3 |
| 12 | 4,2 ± 1,8 | 56,3 ± 8,5 **, ## | 15,6 ± 3,9 ** | 59,0 ± 10,5 **, ## | 5,0 ± 2,2 |
* P # P ## P 3 D). Deși au fost efectuate investigații ample pentru a determina sursele de nutriție ale cartilajului articular și relația dintre nutriție și degenerarea cartilajului [2, 6, 12, 17], aceasta din urmă rămâne incomplet înțeleasă [15]. Pentru a determina care sursă de nutriție este mai importantă în menținerea homeostaziei normale a cartilajului adult, am proiectat o nouă metodă de capac din PVC pentru a priva cartilajul de nutriția SF sau BM (sau ambele). Rezultatele noastre au demonstrat că această metodă simplă a fost eficientă pentru a bloca nutriția cartilajului din SF și BM. În plus, așa cum a demonstrat lipsa diferențelor semnificative detectabile în modificările cartilajului între fals și SFBM-ambele grupuri de control, SFBM-ambele grupuri ar putea obține în continuare nutriția din SF și BM, chiar dacă dopul cartilajului a fost înconjurat de un Tub din PVC.
Este bine cunoscut faptul că cartilajul articular poate obține nutriție atât din SF, cât și din BM [24]. Cu toate acestea, care cale este mai importantă pentru homeostazia cartilajului articular este încă în discuție [12, 17]. Rezultatele noastre au dovedit că cartilajul ar putea fi deteriorat prin blocarea oricărei căi de nutriție, dar blocarea căii SF a dus la o degenerare a cartilajului semnificativ mai mare decât blocarea căii BM subcondrale. Prin urmare, descoperirile noastre sugerează că cartilajul articular este hrănit în principal din lichidul sinovial.
Cea mai severă deteriorare a cartilajului a fost observată în grupul numai cu BM, incluzând invazia sângelui BM, dispariția cartilajului calcificat, deteriorarea cartilajului și înconjurarea cartilajului rezidual de către BM (Fig. 2 Aq, Aq, 3A-b, 3 Ab, g, D). Datele noastre indică faptul că SF poate fi sursa dominantă de nutriție necesară pentru a menține structura și funcția normală a cartilajului adult. Deficitul de nutriție de către SF induce în mod direct degenerarea cartilajului. Când alimentația din SF a fost blocată, nutriția de către BM a devenit dominantă. Cu toate acestea, când BM a devenit principala sursă de nutriție, aceasta a avut ca rezultat leziuni grave ale cartilajului din cauza invaziei vaselor de sânge din măduva osoasă. Studiile au arătat că degenerarea cartilajului este legată de invazia vasculară [7, 27, 28, 33]. Rezultatul nostru este în concordanță cu aceste constatări. Descoperirile noastre indică faptul că modificarea nutriției lichidului sinovial sau prevenirea sau blocarea invaziei de sânge din măduva osoasă subcondrală poate avea un efect terapeutic în tratamentul degenerescenței cartilajului.
Deteriorarea moderată a cartilajului a fost, de asemenea, găsită în grupul numai cu SF, dar această deteriorare a fost mai mică decât în grupul numai cu BM. Acest rezultat indică faptul că nutriția de mâine osoasă este necesară și pentru menținerea homeostaziei normale a cartilajului. Este interesant de observat că deteriorarea cartilajului în grupul None-SFBM nu a provocat deteriorări suplimentare ale cartilajului comparativ cu BM singur. O posibilă explicație este absența invaziei vaselor de sânge (Fig. 2 A-t, A-t, 3A-e, 3 A-e, j).
Rezultatele PCR au demonstrat în continuare că blocarea nutriției din SF sau BM a dus la scăderea nivelului de ARNm de AGG și Col II, ceea ce indică faptul că nutriția atât din SF cât și din BM este critică pentru a menține funcția normală a cartilajului articular. MMP-13 joacă un rol critic în degenerescența cartilajului OA [29]. În acest studiu, am observat că MMP-13 mARN a fost crescut în grupurile numai BM, None-SFBM și SF numai în comparație cu SFBM-ambele și grupurile cu mufă liberă, ceea ce indică faptul că MMP-13 joacă un rol important în cartilaj degenerescență cauzată de lipsa de nutriție din SF sau BM (Fig. 5).
Locația pentru colectarea probelor de cartilaj este esențială pentru analiza grosimii cartilajului, deoarece grosimea cartilajului se modifică odată cu localizarea anatomică [5, 26]. Pentru a obține rezultate consistente și comparabile, am ales centrul acestui troheu femural, paralel cu marginea superioară a ligamentului lateral (Fig. 1 A, B) în acest studiu. Articulația patelofemorală este o articulație importantă de încărcare a greutății la rozătoare. Această articulație este largă și plană deasupra marginii superioare a ligamentului lateral. Cartilajul din acest sit a fost omogen ca grosime în planul sagital al troheei femurale. Prin urmare, datele obținute din această locație au fost consistente și pot fi comparate între diferitele grupuri.
Concluzie
Există două căi pentru nutriția cartilajului articular: difuzia din lichidul sinovial sau măduva osoasă subcondrală. Nutriția din lichidul sinovial este esențială pentru structura și funcția normală a cartilajului, iar pierderea acestei surse de nutriție duce la o degenerare a cartilajului mult mai severă în comparație cu pierderea nutriției din măduva osoasă subcondrală. În plus, nutriția din măduva osoasă subcondrală este necesară și pentru structura și funcția normală a cartilajului, iar deteriorarea cartilajului poate fi cauzată de deficiența nutriției din măduva osoasă subcondrală. Modificarea nutriției lichidului sinovial și prevenirea invaziei de sânge din măduva osoasă subcondrală poate avea efecte terapeutice în degenerarea cartilajului.
- Fapte nutriționale clasice despre micul Coca-Cola clasic McDonald's
- Gusturi noi și interesante pentru luna națională a nutriției, experimentați cu ierburi și condimente pentru a savura
- Sago Nutriție, beneficii, dezavantaje și utilizări
- Informații nutriționale despre McDonald's Large French Fries
- Nouă nutriție scurtă în acoperirea sănătății universale - SUN