Abstract
Polietilena cu densitate redusă (LDPE) este o cauză majoră a poluării mediului persistente și pe termen lung. În această lucrare, două izolate bacteriene Bacillus amyloliquefaciens (BSM-1) și Bacillus amyloliquefaciens (BSM-2) au fost izolate din solul solid municipal și utilizate pentru studii de degradare a polimerilor. Degradarea microbiană a LDPE a fost analizată prin reducerea în greutate uscată a filmului de LDPE, modificarea pH-ului mediului de cultură, estimarea CO2, microscopie electronică cu scanare (SEM) și spectroscopie FTIR în infraroșu cu transformare fourier a suprafeței filmului. Analiza SEM a arătat că ambele tulpini au prezentat aderență și creștere cu LDPE care a fost utilizat ca singură sursă de carbon, în timp ce imaginile FTIR au arătat diferite modificări chimice de suprafață după 60 de zile de incubație. Izolatele bacteriene au arătat depolimerizarea produselor biodegradate în mediul extracelular indicând procesul de biodegradare. BSM-2 a prezentat o degradare mai bună decât BSM-1, ceea ce dovedește potențialitatea acestor tulpini de a degrada filmele LDPE într-un interval scurt de timp.
Introducere
Polietilena cu densitate redusă (LDPE) este un termoplastic nebiodegradabil utilizat pe scară largă. Pentru a rezolva această problemă de mediu legată de termoplastele nebiodegradabile, cercetarea pentru modificarea termoplastelor nebiodegradabile la materiale biodegradabile este de mare interes (Zheng și colab. 2005). Mai mult, acești polimeri sintetici nu sunt în mod normal biodegradabili până când nu sunt degradați în fragmente cu greutate moleculară mică care pot fi asimilate de microorganisme (Francis și colab. 2010).
Materiale și metode
Pre-tratarea și prepararea pulberii LDPE
Polietilena de joasă densitate (LDPE) a fost obținută de la B.N. Polymers, Bangalore, India. Filmele din LDPE au fost tăiate în bucăți mici, imersate în xilen și fierte timp de 15 minute, urmate de zdrobire cu un blender la 3.000 rpm. După cum s-a obținut pulberea de LDPE a fost spălată în continuare cu etanol, uscată peste noapte în cuptor cu aer cald la 60 ° C și depozitată la temperatura camerei pentru utilizare ulterioară.
Bacterii degradante din polietilenă și condiții de cultură
Bacteriile utilizate în acest studiu, B. amyloliquefaciens (BSM-1) (GenBank acces nr. KC924446) și B. amyloliquefaciens (BSM-2) (nr. De acces GenBank KC924447) (Das și Kumar 2013), au fost izolate din zona de depozitare a deșeurilor solide municipale, Pallikaranai (12.9377N/80.2153E, 7 m deasupra nivelului mării), Chennai, India și menținută pe agar nutritiv la 4 ° C. Bacteriile degradante ale polimerului au fost identificate folosind medii sintetice suplimentate cu 0,3% pulbere de LDPE. Compoziția mediului sintetic a fost după cum urmează: (g/L: K2HPO4, 1; KH2PO4, 0,2; (NH4) 2SO4, 1; MgSO4 · 7H2O, 0,5; NaCI, 1; FeSO4 · 7H2O, 0,01; CaCl2 · 2H2O, 0,002; MnSO4 · H2O, 0,001; CuSO4 · 5H2O, 0,001; ZnSO4 · 7H2O, 0,001; Agar 15; pH 7,0).
Studii de biodegradare
Testele de biodegradare au fost efectuate cu probe de 3 g de filme LDPE (1,5 × 1,5 cm) care au fost uscate peste noapte la 60 ° C, cântărite, dezinfectate (30 min în etanol 70%), uscate la aer timp de 15 minute în camera de curgere a aerului laminar și adăugate la baloane Erlenmeyer care conțin 300 ml mediu sintetic. Studiul de degradare a LDPE a fost realizat folosind ambele tulpini bacteriene individual. Fiecare balon inoculat cu 3 ml de cultură veche de 24 de ore (BSM-1 și BSM-2) crescut pe mediu suplimentat cu LDPE a fost utilizat ca inoculuri pentru a evita orice fază de întârziere asociată. Apoi culturile au fost incubate pe un agitator rotativ (Neolab Instruments) la 33,3 ° C și 130 rpm timp de 60 de zile. Fiecare test a constat din trei replici.
Măsurarea biodegradării
Determinarea modificării pH-ului
Studiul modificării pH-ului a fost adoptat pentru a se asigura de orice activitate metabolică a tulpinii microbiene în mediu suplimentat, deoarece metabolismul arătat de celulele microbiene poate sprijini în mare măsură dovezile degradării. PH-ul fiecărei suspensii bacteriene a fost măsurat la un interval de 10 zile în timpul studiului. Sonda de pH a fost introdusă în bulion pentru a măsura pH-ul. Valoarea inițială a mediului a fost asigurată să fie de 7 ± 0,3 pentru ambele tulpini folosind tampon fosfat.
Determinarea greutății uscate a polimerului rezidual
Pentru a facilita măsurarea exactă a greutății polietilenei reziduale, foile de polietilenă au fost recuperate după 60 de zile de incubație și spălate biofilmul bacterian de pe suprafața polimerului cu o soluție apoasă de dodecil sulfat de sodiu 2% (v/v) timp de 4 ore (folosind agitator), urmat de apă distilată și în cele din urmă cu 70% etanol pentru a asigura îndepărtarea maximă posibilă a celulelor și a resturilor. Bucățile de polimer spălate au fost plasate pe o hârtie de filtru și uscate peste noapte la temperatura camerei înainte de cântărire.
Test de evoluție a CO2
A fost proiectat aparatul simplu auto-modificat care constă din vase de control și test și aer steril a fost furnizat sistemului pentru aerare. Aici, polimerul incubat cu microbi a servit drept test și polimerul fără microbi a servit drept control. După incubare, atât CO2 metabolic cât și atmosferic din vasul de testare și CO2 atmosferic din vasul de control au fost prinse și evaluate folosind „testul Sturm” (Sturm 1973) pentru fiecare izolat.
Microscopie electronică cu scanare (SEM)
Probele netratate și tratate după 60 de zile au fost supuse analizei SEM (după spălare cu 2% (v/v) SDS apoasă și apă distilată în mod repetat prin agitare ușoară timp de câteva minute și spălate suplimentar cu etanol 70% cu obiectivul de îndepărtarea probelor, astfel încât suprafața maximă să fie expusă pentru vizualizare. Probele au fost lipite pe SEM Sample Stub folosind o bandă de carbon și proba a fost acoperită cu aur timp de 40 s și analizată cu microscop electronic cu scanare de înaltă rezoluție (JEOL, Model JSM -6390LV).
Analiza FTIR
Au fost efectuate studii spectroscopice în infraroșu cu transformată Fourier pentru controlul și filmele LDPE tratate cu bacterii. Analiza a fost efectuată utilizând spectroscopia FTIR Perkin-Elmer Spectrum-One în modul orizontal cu discuri de bromură de taliu.
rezultate si discutii
Plasticul biodegradabil este o soluție favorabilă a eliminării sau a problemelor de acumulare în natură. Ca deșeuri menajere și industriale care conțin o cantitate uriașă de polietilenă cu densitate redusă, în această lucrare a fost colectată o probă de deșeuri solide pentru depozitarea deșeurilor municipale pentru a izola microorganismele care au prezentat o biodegradare puternică. Izolatele bacteriene pot crește într-un mediu sintetic suplimentat cu LDPE utilizând LDPE ca sursă unică de carbon și energie. Aceste observații indică formarea și atașarea unui biofilm pe pelicula de LDPE. Colonizarea microbiană pe suprafața polimerului este prima cerință pentru biodegradarea acestuia (Yabannavar și Bartha 1993).
Studii de biodegradare
După o perioadă de incubație de 60 de zile, capacitatea de degradare a tulpinilor Bacillus amyloliquefaciens (BSM-1) și Bacillus amyloliquefaciens (BSM-2) a fost analizat și interpretat folosind diverși parametri.
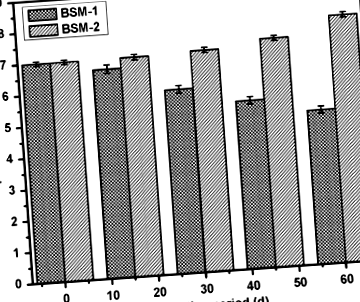
Schimbarea pH-ului
Figura 1 prezintă variația pH-ului ambelor suspensii bacteriene în timpul și după biodegradare. Microorganismele secretă o varietate de enzime în apa solului, ceea ce începe descompunerea polimerilor. Două tipuri de enzime sunt implicate în proces, și anume depolimeraze intracelulare și extracelulare. Exoenzimele din microorganisme descompun mai întâi polimerii complexi care dau lanțuri scurte sau monomeri suficient de mici pentru a pătrunde prin pereții celulari pentru a fi utilizați ca surse de carbon și energie printr-un proces de depolimerizare (Dey și colab. 2012). Izolatele bacteriene, BSM-1 și BSM-2 au arătat producerea unor enzime și metaboliți cu indicația modificării pH-ului care susține activitatea metabolică a tulpinilor pe substratul LDPE și, de asemenea, degradarea acestuia.
Variația nivelului pH-ului în timpul biodegradării datorită activității microbiene
Reducerea greutății
O modalitate simplă și rapidă de a măsura biodegradarea polimerilor este determinarea pierderii în greutate. Microorganismele care cresc în polimer duc la o creștere în greutate datorită acumulării, în timp ce o pierdere a integrității polimerului duce la pierderea în greutate. Pierderea în greutate este proporțională cu suprafața, deoarece biodegradarea este inițiată de obicei la suprafața polimerului. După perioada de degradare, filmele LDPE au fost tratate cu SDS ca un agent tensioactiv care a denaturat celulele și a fost complet spălat de pe suprafață. Reducerea în greutate a fost observată după biodegradarea LDPE (Fig. 2).
Degradarea filmelor LDPE (greutate inițială: 30 mg cu 1,5 × 1,5 cm) pe mediu sintetic inoculat cu tulpina BSM-1 și BSM-2 incubate la 33,3 ° C timp de 60 de zile
Evaluarea nivelului de mineralizare
Testul Sturm este metoda în care degradarea a fost atribuită cantității de dioxid de carbon metabolic evoluată în perioada de creștere. Polimerii sunt compuși din lanț de carbon și atunci când se degradează prin microbi CO2 și H2O sunt obținuți ca subproduse, procesul se numește mineralizare în care polimerul este transformat mai întâi în monomeri prin ruperea legăturilor și apoi în compuși mai simpli pentru a fi asimilați în celulele vii. Nivelul de CO2 a fost calculat din martor (CO2 atmosferic) și camera de reacție (CO2 atmosferic și metabolic) după 60 de zile de studiu de biodegradare. Evoluția teoretică a dioxidului de carbon pentru 3% LDPE a fost estimată la 11 g/L pentru biodegradarea completă. Aici, procentul nivelului de biomineralizare a LDPE prin dioxidul de carbon evoluat din camerele de reacție a fost calculat pentru tulpina BSM-1 și BSM-2 prin compararea cu valorile corespunzătoare ale camerelor de control (Tabelul 1). Rezultatul arată potențialitatea Bacillus amyloliquefaciens și susține faptul biodegradării și biomineralizării acestui polimer periculos.
Analiza SEM a filmului LDPE
În timp ce schimbarea pH-ului, reducerea greutății, nivelul de mineralizare și spectrele de absorbție oferă dovezi solide ale biodegradării polimerului, modificările de pe suprafața filmelor LDPE au fost elucidate de SEM. Eșantionul de control are un aspect de suprafață netedă care nu prezintă gropi, fisuri sau particule atașate pe suprafață (Fig. 3a). În cazul filmului de LDPE tratat cu izolatul bacterian BSM-1, s-a constatat că mai multe fisuri la suprafață s-au dezvoltat după 60 de zile de tratament. În același timp, microbii au fost observați și pe suprafața filmului pentru a indica capacitățile sale aderente puternice, precum și capacitățile de utilizare a LDPE (Fig. 3b). Filmul tratat cu izolatul bacterian BSM-2 sa dovedit a avea atașament bacterian la o rată mai mare în comparație cu BSM-1. Un semn clar de degradare poate fi văzut în locurile în care inițial microbii au fost atașați împreună cu buzunarele și gropile din jur (Fig. 3c). Pentru ambele tulpini, în diferite locuri de la suprafață pot fi observate mai multe colonii care formează biofilm.
Micrografie SEM a filmului LDPE înainte de tratament ca Control (A), Film LDPE după tratamentul cu BSM-1 (b) și film LDPE după tratamentul cu BSM-2 (c)
Analiza FTIR
Spectrele de control FTIR (A), tratat cu BSM-1b) și tratate cu BSM-2c)
Concluzie
Problema poluării cu plastic este acum cu adevărat o mizerie pentru omenire. Nu există nicio parte a lumii neatinsă de impactul ei. În era actuală a globalizării trebuie pus un anumit stres pentru a planifica eliminarea în siguranță a produselor înainte de a le face comerciale. A face știința să sară și a uita cealaltă față a monedei duce la astfel de condiții. În prezentul studiu, două tulpini izolate de Bacillus amyloliquefaciens s-au dovedit a fi utile pentru biodegradare, care este raportată pentru prima dată cu dovezile aplicabile. Această abordare a biodegradării este sigură și ecologică. Rezultatele au arătat o speranță promițătoare de a degrada rata LDPE mai rapid decât de a fi degradată în mod natural.
Referințe
Albertsson AC, Andersson SO, Karlsson S (1987) Mecanismul biodegradării polietilenei. Polym Degrad Stab 18: 73-87
Andrady AL (2011) Microplasticele în mediul marin. Mar Pollut Bull 62: 1596–1605
Arboleda CE, Mejía AIG, López BLO (2004) Poli (vinilalcool-co-etilenă) biodegradare pe fermentare semi solidă prin Phanerochaete chrysosporium. Acta Farm Bonaer 23: 123–128
Das MP, Kumar S (2013) Influența hidrofobiei suprafeței celulare în colonizare și formarea biofilmului asupra biodegradării LDPE. Int J Pharm Pharm Sci 5: 690-694
Dey U, Mondal NK, Das K, Dutta S (2012) O abordare a degradării polimerilor prin microbi. IOSRPHR 2: 385–388
Drímal P, Hoffmann J, Družbík M (2007) Evaluarea biodegradabilității aerobe a materialelor plastice în mediul solului prin analiza GC și IR a fazei gazoase. Testul de teren 26: 729-741
Francis V, Raghul SS, Sarita GB, Eby TT (2010) Studii de degradare microbiană pe amestecuri liniare de poli (etilenă) -poli (alcool vinilic) cu densitate mică Vibrio sp. Conferința internațională privind progresele în tehnologia polimerilor, pp. 26-27
Gu JD, Ford TE, Mitton DB, Mitchell R (2000) Coroziunea microbiană a metalelor. În: Revie W (ed) The Uhlig Corrosion Handbook, 2nd edn. Wiley, New York, pp. 915-927
Kiatkamjornwong S, Sonsuk M, Wittayapichet S, Prasassarakich P, Vejjanukroh PC (1999) Degradarea materialelor plastice din polistiren cu umiditate de stiren-g-manioc. Personalul Degrad pe teren 66: 323-335
Klrbas Z, Keskin N, Güner A (1999) Biodegradarea clorurii de polivinil (PVC) prin ciuperci de putregai alb. Bull Environ Contam Toxicol 63: 335–342
Sadocco P, Nocerino S, Dubini-Paglia E, Seves A, Elegir G (1997) Caracterizarea unei poli (3-hidroxibutirat) depolimerază din Aureobacterium saperdae: sit activ și cinetica studiilor de hidroliză. J Environ Polym Degrad 5: 57–65
Shah AA, Hasan F, Hameed A, Ahmed S (2008) Degradarea biologică a materialelor plastice: o analiză cuprinzătoare. Biotech Adv 26: 246–265
Starnecker A, Menner M (1996) Evaluarea biodegradabilității materialelor plastice în condiții de compostare stimulată într-un sistem de testare de laborator. Int Biodeter Biodegr 37: 85-92
Sturm RN (1973) Biodegradabilitatea surfactanților neionici: test de screening pentru rata de predicție și biodegradarea finală. J Oil Chem Soc 50: 159–167
Swift G (1997) Polimeri biodegradabili nemedicali: polimeri degradabili din mediu. În: Manual de polimeri biodegradabili. Hardwood Academic, Amsterdam, pp. 473-511
Tokiwa Y, Calabia BP, Ugwu CU, Aiba S (2009) Biodegradabilitatea materialelor plastice. Int J Mol Sci 10: 3722–3742
Yabannavar A, Bartha R (1993) Biodegradabilitatea unor materiale de ambalare a alimentelor în sol. Soil Biol Biochem 25: 1469–1475
Zheng Y, Yanful EK, Bassi AS (2005) O revizuire a biodegradării deșeurilor de plastic. Crit Rev Biotechnol 25: 243-250
Mulțumiri
Autorii își mulțumesc Departamentului de Biotehnologie Industrială, Universitatea Bharath, Chennai, pentru furnizarea de facilități de laborator.
Conflict de interese
Autorii acestei lucrări declară că nu au niciun conflict de interese.
Informatia autorului
Afilieri
Departamentul de Biotehnologie Industrială, Universitatea Bharath, Chennai, 600073, Tamil Nadu, India
Merina Paul Das și Santosh Kumar
Puteți căuta acest autor și în PubMed Google Scholar
Puteți căuta acest autor și în PubMed Google Scholar
autorul corespunzator
Drepturi și permisiuni
Acest articol este publicat sub licență către BioMed Central Ltd.Acces deschis Acest articol este distribuit în condițiile licenței de atribuire Creative Commons, care permite orice utilizare, distribuție și reproducere în orice mediu, furnizat de autorul (autorii) original (i) și sursa sunt creditate.
- O abordare echilibrată a injecțiilor cu steroizi epidurali Dr.
- O abordare holistică a pierderii în greutate; Dr.
- Analiza recombinării la telomerii de drojdie SpringerLink
- O abordare practică a pierderii de grăsime sănătoase
- Abordarea exercitării pierderii în greutate Boca Raton HFWL