Makoto Kuro-o
Departamentul de patologie, Universitatea din Texas Southwestern Medical Center din Dallas, 5323 Harry Hines Blvd., Dallas, Texas 75390-9072, Telefon: (214) 648-4018, Fax: (214) 648-4070
Abstract
Homeostazia fosfatului este menținută în primul rând de o axă endocrină os-rinichi. Când fosfatul este în exces, factorul de creștere a fibroblastului-23 (FGF23) este secretat din os și acționează asupra rinichiului pentru a promova excreția de fosfat în urină. FGF23 reduce, de asemenea, nivelurile serice de vitamina D pentru a suprima absorbția fosfatului din intestin. Astfel, FGF23 funcționează ca un hormon care induce un echilibru negativ al fosfatului. O caracteristică critică a FGF23 este că necesită Klotho, o proteină transmembranară cu o singură trecere exprimată în tubulii renali, ca un co-receptor obligatoriu pentru a lega și a activa receptorii FGF înrudiți. Important, defectele fie în FGF23, fie în Klotho nu numai că provoacă retenție de fosfați, ci și un sindrom de îmbătrânire prematură la șoareci, care poate fi salvat prin rezolvarea hiperfosfatemiei. În plus, modificările concentrației de fosfat extracelular și intracelular afectează metabolismul glucozei, sensibilitatea la insulină și stresul oxidativ in vivo și in vitro, care pot afecta procesele de îmbătrânire. Aceste descoperiri sugerează o legătură neașteptată între fosfatul anorganic și îmbătrânirea la mamifere.
1. Introducere
2. Reglarea endocrină a metabolismului fosfatului
3. Baza moleculară a acțiunii FGF23
Studii recente au identificat Klotho, o proteină transmembranară cu o singură trecere exprimată în rinichi, ca un co-factor necesar ca FGF23 să se lege de FGFR (Kurosu și colab., 2006; Urakawa și colab., 2006). Proteina Klotho formează un complex binar constitutiv cu mai multe FGFR (FGFR1c, 3c și 4) și le crește afinitatea în mod specific față de FGF23. Cu alte cuvinte, Klotho funcționează ca un co-receptor obligatoriu pentru FGF23. De fapt, șoarecii cu deficit de Klotho sunt total rezistenți la FGF23 și prezintă fenotipuri de retenție a fosfatului, cum ar fi șoarecii cu deficiență FGF23 (Tsujikawa și colab., 2003; Yoshida și colab., 2002). Expresia renală specifică a Klotho explică de ce FGF23 recunoaște rinichiul ca organul său țintă printre multe organe care exprimă FGFR. Este posibil ca proteina Klotho să fi evoluat pentru a compensa afinitatea scăzută a FGF23 față de sulfatul de heparan și pentru a susține în mod specific activarea FGFR cu FGF23, care reprezintă un mecanism nou pentru confinarea organelor țintă în interacțiunile redundante ligand-receptor. Astfel, Klotho și FGF23 au apărut ca componente importante ale axei endocrine os-rinichi care reglează metabolismul fosfatului (Kuro-o, 2006, 2008; Kurosu și Kuro-o, 2008, 2009b; Liu și colab., 2007; Liu și Quarles, 2007).
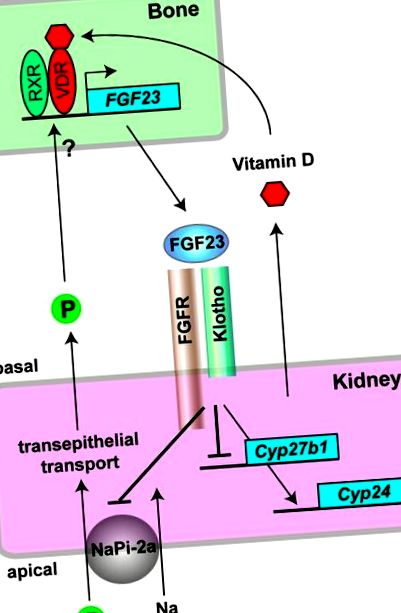
Axele endocrine os-rinichi mediate de FGF23 și Klotho. În osteocite, forma activă a vitaminei D (1,25-dihidroxivitamină D3) se leagă de receptorul vitaminei D (VDR) și formează heterodimeri cu un alt receptor nuclear (RXR) pentru transactivarea transcripției genei FGF23. Fosfatul (P) crește, de asemenea, expresia FGF23 în os, dar mecanismul său rămâne de determinat. FGF23 secretat din os acționează asupra complexului Klotho-FGFR exprimat în epiteliu renal la rinichi. Ca hormon fosfaturic, FGF23 inhibă reabsorbția fosfatului transepitelial prin suprimarea co-transportorului de sodiu-fosfat de tip IIa (NaPi-2a) pe membrana apicală de perie a tubulilor renali, închizând astfel o buclă de feedback negativă pentru homeostazia fosfatului. Ca hormon contrareglator al vitaminei D, FGF23 reduce nivelurile serice de 1,25-dihidroxivitamină D3 prin suprimarea sintezei sale prin reglarea în jos a expresiei genei Cyp27b1 și promovarea inactivării acesteia prin reglarea în sus a expresiei genei Cyp24, închizând astfel o buclă de feedback negativ pentru homeostazia vitaminei D.
4. Dovezi genetice privind toxicitatea fosfatului
Defectele din Klotho sau FGF23 perturbă buclele de feedback negativ care mențin fosfatul și homeostazia vitaminei D, rezultând niveluri ridicate de fosfat seric și vitamina D. Vitamina D serică ridicată favorizează absorbția intestinală a calciului și induce și hipercalcemie. De remarcat, această stare metabolică se caracterizează prin niveluri serice ridicate de fosfat, calciu și vitamina D, fiind asociată cu un sindrom de îmbătrânire prematură. De fapt, gena klotho a fost identificată inițial ca o genă mutată într-o tulpină de șoarece care a moștenit un sindrom de îmbătrânire prematură (Kuro-o și colab., 1997). Șoarecii lipsiți de Klotho dezvoltă fenotipuri multiple asemănătoare îmbătrânirii, inclusiv o durată de viață scurtată, întârzierea creșterii, hipogonadism hipogonadotrop, atrofie rapidă a timusului (Min și colab., 2007), atrofie a pielii, sarcopenie, calcificare vasculară, osteopenie (Kawaguchi și colab., 1999 )), emfizem pulmonar (Ishii și colab., 2008; Sato și colab., 2007; Suga și colab., 2000), tulburări cognitive (Nagai și colab., 2003), tulburări de auz (Kamemori și colab., 2002), și degenerescența neuronilor motori (Anamizu și colab., 2005). Aceste fenotipuri sunt observate și la șoareci lipsiți de FGF23 (Razzaque și colab., 2006).
Aceste observații implică faptul că fosfatul, calciul și/sau vitamina D pot fi toxice atunci când sunt reținute și accelerează îmbătrânirea. Mai multe studii au susținut această noțiune. În primul rând, dieta cu deficit de vitamina D nu numai că a redus nivelul normal al fosfatului seric și al calciului, ci a salvat și mai multe fenotipuri asemănătoare îmbătrânirii, atât la șoarecii cu deficit de Klotho, cât și la șoarecii cu deficit de FGF23 (Stubbs și colab., 2007; Tsujikawa și colab., 2003 ). În al doilea rând, ablația acțiunii vitaminei D la șoareci deficienți în Klotho și șoareci deficienți de FGF23 prin perturbarea genei Cyp27b1 (Ohnishi și colab., 2009; Razzaque și colab., 2006) sau a genei receptorului vitaminei D (Hesse și colab., 2007) a salvat, de asemenea, hiperfosfatemia, hipercalcemia și sindromul de îmbătrânire prematură.
În cele din urmă, dieta cu fosfat scăzut a salvat durata de viață scurtată și calcificarea vasculară atât la șoarecii deficienți în FGF23, cât și la șoarecii deficienți în Klotho (Morishita și colab., 2001; Stubbs și colab., 2007). Aceste studii au furnizat dovezi fără echivoc că sindromul de îmbătrânire prematură cauzat de defecte ale axei endocrine Klotho-FGF23 se datorează retenției de fosfat, calciu și/sau vitamina D. Trebuie remarcat faptul că dieta cu fosfat scăzut a salvat mai multe fenotipuri ale FGF23- șoareci deficienți, în ciuda faptului că a crescut și mai mult nivelurile serice de calciu și vitamina D (Stubbs și colab., 2007), sugerând că fosfatul, dar nu calciu sau vitamina D, este în primul rând responsabil pentru fenotipurile asemănătoare îmbătrânirii. Este probabil ca o dietă scăzută de vitamina D și ablația activității vitaminei D să salveze îmbătrânirea accelerată prin reducerea nivelului de fosfat seric, deși rămâne de stabilit dacă sunt necesare niveluri serice de vitamina D și/sau calciu pentru ca fosfatul să inducă sindromul de îmbătrânire prematură.
5. Fosfat și îmbătrânire
Fosfatul anorganic nu este doar o componentă esențială a structurii celulare (ADN și fosfolipide de membrană), ci și un mediator cheie al numeroaselor activități celulare, inclusiv metabolismul energetic (producția de ATP) și transducția semnalului mediată de kinază. Este, de asemenea, implicat în fiziopatologia diferitelor tulburări, cum ar fi bolile osoase, calcificarea vasculară și bolile renale cronice, printre altele. Deși se știe puțin despre efectele directe ale fosfatului asupra îmbătrânirii, dovezile acumulate au demonstrat că fosfatul anorganic are efecte semnificative asupra metabolismului glucozei și a stresului oxidativ, care pot afecta procesele de îmbătrânire ale oricărui organism de la drojdie la om.
În Saccharomyces cerevisiae, foamea fosfatului, precum și foamea glucozei, induce oprirea ciclului celular și extinderea duratei de viață cronologică (Boer și colab., 2008; Brauer și colab., 2008). Au fost identificate mai multe gene care răspund la fosfat, inclusiv gena PHO85 care codifică o kinază dependentă de ciclină a cărei activitate este corelată cu concentrația de fosfat intracelular. Pho85 este inactivat în condiții de fosfat scăzut, ducând la o stare asemănătoare G0 și supraviețuire prelungită (Wanke și colab., 2005). Pho85 funcționează, de asemenea, ca un regulator negativ pentru un set de gene care sunt induse în mod obișnuit sub foamea glucozei (DeRisi și colab., 1997; Mouillon și Persson, 2006). Astfel, restricția fosfatului determină modificări metabolice similare cu cele induse de restricția calorică (glucoză) în drojdie.
La mamifere, dieta cu conținut scăzut de fosfat determină modificări ale metabolismului similare cu cele induse de restricția dietei, așa cum este discutat mai jos. Animalele sub restricție alimentară reduc nivelurile de insulină din sânge pentru a adapta disponibilitatea redusă a glucidelor și a modifica expresia genelor care răspund la insulină, ceea ce duce la modificări ale metabolismului glucozei, inclusiv gluconeogeneza crescută și scăderea glicolizei printre altele (Cao și colab., 2001; Kayo și colab., 2001; Lee și colab., 1999; Masoro, 2006; Wetter și colab., 1999). Deși dieta cu un nivel scăzut de fosfat nu reduce nivelul insulinei din sânge, într-adevăr modifică expresia genelor care răspund la insulină într-un mod similar cu cel indus de restricția dietei (Xie și colab., 1999; Xie și colab., 2000), ducând la creșterea gluconeogeneză și scăderea glicolizei, de asemenea. Acest lucru poate fi parțial explicat prin faptul că dieta cu fosfat scăzut induce o rezistență moderată la insulină prin mecanisme necunoscute (Haap și colab., 2006; Paula și colab., 1998). Astfel, rezistența moderată la insulină indusă de restricția fosfatului, precum și hipoinsulinemia indusă de restricția dietei, atenuează activitatea de semnalizare a insulinei intracelulare și induc modificări similare în expresia genei care răspunde la insulină, rezultând o stare metabolică similară.
Mai mult, American Heart Association a anunțat că BCR ar trebui să fie inclusă în grupul cu cel mai mare risc pentru bolile cardiovasculare (Sarnak și colab., 2003). Important, expresia Klotho este redusă semnificativ la rinichii pacienților cu CKD (Koh și colab., 2001). Astfel, CKD poate fi privit ca un sindrom progeroid segmentar asociat cu o stare de deficit de Klotho și retenție de fosfat. Interesant este faptul că pacienții cu sindrom de progeria Hutchinson-Gilford (HGPS) prezintă hiperfosfatemie și excreție fracționată redusă de fosfat (Merideth și colab., 2008; Ortiz, 2008), care sunt trăsături caracteristice șoarecilor lipsiți de Klotho sau FGF23. Deși hiperfosfatemia nu este responsabilă în principal de fenotipurile HGPS, poate crește mortalitatea cardiovasculară la pacienții cu HGPS.
O altă dovadă în sprijinul noțiunii că fosfatul afectează procesele de îmbătrânire este o corelație inversă între longevitate și nivelurile serice de fosfat la mamifere (Fig. 2). Deși există dificultăți în estimarea precisă a longevității și a nivelului de fosfat seric „normal”, se observă în mod clar o relație strânsă între longevitate și fosfat seric la diverse specii.
- 5 lecții de sănătate de învățat de la italieni - Longevitate LIVE
- Efect anti-obezitate și activitate antioxidantă în produse cu grăsimi alimentate cu șoareci alimentate cu hrișcă fermentate
- Efect anti-obezitate la șoareci obezi C57BL6 induși în diete cu conținut ridicat de grăsimi Studiul unui nou extract din
- Efectele anti-obezitate și antiinflamatorii ale oțetului de ginseng la șoarecii cu hrană bogată în grăsimi SpringerLink
- O legătură surprinzătoare către obezitate