De Canan Nebigil
Trimis: 3 mai 2016 Revizuit: 9 septembrie 2016 Publicat: 22 martie 2017
Abstract
Obezitatea conferă un risc crescut de boli renale cardiovasculare, diabet zaharat, steatohepatită nealcoolică, tulburări musculo-scheletice și cancere. Prokineticin-2 este un hormon peptidic, care există atât ca sistem hormonal circulant, cât și ca mecanism local de semnalizare paracrină în diferite țesuturi, inclusiv creierul, rinichii și adiposul. Acționează asupra receptorilor cuplați la proteina G (GPCR) PKR1 și PKR2. Rolul procineticinei - 2 în sistemul nervos central este controlul aportului alimentar. Efectul său anorexigen este cel puțin parțial prin sistemul hipotalamic melanocortin. Prokineticin-2 previne, de asemenea, expansiunea țesutului adipos prin limitarea capacității de proliferare și diferențiere a preadipocitelor. Semnalizarea Prokineticin-2 este importantă pentru pasajele capilare ale insulinei. De asemenea, reglează dezvoltarea și funcția inimii și a rinichilor. Aici, discutăm o nouă semnalizare a peptidelor obezității prokineticin în reglarea centrală a aportului alimentar, dezvoltarea țesutului adipocitar și funcția cardiovasculară. Prokineticina poate juca un rol cheie în asocierea dintre obezitate și bolile cardiovasculare. De asemenea, prezentăm potențialul receptorului de prokineticină - 1 ca țintă pentru tratamentul obezității și a bolilor cardiovasculare.
Cuvinte cheie
- prokineticin
- GPCR-uri
- obezitate
- Diabet
- anorexigenic
- angiogenă
informații despre capitol și autor
Autor
Canan Nebigil *
- CNRS-Universitatea din Strasbourg, (UMR 7242), Illkirch, Franța
* Adresați toată corespondența la: [email protected]
Din volumul editat
Editat de Jan Oxholm Gordeladze
1. Introducere
2. Prokineticinele și receptorii acestora
Prokineticinele sunt hormoni anorexigenici și angiogeni. Datorită similitudinilor structurale, de semnalizare și funcționale, prokineticinele sunt considerate citokine/chemokine [5]. Ele sunt eliberate în principal de macrofage și organe de reproducere [6]. Recent, procineticina a fost considerată o adipokină deoarece s-a găsit un nivel ridicat de prokineticine în WAT uman obez [7]. Aceste peptide mici (80-120 aminoacizi) se numesc prokineticine, deoarece aceste molecule au fost identificate mai întâi ca factori contracționali puternici în tractul gastro-intestinal [8]. Au fost identificate două izoforme de prokineticine: prokineticin-1 și prokineticin-2. Prokineticin-1 a fost numit inițial ca factor de creștere endotelial vascular derivat din glanda endocrină (EG - VEGF), [9] datorită similitudinii sale funcționale cu VEGF. Prokineticin-2 este, de asemenea, numit Bv8. Ambele peptide sunt 45% identice cu motivul AVITGA N-terminal extrem de conservat, esențial pentru activitatea lor biologică [6, 10]. Activitatea procineticinului este mediată de doi receptori cuplați cu proteina G, PKR1 și PKR2 [11].
2.1. Prokineticin-2 este o peptidă anorexigenică
Hormonii circulanți și substanțele nutritive sunt integrate pentru a media reglarea aporturilor dietetice pe termen scurt și lung în hipotalamus. Un centru de control al alimentării și al homeostaziei energetice din hipotalamus este numit nucleu arcuat (ARC) [12, 13]. ARC integrează majoritatea semnalelor hormonale periferice, inclusiv leptina, insulina și grelina. ARC are două subpopulații majore de neuroni primari care exprimă neurohormoni cu efecte opuse asupra consumului de alimente. Neuronii ARC care eliberează peptida derivată din proopiomelanocortină (POMC), hormon stimulant alfa-melanocit (α-MSH) și peptida transcriptă reglementată de cocaină și amfetamină (CART) reduc puternic aportul de alimente [13, 14]. Cu toate acestea, neuronii producători de neuropeptidă Y (NPY) din ARC stimulează consumul de alimente.
Prokineticin-2 este implicat în controlul aportului de alimente și al masei grase prin acțiuni în ARC în hipotalamus [15]. Receptorul PKR1 este exprimat atât pe neuronii NPY/AgRP, cât și pe POMC/CART. Injecția intracraniană de prokineticin - 2 la șobolani scade puternic aportul de alimente. Controversă, anticorpul anti-procineticin-2 crește aportul de alimente. Efectul anorexigenic al prokineticin-2 este mediat cel puțin parțial prin sistemul ARC hipotalamic de melanocortină. Prokineticin-2 crește eliberarea de alfa-MSH din explante hipotalamice ex vivo. Recent, PKR1 a fost arătat ca primul GPCR non-melanocortin care a fost reglat de proteina accesorie 2 a receptorului melanocortinei (MRAP2). Într-adevăr, MRAP2 inhibă în mod semnificativ și specific semnalizarea PKR1 [16].
Administrarea periferică de prokineticin-2 reduce consumul de alimente și greutatea corporală atât la șoarecii slabi, cât și la modelele obezității induse de dietă [17]. Acest efect al prokineticin-2 nu este evident atunci când pofta de mâncare este crescută sau se promovează comportamentul alimentar. Procineticina hipotalamică - 2 niveluri s-au găsit extrem de ridicate în perioada neonatală timpurie. Cu toate acestea, un nivel scăzut de prokineticin-2 a fost evident în condiții de post [18]. Prokineticin - 2 - șoareci knockout au devenit obezi la vârsta târzie. Oamenii cu mutații inactivante ale genei prokineticin-2 sunt, de asemenea, obezi [17, 19]. Efectele anorectice ale prokineticin-2 sunt abolite de antagoniștii PKR1 și nu sunt observate la șoareci lipsiți de PKR1 [17]. Astfel, efectele anorectice ale prokineticin-2 în hipotalamus sunt mediate de PKR1.
2.2. Prokineticin în dezvoltarea obezității
Mecanismele care stau la baza dezvoltării obezității includ hipertrofia și/sau hiperplazia adipocitelor, inflamația țesutului adipos (AT), afectarea remodelării matricei extracelulare și fibroza împreună cu o secreție modificată de adipokine [20]. Expansiunea AT implică două mecanisme distincte: o creștere a celulelor adipoase și o creștere a numărului de adipocite [21]. Adipocitele diferențiate sunt post-mitotice și, prin urmare, hiperplazia este rezultatul creșterii formării de adipocite de novo (adipogeneza). Adipogeneza afectată este asociată cu rezistența la insulină [22]. Echilibrul dintre proliferarea și diferențierea preadipocitelor și apoptoza sau necroza adipocitelor determină numărul adipocitelor.
Prokineticin - 2 niveluri s-au dovedit a fi ridicate în WAT uman obez [7]. Prokineticin-2 suprimă expansiunea AT prin două mecanisme distincte: reglarea centrală a aportului de alimente și limitarea proliferării și diferențierii preadipocitelor. Reglarea centrală a greutății corporale este contracarată de pierderea PKR1 în țesutul adipos la șoareci. Într-adevăr, s-a observat o acumulare anormal de excesivă de masă de grăsime abdominală la acești șoareci în care PKR1 a fost șters în mod specific în adipocite (PKR1 ad -/-) [7]. Formarea de noi adipocite atât la șoareci PKR1 nul, cât și la șoareci ad -/- PKR1 a fost rezultatul unei accelerări a proliferării și diferențierii preadipocitelor. Fenotipul proliferativ AT a trecut la fenotipul hipertrofic AT atunci când acești șoareci au fost tratați cu o dietă bogată în grăsimi, ceea ce implică un aport ridicat de calorii este implicat în conversia hiperplaziei în hipertrofie. În preadipocite izolate, activarea PKR1 suprimă proliferarea și diferențierea adipogenă [38].
Atât șoarecii PKR1null cât și PKR1ad -/- prezintă obezitate abdominală [7] Cu toate acestea, doar șoarecii PKR1null au obezitate periferică cu un sindrom asemănător diabetului. Astfel, evenimentele mediate de PKR1 neadipocite contribuie la dezvoltarea unui sindrom asemănător diabetului. Într-adevăr, șoarecii endoteliali specifici PKR1 - knockout (PKR1ec -/-) [23] au avut rezistență la insulină în adipocite. În PKR1ec -/- adipocite, insulina nu poate favoriza stocarea normală a grăsimilor, rezultând în exces acizi grași liberi care circulă, care, la rândul lor, contribuie în continuare la rezistența la insulină în mușchi, ducând la sindromul diabetic. Cu toate acestea, se pare că PKR1 nu are niciun efect direct asupra depunerii de grăsime în adipocite. Șoarecii ad -/- PKR1 nu au acumulat sever țesut adipos în adipocitele lor. Deoarece adipocitele nu sunt create din alte adipocite, ci apar din celulele precursoare (preadipocite), PKR1 suprimă capacitatea acestor celule precursoare de a deveni adipocite (Figura 1) [7]. Expansiunea și metabolismul țesutului adipos reprezintă problema majoră a obezității.
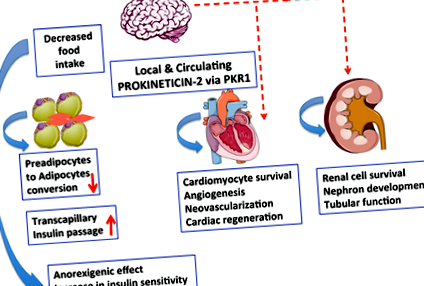
figura 1.
Semnalizarea Prokineticin-2/PKR1 poate acționa ca un nou conector între dezvoltarea obezității, diabetului și a bolilor cardiovasculare. Prokineticin - semnalizarea 2/PKR1 în sistemul nervos central (SNC) reglează aportul de alimente. Prokineticin - 2 eliberat din adipocite controlează conversia preadipocitelor în adipocite prin semnalizarea PKR1. Semnalizarea Prokineticin - 2/PKR1 promovează supraviețuirea cardiomiocitelor și a angiogenezei și implicată în neovascularizare prin activarea celulelor progenitoare cardiace. Semnalizarea Prokineticin - 2/PKR1 contribuie la dezvoltarea inimii și a rinichilor, precum și la funcționarea rinichilor. Rămâne de studiat dacă această semnalizare implică reglarea inimii și a rinichilor prin SNC.
2.3. Rezistența la procineticină și insulină
Endoteliul este esențial pentru livrarea transcapilară a insulinei către interstitiul mușchilor scheletici. Acest proces este etapa de limitare a ratei în absorbția de glucoză stimulată de insulină. [24] Afectarea procesului de administrare a insulinei contribuie la rezistența la insulină [25]. Pe de altă parte, rezistența la insulină duce la disfuncție endotelială [26]. Astfel, endoteliul vascular este o țintă terapeutică potențială pentru prevenirea rezistenței la insulină și a complicațiilor asociate [27].
Șoarecii knock-out PKR1 specific endoteliului (PKR1 ec -/-) prezintă o formare capilară afectată și o absorbție redusă a insulinei transcapilare [23]. Livrarea și semnalizarea insulinei afectate în celulele endoteliale (EC) au fost observate în cazurile de rezistență la insulină cu diabet de tip 2 și obezitate. Celulele endoteliale care supraexprimă PKR1 promovează absorbția transendotelială a insulinei [9] și angiogeneza [28]. PKR1ec -/- șoareci prezintă lipodistrofie datorită formării capilare slabe în AT. Lipodistrofiile, care implică o pierdere a WAT, provoacă hiperfagie și rezistență la insulină periferică [29].
Ca rezumat, prokineticina reglează pofta de mâncare (efectele asupra sistemului nervos central (SNC)) și suprimă expansiunea adipocitelor (efect direct asupra țesutului adipocitar), promovează depozitarea normală a grăsimilor (efect endotelial-dependent) și crește sensibilitatea la insulină. Strategiile terapeutice care vizează PKR1 ar putea fi importante pentru tratarea obezității și a rezistenței la insulină asociate obezității.
2.4. Prokineticina în reglarea cardiovasculară
Obezitatea este atât un factor de risc independent, cât și un marker de risc pentru dezvoltarea bolii coronariene asimptomatice și simptomatice, a insuficienței cardiace și a fibrilației atriale [2]. Relația dintre obezitate și bolile cardiovasculare poate fi asociată cu modificări cardiovasculare hemodinamice și anatomice legate de excesul de masă corporală [30]. Cu toate acestea, relația poate fi mediată și de modificările metabolice, inflamatorii și neurohormonale legate de obezitate.
Exprimarea modificată a prokineticinelor și a receptorilor acestora a fost implicată în dezvoltarea unui număr de afecțiuni cardiace patologice, inclusiv insuficiența cardiacă [31]. Prokineticinele și receptorii lor au fost identificați ca un important sistem de semnalizare cardiovasculară, în special angajamentul celulelor cardiace și comunicațiile dintre celule și celule [32].
PKR1 - semnalizarea mediată contribuie la supraviețuirea cardiomiocitelor și la repararea inimii adulților. PKR1 activează Akt în cardiomiocit pentru a proteja aceste celule împotriva apoptozei mediate de hipoxie [33]. Șoarecii transgenici (TG) - supraexprimând PKR1 în cardiomiocite (TG - PKR1) au avut un număr crescut de celule progenitoare derivate din epicard (EPDC), cu o creștere a densității capilare și a arteriolelor coronare. [32] Cardiac - semnalizarea PKR1 - își reglează propriul ligand prokineticin-2 pentru a stimula diferențierea EPDC în celulele endoteliale și musculare netede pentru a promova neovasculogeneza [32]. Cu toate acestea, cardiomiocitele - PKR1 sunt esențiale pentru supraviețuirea și contractilitatea cardiomiocitelor. Șoarecii nul PKR1 au prezentat defecte contractile cardiomiocite și apoptoză parțial din cauza lipsei semnalizării PKR1 în cardiomiocite. [34]
În celulele endoteliale (EC), PKR1 activează Akt și MAPK pentru a promova proliferarea, migrația și angiogeneza. În acord cu constatările in vitro, pierderea specifică a PKR1 din EC de șoarece a dus la angiogeneza defectuoasă, ducând la necroză/apoptoză în țesuturile înconjurătoare în mai multe organe, inclusiv inima și rinichii [23].
A existat o formare capilară semnificativ mai mică în inimile PKR1 ec -/- adulte. Pereții posteriori ai inimilor ec -/- PKR1 erau mai subțiri, ceea ce se datora pierderii formării capilare și un nivel ridicat de apoptoză [23]. Restul mușchiului cardiac viabil este supus unui stres biomecanic mai mare, declanșând hipertrofie [23]. Fracțiile de scurtare (indicatori ai contractilității ventriculului stâng) au fost reduse progresiv la șoarecii mutanți. PKR1 ec -/- inimile afișate dereglare EC, refracție capilară, apoptoză, fibroză și depunere de lipide ectopice, semnalizare anormală a insulinei în inimă care duce la afectarea funcției diastolice.
CE ale inimii au prezentat o scădere severă a absorbției insulinei FICT, indicând un transport transcapilar defect al insulinei în peretele vascular al acestor șoareci. EC izolate din țesuturile cardiace și renale mutante au prezentat o absorbție foarte mică a insulinei, confirmând că pierderea PKR1 din EC a scăzut transportul insulinei [23]. Supraexprimarea PKR1 în aceste EC a promovat trecerea insulinei fluorescein izotiocianat (FITC). Într-adevăr, defectul primar care leagă rezistența la insulină și disfuncția endotelială este considerat a fi un deficit de oxid nitric de origine endotelială [35]. De acord, absorbția insulinei și activarea eNOS mediată de insulină au fost afectate în toate EC mutante. În mod similar, activarea eNOS modificată și acțiunea scăzută a insulinei au fost recent demonstrate la endoteliul pacienților cu diabet zaharat [36]. Astfel, insuficiența de livrare a insulinei către EC poate duce la activarea defectuoasă a NOS și eNOS în PKR1 ec -/- aortas, afectând în consecință relaxarea dependentă de endoteliu. Aceste date evidențiază rolul PKR1 ca regulator pozitiv al absorbției insulinei [37].
Semnalizarea PKR1 contribuie, de asemenea, la dezvoltarea inimii. În inima în curs de dezvoltare, PKR1 reglează tranziția epicardico-mezenchimală (EMT) pentru a forma celule progenitoare derivate din epicard (EPDC) [38]. Ablația genetică a PKR1 în epicard duce la hipoplazie ventriculară și defecte septale în timpul embriogenezei. Afectarea vasculogenezei la acești șoareci se datorează proliferării EPDC afectate, precum și diferențierii EPDC defecte în tipul de celule endoteliale și musculare netede. PKR1 în EPDCS activează semnalizarea Akt, schimbă morfologia celulară, remodelarea citoscheletului actinic și profilul de exprimare a genei EMT. Epicardic - PKR1 contribuie la cardiomiocite, proliferare și ritmicitate pe o cale paracrină.
2.5. Prokineticina în dezvoltarea și funcția renală
Șoarecii globali PKR1 - knockout au obezitate periferică însoțită de un sindrom asemănător diabetului la vârsta târzie (36 de săptămâni) [7], în principal din cauza disfuncției endoteliale și a funcțiilor afectate ale țesutului adipos [37]. Acești șoareci au prezentat, de asemenea, cardiomegalie, fibroză interstițială severă și disfuncție cardiacă în condiții de stres. Acești șoareci au prezentat, de asemenea, dilatare tubulară renală afectată, capilare glomerulare reduse, excreție de fosfat urinar și proteinurie [34].
În mod similar, șoarecii knockout specifici PKR1 endoteliali (PKR1 ec -/-) au prezentat, de asemenea, dilatarea spațiilor Bowman în majoritatea glomerulilor, un glomerul compact, fibroză și structuri tubulare mărite cu un nucleu necrotic umflat, mitocondrii anormale și organizarea aberantă a podocitelor. Funcția tubulară anormală cu niveluri mai ridicate de excreție de fosfat renal absolut (Pi) la șoarecii PKR1 ec -/- se datorează nivelurilor mai scăzute de schimbător de sodiu - calciu și fosfat de sodiu. Modificările morfologice ale rinichilor ec -/- PKR1 au fost asociate cu niveluri mai ridicate de apoptoză și afectarea semnalizării insulinei și a acumulării de lipide. Șoarecii mutanți au prezentat niveluri ridicate de clearance-ul creatininei și proteinurie. [34] Disfuncția endotelială rezultată din pierderea semnalizării PKR1 stă la baza parțială a caracteristicilor patologice ale inimii și rinichilor.
Semnalizarea PKR1 în rinichi este esențială pentru dezvoltarea nefronului în timpul embriogenezei [38]. Recent, s-a arătat că șoarecii mutanți cu perturbări ale genei PKR1 țintite la progenitorii nefronului au prezentat letalitate embrionară și postnatală parțială din cauza rinichilor hipoplastici cu glomeruli prematuri și nefroni necrotici. Defectele de dezvoltare a rinichilor la acești șoareci se manifestă în stadiul adult ca atrofie renală cu defecte glomerulare, nefropatie și uremie. Astfel, PKR1 este necesar pentru tranziția renală mezenchimală - epitelială (MET) care este implicată în formarea progenitorilor renali, reglând glomerulogeneza spre formarea nefronilor în timpul dezvoltării rinichilor. Într-adevăr, PKR1 prin NFATc3 modifică prelucrarea MET pentru dezvoltarea nefronului.
3. Concluzie
Semnalizarea PKR1 are diferite efecte benefice, de exemplu, reglarea centrală a poftei de mâncare, suprimarea masei adipocitelor și a insulinei - efecte sensibilizante asupra mușchilor scheletici și a altor țesuturi, efecte regenerative cardiace și reglarea funcției renale. Acest lucru a atras un interes considerabil pentru posibila utilizare a acestui receptor ca țintă pentru tratamentele care combină obezitatea, diabetul și bolile cardiovasculare. Transferul genei intracardiace PKR1 a îmbunătățit rata de supraviețuire și funcțiile cardiace după infarctul miocardic [33]. Întrucât sa constatat că PKR2 contribuie la scurgerile vasculare și la cardiomiopatia hipertrofică [39], mai multe laboratoare s-au concentrat pe descoperirea agonistului PKR1. Recent, a fost identificat un agonist non-peptidic PKR1 [40]. Agonistul PKR1 previne formarea leziunilor cardiace și funcția cardiacă îmbunătățită după infarctul miocardic la șoareci, promovând proliferarea celulelor progenitoare cardiace și neovasculogeneza. PKR1 agonist în strategiile de tratament ale bolilor metabolice rămâne de studiat.
Rămâne de asemenea determinat modul în care procineticina-2 contribuie la remodelarea AT [41], modul în care modulează interacțiunea dintre adipocite, macrofage și celule endoteliale pentru a regla expansiunea AT [42]. Nivelurile circulante de prokineticină la pacienții obezi, diabetici și cu insuficiență cardiacă rămân de explorat.
Mulțumiri
Doresc să mulțumesc persoanelor implicate în studiile descrise aici, inclusiv Kyoji Urayama, Célia Guilini, Gulen Turkeri, Monia Boulberdaa, Mojdeh Dormishian, Rehana Qureshi, Himanshu Arora și Adeline Gasser. Publicația a fost susținută parțial de subvenții de la Fundația pentru Cercetarea Medicală (Equipe Labellisée), Centrul Național al Cercetării Științifice și Universitatea din Strasbourg. Această lucrare a fost publicată și în cadrul LABEX ANR - 10 - LABX‐ 0034_Medalis și a primit un sprijin financiar din partea guvernului francez administrat de Agenția Națională a Căutării (ANR) în cadrul „Program d ׳ investissement d ׳ avenir”.
- Peptida din mătase dietetică fără text complet previne obezitatea indusă de dietă bogată în grăsimi și promovează
- Peptida vindecă obezitatea și diabetul la șobolani - Futurity
- Alergarea ajută la evitarea creșterii în greutate, în ciuda „genelor obezității”, constată studiul
- Melodiile pentru un album America mai sănătoasă combate obezitatea infantilă
- Alunele, untul de arahide pot deține cheia pentru prevenirea obezității - ScienceDaily