Peptidele bioactive au în general 3-20 de reziduuri de aminoacizi în lungime și, deși se știe că atât proteinele animale, cât și cele vegetale conțin secvențe bioactive potențiale, majoritatea studiilor de până acum au implicat proteine din lapte.
Termeni asociați:
- Beta-cazeină
- Iaurt
- Lapte fermentat
- Valoare nutritivă
- Mâncare funcțională
- Chefir
- Lactoferina
- Cazeină
- Proteina din lapte
Descărcați în format PDF
Despre această pagină
Volumul 2
Leticia Mora,. Fidel Toldrá, în Enciclopedia chimiei alimentelor, 2019
Introducere
Peptidele bioactive sunt derivate din proteinele alimentare și exercită un efect pozitiv la om datorită proprietăților sale de promovare a sănătății. Peptidele bioactive pot exercita mai multe efecte benefice, cum ar fi prevenirea bolilor sau modularea sistemelor fiziologice odată ce acestea sunt absorbite în corpul uman. Există o gamă largă de funcții, în funcție de secvența peptidelor bioactive, astfel încât acestea să poată fi implicate în sistemul gastrointestinal, cum ar fi peptidele anti-obezitate și satietate, sistemul cardiovascular, cum ar fi peptidele antihipertensive, antitrombotice, antioxidante și hipocolesterolemiante., sistemul imunitar, cum ar fi peptidele antimicrobiene, citomodulatoare și imunomodulatoare, și sistemul nervos, cum ar fi peptidele opioide.
Peptidele bioactive conțin de obicei între 3 și 20 de resturi de aminoacizi și rămân inactive în timp ce secvențele sunt păstrate în proteina mamă. Acestea sunt active odată eliberate prin hidroliza enzimatică de către peptidaze în timpul procesării alimentelor și/sau în timpul digestiei gastro-intestinale. Pentru a exercita un efect pozitiv asupra sănătății, peptidele bioactive trebuie să traverseze bariera gastrointestinală (GI) și să supraviețuiască degradării enzimei.
Numeroase peptide bioactive au fost raportate în ultimii ani ca prezente în mod natural sau generate din proteine alimentare de diferite origini precum lapte, ouă, soia, pește și carne. În acest sens, cea mai extinsă bioactivitate studiată în ultimul deceniu a fost activitatea antihipertensivă prin măsurarea activității inhibitoare a enzimei de conversie a angiotensinei I (ECA). Motivul acestui interes se datorează în principal faptului că tensiunea arterială ridicată este unul dintre principalii factori de risc independenți pentru bolile cardiovasculare și principalul motiv de deces în țările dezvoltate. Peptidele cu acest tip de activitate sunt denumite generic ca peptide bioactive, chiar dacă alte activități, cum ar fi antioxidant, antimicrobian, opioid, antitrombotic, antidiabetic, etc ... se încadrează, de asemenea, în termenul general de peptide bioactive.
Peptide bioactive
12.4 Efectul tratamentului termic asupra activității peptidelor bioactive
Peptidele bioactive generate în mod natural în timpul procesării alimentelor pot fi ingerate direct fie crude, fie după tratament termic (pasteurizare, sterilizare, gătit etc.). Când se aplică un astfel de tratament termic, acesta poate afecta peptida în sine sau bioactivitatea acesteia, făcând necesară studierea stabilității peptidelor bioactive în condiții tipice de procesare termică. Tratamentele termice ușoare (60-80 ° C) induc desfășurarea proteinelor și pot îmbunătăți accesibilitatea la endopeptidaze (Bax și colab., 2012; Soladoye, Juárez, Aalhus, Shand și Estévez, 2015). Atunci când tratamentele termice sunt mai intense (> 100 ° C) proteinele sunt mai puțin accesibile peptidazelor, deoarece experimentează desfășurare ireversibilă, agregare, schimburi de disulfură, fragmentare a proteinelor și modificări chimice (Davis & Williams, 1998; Soladoye și colab., 2015).
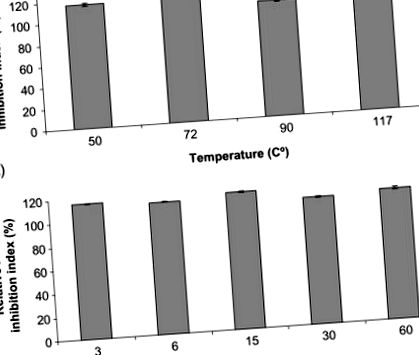
Stabilitatea extractelor de peptide bioactive împotriva diferitelor tratamente termice a fost recent testată. În studiu, peptidele cu activitate inhibitoare ECA ridicată au fost izolate din șunca spaniolă uscată și supuse unei varietăți de tratamente termice destul de frecvente în procesarea alimentelor (Escudero, Mora și Toldrá, 2014). Autorii au examinat efectele încălzirii pentru un anumit timp (50 ° C, 72 ° C, 90 ° C și 117 ° C timp de 6 minute) și timpul pentru o anumită temperatură (3, 6, 15, 30 și 60 min la 117 ° C). Așa cum se arată în FIG. 12.3, peptidele bioactive testate au rămas active în toate cazurile, indicând o bună stabilitate împotriva încălzirii.
FIG. 12.3. Stabilitatea peptidelor inhibitoare ECA derivate din șuncă spaniolă vindecată după uscare după: (A) 6 min de incubație la diferite temperaturi și (B) 117 ° C de incubație în momente diferite.
Reprodus din Escudero, E., Mora, L. și Toldrá, F. (2014) Stabilitatea inhibitorilor ECA peptidelor de șuncă împotriva tratamentului termic și a digestiei in vitro. Food Chemistry 161, 305-311 cu permisiunea lui Elsevier.
Alte studii au arătat descoperiri similare, cum ar fi peptidele inhibitoare ECA din sucul de gătit al tonului care au rămas stabile într-o gamă largă de temperaturi (20-100 ° C timp de 2 ore) fără a modifica compoziția datorită tratamentelor (Hwang, 2010), precum și soia proteine după tratamente la 20 ° C, 40 ° C, 60 ° C, 80 ° C și 100 ° C timp de 2 ore (Wu și Ding, 2002). Au fost studiate fierberea și prăjirea ouălor (sub formă de albușuri, gălbenușuri și ouă întregi), urmată de digestia simulată gastro-intestinală. Digeririle de ouă prăjite au avut o activitate inhibitoare a ECA mai mare și au fost raportate șapte peptide, în mare parte tripeptide (Majumder & Wu, 2009).
Impactul pasteurizării a fost studiat în brânza de oaie maturată (Pisanu și colab., 2015). Pasteurizarea brânzei a dus la unele modificări ale identității și abundenței peptidelor. Proteoliza a avut o intensitate mai mică în brânzeturile din lapte pasteurizat, menținând în același timp o omogenitate mai bună. Expunerea laptelui la căldură ar putea afecta accesibilitatea proteinelor la clivajul enzimatic, reducându-i susceptibilitatea la proteoliză. Acest lucru poate fi chiar crescut prin inactivarea căldurii fie a bacteriilor indigene, fie a enzimelor proteolitice. De fapt, catepsina D este destul de sensibilă la pasteurizare, rămânând doar aproape 8% din activitate (Hayes și colab., 2001). Bioactivitatea raportată a fost, de asemenea, mai mare la acele brânzeturi obținute din lapte crud.
Gătirea cărnii de vită îmbătrânite (la 70 ° C timp de 45 de minute) a avut un efect slab asupra profilului peptidic (Mora și colab., 2017). Cu toate acestea, digestia in vitro a cărnii fierte a produs o creștere a activității inhibitoare a ECA și a antioxidantului. Acest lucru s-ar putea datora eliberării de peptide bioactive mai mici de către enzimele gastrointestinale. (Mora și colab., 2017). Cu toate acestea, digestia gastro-intestinală in vitro simulată a pieptului de pui gătit încălzit la 70 ° C timp de 0,5 h a arătat o activitate inhibitoare a ECA mai mare decât un tratament termic mai intens, cum ar fi 121 ° C timp de 1 oră (Sangsawad, Roytrakul și Yongsawatdigul, 2017).
S-a raportat că peptidele antioxidante din calamar au o rezistență puternică la căldură, păstrând> 94% din activitate atunci când sunt încălzite la 100 ° C. O astfel de activitate a fost menținută în condiții acide, dar s-a pierdut când pH-ul a crescut (Hu și colab., 2017). S-a raportat că peptida SNAAC are o bună stabilitate după încălzire la diferite temperaturi (50 ° C, 72 ° C și 90 ° C) timp de 10 minute și în prezența de până la 8% NaCl, dar activitatea sa antioxidantă a fost foarte redusă atunci când expus la 100 ° C în comparație cu controlul la 37 ° C (Gallego, Mora, Reig și Toldrá, 2018).
Gătitul are un efect asupra conținutului de carnozină și anserină, care sunt histidil dipeptide cu activitate antioxidantă și acțiune tampon (Jayasena și colab., 2015). Astfel de pierderi sunt raportate în sucurile de gătit, deoarece carnosina și anserina sunt destul de solubile (Peiretti și colab., 2011; Purchas, Rutherfurd, Pearce, Vather și Wilkinson, 2004). Excepția este prepararea la microunde, deoarece conținutul de histidil dipeptidă a rămas destul de mare (Peiretti și colab., 2011). Compușii solubili, cum ar fi peptidele bioactive și aminoacizii, se pierd în sucul de gătit al creveților și al stridiei (Cambero și colab., 1998; Kim și colab., 2000).
Proprietățile nutraceutice ale peptidelor bioactive lactate
Concluzie
Peptidele bioactive au atras mult interes științific datorită atributelor lor biofuncționale intenționate. Literatura actuală a arătat peptide bioactive derivate din proteinele din laptele de bovine că proprietățile lor multifuncționale versatile nutritive, bine stabilite prin intermediul diferitelor metode, posedă activități biologice remarcabile și proprietăți de promovare a sănătății. În general, se pare că peptidele bioactive derivate din proteine din lapte pot fi utilizate ca o componentă sănătoasă eficientă oral și au potențialul de a fi utilizate în producția de alimente funcționale cu proprietăți de promovare a sănătății. Cu toate acestea, se pare că ar trebui efectuate cercetări suplimentare în acest domeniu pentru a evalua efectele in vivo de promovare a sănătății și biodisponibilitatea peptidelor bioactive originate de proteine din lapte la subiecți umani și pentru a elucida mecanismele lor moleculare de acțiune.
Fortificarea în băuturi
3.6.3 Fortificarea peptidelor bioactive
Peptidele bioactive pot fi obținute din proteoliza diferitelor proteine de către enzime și, de asemenea, produse în timpul digestiei intestinale a nutrienților, funcționează ca un regulator fiziologic potențial al metabolismului. Recent, o mare atenție a fost acordată studierii rolurilor bioactive ale peptidelor bioactive ca efecte antioxidante, antihipertensive, hipocolesterolemiante, antiinflamatorii și imunomodulatoare (Umayaparvathi și colab., 2014; Hernández-Ledesma și colab., 2014). Anumite proteine alimentare, în principal cazeine din lapte, pot acționa ca un precursor al peptidelor bioactive cu beneficii fiziologice variate (Özer și Kirmaci, 2010). Un exemplu de băutură disponibilă în comerț cu peptide bioactive adăugate este Evolus de la Valio Ltd. (Finlanda). Peptidele biologic active sintetizate de L. helveticus din cazeina din lapte au efectul benefic major în ea și pot fi adăugate în produsele pentru băuturi (Prado și colab., 2008).
Peptide bioactive în alimente fermentate
Abstract
Peptidele bioactive sunt fragmente proteice cu greutate moleculară mică de 2-20 reziduuri de aminoacizi care prezintă efecte fiziologice benefice in vivo. Generarea de peptide bioactive în timpul fabricării alimentelor fermentate este bine documentată. Aceste peptide sunt eliberate din proteinele precursoare în timpul proceselor de fermentare sau maturare de către enzime endogene sau microbiene derivate din culturi inițiale sau nonstarter. Producția de peptide bioactive în alimentele fermentate prezintă un mare interes, deoarece acestea prezintă mai multe bioactivități interesante legate de promovarea sănătății, cum ar fi antihipertensive, opioide, antioxidante, imunomodulatoare, stimulatoare de mucină, insulinomimetice și antiosteoporotice, printre altele. Randamentele crescute de peptide bioactive în alimentele fermentate pot fi obținute prin mai multe abordări, incluzând selecția microorganismelor proteolitice ridicate, combinația adecvată de co-culturi, optimizarea condițiilor de procesare și adăugarea componentelor mediului. În acest capitol, sunt analizate cele mai recente investigații care susțin beneficiile potențiale pentru sănătate ale peptidelor bioactive în alimentele fermentate pe sistemele cardiovasculare, nervoase, gastrointestinale și imune, precum și pe oase și țesut adipos.
Alimente medicinale marine
I. Introducere
Atribute de sorg și mei care promovează sănătatea legate de fitochimie
Kwaku G. Duodu, Joseph M. Awika, în Sorg și mei (ediția a doua), 2019
5 Chimia peptidelor bioactive în sorg și mei
Alimente medicinale marine
II Dezvoltarea peptidelor antihipertensive derivate din pești marini
Subproduse proteice de prelucrare marină: o sursă de ingrediente alimentare biofuncționale
A.C. Neves,. R.J. FitzGerald, în Protein Byproducts, 2016
4 Biodisponibilitate
BAP-urile pot fi eliberate din proteinele alimentare în timpul digestiei gastro-intestinale și prin fermentare, hidroliză enzimatică și în timpul procesării alimentelor. Efortul de cercetare în domeniul BAP a crescut în ultimii ani. Mai multe studii arată că peștii și crustaceele au potențial ca sursă de BAP pentru generarea de alimente biofuncționale (Harnedy & FitzGerald 2013a). Cu toate acestea, trebuie efectuate mai multe studii pentru a determina dacă BAP-urile din surse de pește și crustacee (tabelele 4.1 și 4.2) își mențin activitățile atunci când sunt supuse diferitelor tehnici de procesare a alimentelor.
Cu toate acestea, există mai multe strategii care pot fi utilizate pentru a îmbunătăți biodisponibilitatea BAP-urilor derivate marine. Dintre acestea, modificarea terminalelor N și C; modificarea structurală, inclusiv alchilarea și glicozilarea; și încapsularea sa dovedit, de asemenea, că îmbunătățește biodisponibilitatea peptidelor. Mai mult, peptidele care conțin un procent ridicat de aminoacizi Pro și Hyp par a fi mai rezistente la hidroliza de către enzimele gastrointestinale (FitzGerald și Meisel, 2000). Unele dintre aceste abordări au fost deja utilizate pentru îmbunătățirea biodisponibilității BAP de pești și crustacee. De exemplu, s-a dovedit că încapsularea peptidelor de ton în lipozomi este eficientă în conservarea capacității lor antihipertensive la șobolani spontan hipertensivi (Hwang și colab., 2010).
- Biguanides - o prezentare generală Subiecte ScienceDirect
- Derivat Biguanide - o prezentare generală Subiecte ScienceDirect
- Dietele artificiale - o prezentare generală Subiecte ScienceDirect
- Association Constant - o prezentare generală Subiecte ScienceDirect
- Mouse CD-1 - o prezentare generală Subiecte ScienceDirect