Aciditatea solului
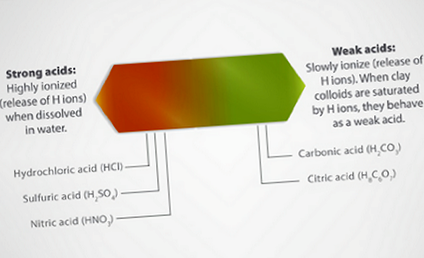
Un acid este definit ca o substanță care tinde să elibereze ioni de hidrogen (H⁺). În schimb, o bază este definită ca o substanță care eliberează ioni hidroxil (OH⁻). Toți acizii conțin ioni de hidrogen, iar puterea acidului depinde de gradele de ionizare (eliberare de ioni de hidrogen) ai acidului. Cu cât mai mulți ioni de hidrogen sunt deținuți de complexul de schimb al unui sol în raport cu ionii de bază (Ca, Mg, K) ținută, cu atât aciditatea solului este mai mare.
NOTĂ: Aluminiul (Al) contribuie, de asemenea, la aciditatea solului, dar pentru simplitate, o discuție suplimentară asupra acidității solului va fi limitată la H ca cauză a acidității solului.
PH-ul solului dorit pentru producția optimă de cultură pH Gamă
PH-ul dorit gama pentru creșterea optimă a plantelor variază între culturi. În timp ce unele culturi cresc cel mai bine în intervalul 6,0-7,0, altele cresc bine în condiții ușor acide. Proprietățile solului care influențează necesitatea și răspunsul la var variază în funcție de regiune. Cunoașterea solului și a culturii este importantă în gestionarea pH-ului solului pentru cea mai bună performanță a culturilor.
Solurile devin acide când elemente bazice precum calciu, magneziu, sodiu și potasiu deținute de coloizi din sol sunt înlocuite cu ioni de hidrogen. Solurile formate în condiții de precipitații anuale ridicate sunt mai acide decât solurile formate în condiții mai aride. Astfel, majoritatea solurilor din sud-est sunt în mod inerent mai acide decât solurile din Vestul Mijlociu și îndepărtatul de Vest.
Solurile formate în condiții de precipitații reduse tind să fie de bază cu pH-ul solului lecturi în jurul valorii de 7.0. Agricultura intensivă de mai mulți ani cu îngrășăminte azotate sau gunoi de grajd poate duce la acidificarea solului. De exemplu, în regiunile de grâu din Kansas și Oklahoma, care au pH-ul solului de 5,0 și mai puțin, toxicitatea aluminiului în grâu și un răspuns bun la calciu au fost documentate în ultimii ani.
Factori care afectează aciditatea solului
Precipitaţii
Precipitațiile contribuie la aciditatea solului. Apa (H₂O) se combină cu dioxidul de carbon (CO₂) pentru a forma un acid slab - acid carbonic (H₂CO₃). Acidul slab se ionizează, eliberând hidrogen (H⁺) și bicarbonat (HCO₃). Ionii de hidrogen eliberați înlocuiesc ionii de calciu deținuți de coloidii solului, determinând aciditatea solului. Ionii de calciu deplasați (Ca⁺⁺) se combină cu ionii de bicarbonat pentru a forma bicarbonat de calciu, care, fiind solubil, este levigat din sol. Efectul net este aciditatea crescută a solului.
Îngrășăminte cu azot
Nivelurile de azot afectează pH-ul solului. Sursele de azot - îngrășăminte, gunoi de grajd, leguminoase - conțin sau formează amoniu. Aceasta crește aciditatea solului, cu excepția cazului în care planta absoarbe direct ionii de amoniu. Cu cât rata de fertilizare cu azot este mai mare, cu atât acidificarea solului este mai mare. Deoarece amoniul este transformat în nitrat în sol (nitrificare), se eliberează ioni H. Pentru fiecare kilogram de azot ca amoniu, este nevoie de aproximativ 1,8 kilograme de carbonat de calciu pur pentru a neutraliza aciditatea reziduală. De asemenea, azotatul care este furnizat sau format se poate combina cu cationi de bază, cum ar fi calciu, magneziu și potasiu și levigare din solul superior în subsol. Pe măsură ce aceste baze sunt îndepărtate și înlocuite cu ioni H, solurile devin mai acide.
Plantele
Leguminoasele precum soia, lucerna și trifoiul tind să ia mai mulți cationi proporțional cu anionii. Acest lucru determină eliberarea ionilor H din rădăcinile plantelor pentru a menține echilibrul electrochimic în țesuturile lor. Rezultatul este o acidificare netă a solului.
Aciditatea subsolului
Chiar dacă primii 6 centimetri de sol prezintă un pH peste 6,0, subsolul poate fi extrem de acid. Când pH-ul subsoluluiScade sub 5,0, aluminiul și manganul din sol devin mult mai solubili, iar în unele soluri pot fi toxice pentru creșterea plantelor. Bumbacul și, într-o oarecare măsură, soia sunt exemple de culturi care sunt sensibile la nivelurile de aluminiu foarte solubile din subsol, iar randamentele culturilor pot fi reduse în condiții de pH scăzut al subsolului. Dacă ați observat zone de plante cascadate în câmpul dvs., luați un eșantion de subsol în aceste zone. Dacă pH-ul solului este extrem de acid (sub 5,2), varul trebuie aplicat devreme în toamnă și întors cât mai adânc posibil.
Liming Soil Pays
Corectarea acidității solului prin utilizarea varului este fundamentul unui bun program de fertilitate a solului. Varul face mai mult decât doar să corecteze aciditatea solului. De asemenea:
Furnizează nutrienți esențiali ai plantelor, Ca și Mg, dacă se utilizează var dolomitic
Face alți nutrienți esențiali mai disponibili
Împiedică elemente precum Mn și Al să fie toxice pentru creșterea plantelor.
Materiale de calcare
Materialele calcaroase conțin calciu și/sau magneziu sub forme, care atunci când sunt dizolvate, vor neutraliza aciditatea solului. Nu toate materialele care conțin calciu și magneziu sunt capabile să reducă aciditatea solului. De exemplu, gipsul (CaSO₄) conține Ca în cantități apreciabile, dar nu reduce aciditatea solului. Deoarece se hidrolizează în sol, gipsul se transformă într-o bază puternică și un acid puternic, așa cum se arată în următoarea ecuație:
CaSO₄ + 2H₂O = Ca (OH) ² + H₂SO₄
Ca (OH) ² și H₂SO₄ formați se neutralizează reciproc, rezultând un efect neutru al solului. Pe de altă parte, atunci când var calcitic (CaCO₃) sau dolomitic (Ca Mg (CO₃) ²) se adaugă în sol, se hidrolizează (se dizolvă în apă) până la o bază puternică și un acid slab.
CaCO3 + 2H₂O = Ca (OH) ² + H₂CO₃
Hidroxidul de calciu este o bază puternică și se ionizează rapid la ionii Ca⁺⁺ și OH⁻. Ionii de calciu înlocuiesc ionii H absorbiți pe coloidul solului și astfel neutralizează aciditatea solului. Acidul carbonic format (H₂CO₃) este un acid slab și se ionizează parțial la ioni H⁺ și CO₂⁻². Prin urmare, efectul net este că mai mulți ioni de H se eliberează în sol și, în consecință, aciditatea solului este neutralizată.
Calcar calcitic
Calcarul măcinat conține în principal carbonat de calciu și are în general mai puțin de 1 până la 6% magneziu. Valoarea sa de neutralizare depinde de puritatea și finețea de măcinare.
Calcar Dolomitic
Calcarul măcinat este un amestec de carbonat de calciu și carbonat de magneziu. În unele state, trebuie să conțină cel puțin 6% Mg pentru a fi clasificat ca var dolomitic. Efectul său neutralizant depinde și de puritatea și finețea măcinării.
Lamaie hidratata
Varul hidratat (Ca (OH) ²) este hidroxid de calciu, numit uneori stins sau var de constructie. Varul hidratat este praf, cu acțiune rapidă și oarecum neplăcut de manevrat. Valoarea de neutralizare variază între 120 și 135 în comparație cu carbonatul de calciu pur. Cincisprezece sute de kilograme de var hidratat cu o valoare de neutralizare de 135 este echivalent cu 2.000 de kilograme de var agricol cu o valoare de neutralizare de 100.
Marne
Marnele sunt depozite de carbonat de calciu amestecate cu argilă și nisip care se găsesc în cea mai mare parte în secțiunea Câmpiei de coastă din statele de est. Valoarea lor de neutralizare variază de obicei între 70 și 90%, în funcție de cantitatea de impurități, în mare parte argilă, pe care o conțin. Utilitatea lor ca material de calciu depinde de valoarea lor de neutralizare și de costul prelucrării. Acestea sunt adesea plastice și aglomerate și trebuie uscate și pulverizate înainte de aplicarea pe sol. Marnele sunt de obicei sărace în magneziu. Reacția lor cu solul este aceeași cu varul calcitic.
Zgura de bază
Zgura de bază este un produs al metodei de bază pentru obținerea oțelului. Calciul conținut este sub formă de silicat de calciu și reacționează cu acizii solului într-un mod similar cu calcarul măcinat. Valoarea sa de neutralizare variază de la 60 la 70, dar din moment ce zgura de bază are în general particule mai mici decât varul agricol, tinde să schimbe pH-ul solului mai rapid decât varul convențional agricol. De asemenea, conține P₂O₅ variind de la 2 la 6 procente și unii micronutrienți și magneziu.
Cojile de stridii la sol
Cojile de stridii și alte scoici sunt în mare parte carbonat de calciu. Ele produc un material de calciu satisfăcător atunci când sunt măcinate fin și au o valoare neutralizantă de la 90 la 110. Deoarece sunt compuse în principal din carbonat de calciu, conțin puțin sau deloc magneziu.
Tei fluid
Un material de calciu denumit în mod obișnuit var de lichid constă în general din calcar fin măcinat suspendat în apă la un raport de aproximativ 50 la sută apă la 50 la sută calcar. În cele mai multe cazuri, producătorii de var fluid utilizează calcar foarte fin măcinat - dintre care majoritatea vor trece printr-un ecran de 200 ochiuri. Varul fluid este capabil să schimbe pH-ul solului într-o perioadă de timp relativ scurtă. Acesta este un avantaj distinct în situațiile în care calcarea a fost întârziată chiar înainte de plantare sau în situații în care pH-ul scăzut al solului este descoperită după plantarea unei culturi. Rețineți, deoarece varul fluid conține aproximativ 50% apă, aceasta înseamnă că un fermier care aplică var fluid cu o rată de 1.000 de lire pe acru ar aplica doar 500 de kilograme de calcar.
Tei peletizat
Varul peletizat este calcar agricol fin măcinat care este peletizat cu ajutorul lutului sau lianților sintetici pentru a produce pelete în intervalul de 5 până la 14 ochiuri. De obicei, aproximativ 70% din calcarul inițial, înainte de peletizare, trece prin sitele de 100 până la 200 de ochiuri. Poate fi împrăștiat cu distribuitoare de îngrășăminte tradiționale, ceea ce îl face atractiv de utilizat. Cercetări nepublicate indică faptul că varul peletat ar trebui să fie lăsat să reacționeze cu o bună precipitație sau irigare pe suprafața solului pentru a dispersa peletele înainte ca acesta să fie amestecat cu solul. Dacă cantitățile de 250 până la 500 de kilograme din acest material de calciu sunt amestecate cu solul înainte ca peleta să se "topească", un volum limitat de sol poate fi afectat de fiecare peletă și pH-ul dorit reglarea stratului de plug nu poate fi realizată.
Utilizarea varului fluid și a varului peletizat
Fluidul și varul peletat sunt surse excelente de var care trebuie utilizate în anumite circumstanțe, cum ar fi: Corecția unui pH scăzut al solului starea după plantarea unei culturi; O schimbare rapidă a pH-ului solului dacă calcarea este întârziată chiar înainte de plantarea unei culturi; Pentru menținerea pH-ului în intervalul optim pentru creșterea și randamentul plantelor. Cu toate acestea, aceste două materiale calcaroase nu trebuie depuse pentru a menține pH-ul solului în timpul întregului sezon de recoltă, dacă este aplicat la o pătrime din rata recomandată de var.
Finețea măcinării este importantă în selectarea materialelor de tăiere
Calitatea varului este măsurată prin cât de eficient neutralizează aciditatea solului. Acest lucru este determinat în mare măsură de puritatea sa chimică și de mărimea particulelor. Puritatea varului este exprimată ca echivalent carbonat de calciu (CCE). Aceasta este o măsură a cât de mult din material poate reacționa cu solul pentru a neutraliza aciditatea în condiții ideale în comparație cu carbonatul de calciu pur. Calcarul ar trebui să aibă o valoare neutralizantă de cel puțin 90%. Chiar dacă CCE-ul de var este satisfăcător, nu va neutraliza aciditatea solului decât dacă calcarul este măcinat fin. În încercarea de a ajunge la o calificare mai precisă a varului pentru a măsura eficacitatea materialului calciar, laboratoarele de testare a solului din unele state au adoptat un conținut eficient de carbonat de calciu pentru evaluarea materialelor calcaroase. Se obține un rating de eficiență prin înmulțirea echivalentului de carbonat de calciu de ori mai mare decât conținutul efectiv de carbonat de calciu, care se bazează pe finețea materialului calciar.
Factori de eficiență pentru materialele de îndepărtare
Următorul exemplu de calcul al „valorii de neutralizare efectivă” (ENV), utilizat de Universitatea din Illinois, servește pentru a ilustra importanța dimensiunii particulelor de var în neutralizarea potențială a acidității solului. ENV = Eficiență totală de finețe x (% echivalent carbonat de calciu/100).
Să presupunem că un material de calciu are un echivalent de 96% carbonat de calciu. După screening, materialul de calciu are următoarea distribuție a mărimii particulelor:
Factorul de eficiență de finețe total poate fi calculat după cum urmează pentru exemplul de material:
+Eficiența ochiurilor 8 este de 5%, deci 04 x 5 = 0,20
–Eficiența ochiurilor de la 8 la 30 este de 20%, deci .25 x 20 = 5,00
–30 la +60 eficiența ochiurilor de plasă este de 50%, deci .26 x 50 = 13.00
–Eficiența ochiurilor de plasă 60 este de 100%, deci .45 x 100 = 45,00
Eficiența totală a fineții pentru primul an = 63,20
Prin urmare, conținutul efectiv de carbonat de calciu al ENV = 63,20 x (96/100) = 60,67 pentru acest exemplu de material calciar pentru primul an.
Aceste calcule permit unui cultivator să determine valoarea pe termen mai scurt și mai lung a materialului de calciu care este luat în considerare pentru cumpărare.
Majoritatea statelor atlantice și sud-estice folosesc soluția Mehlich I (acid dublu) pentru a extrage P, K, Ca, Mg, Mn și Zn. Majoritatea statelor din Midwestern folosesc soluția Bray I pentru extragerea P. Pentru K, Mg și Ca, se folosește acetat de amoniu. În regiunile cu soluri calcaroase, cum ar fi centura de porumb din vest și Marea Câmpie, testul Olsen este utilizat pentru a extrage P.
Factori de eficiență: calendarul, plasarea și frecvența de aplicare
Sincronizare
Pentru rotațiile culturilor care includ leguminoase precum lucerna sau trifoiul, varul trebuie aplicat pentru a permite suficient timp să reacționeze cu solul înainte de plantarea leguminoaselor. În mod ideal, varul ar trebui să fie aplicat cu trei până la șase luni înainte de însămânțarea culturii vizate. Aplicările chiar mai târziu chiar înainte de plantare, cu o bună încorporare a solului, pot fi în continuare benefice pe solurile puternic acide. Se va produce încă o reducere a acidității solului, deși pH-ul maxim creșterile nu se ating în mod normal decât la aproximativ un an de la aplicarea calcarului agricol tipic.
Plasament
Frecvență
Cu cât producția de culturi este mai intensă, cu atât este mai mare utilizarea îngrășămintelor azotate sau a gunoiului de grajd și cu cât randamentele recoltei (și eliminarea nutrienților) sunt mai mari, cu atât va fi mai mare și mai frecventă nevoia de var. Eșantionarea solului este cel mai bun mod de a evalua pH-ul solului nivelurile și nevoia de var.
Alcalinitatea în exces - naturală și indusă
Dacă apa din puț conține semnificativ mai mult sodiu în comparație cu calciu sau magneziu, poate exista un risc de acumulare de sodiu pe soluri care nu se usucă ușor. Aceasta este mai des o preocupare mai mare în regiunile aride decât în regiunile umede. Solurile cu niveluri naturale ridicate de sodiu sau cele care au primit cantități mari de bicarbonat de sodiu prin irigare pot avea pH niveluri de până la 8,5 sau mai mari. Teoretic, dacă sodiul nu este un factor, chiar dacă se aplică cantități mari de carbonat de calciu sau magneziu, pH-ul solului nu va depăși 8,2-8,3. La pH 8.2, carbonatul din sol atinge un echilibru cu nivelul de dioxid de carbon din atmosferă. Dacă se suspectează sau se știe că apa pentru irigații produce cantități semnificative de săruri de var și/sau săruri solubile, probele de sol trebuie colectate mai frecvent pentru a monitoriza mai bine pH-ul solului, salinitatea și echilibrul cationic. Calitatea apei pentru irigații trebuie, de asemenea, monitorizată periodic.
Corectarea excesului de alcalinitate prin acidularea solului
Sulful elementar poate fi utilizat pentru a acidifica solul alcalin la pH-ul dorit gamă. Poate fi folosit și pentru menținerea pH-ului în domeniul dorit, pe soluri care tind să devină alcaline odată cu gestionarea. Când sulful elementar este aplicat pe sol, acesta se combină cu oxigen și apă pentru a forma acid sulfuric. Această oxidare a sulfului este cauzată de anumite microorganisme și poate dura între trei și șase săptămâni sau mai mult, în funcție de condițiile solului. Cu cât sulful este mai fin, cu atât este mai rapidă conversia în sulfat și acid sulfuric diluat. Rata de scădere a pH-ului cu sulf elementar poate fi similar cu rata pH-ului creștere provocată de calciu. Cu cât este mai mult carbonat de calciu liber și solul este mai tamponat, cu atât va dura mai mult timp pentru a acidifica solul. De asemenea, va fi nevoie de mai mult sulf pe solurile cu carbonați liberi prezenți. Sulfatul de aluminiu este un alt amendament folosit adesea în horticultura ornamentală pentru acidificarea solului în paturile vegetale. Cu toate acestea, este nevoie de mai mult pentru a produce aceeași acidificare ca și sulful elementar, chiar dacă oferă avantajul unei reacții mai rapide. În comparație cu sulful elementar, rata poate fi necesară de două până la șapte ori mai mare. Puțin din acest amendament este utilizat în agricultura comercială.
NOTĂ: Dacă sunt prezenți carbonați liberi, vor fi necesare rate mai mari decât cele indicate. Referință: „Western Fertilizer Handbook”, ediția a opta. Asociația de îngrășăminte din California
Proceduri
Ca și în cazul testării solului, o fază importantă a analizei plantelor este colectarea probelor. Compoziția plantei variază în funcție de vârstă, porțiunea plantei prelevate, starea plantei, soiul, vremea și alți factori. Prin urmare, este necesar să urmați instrucțiunile de eșantionare dovedite. Majoritatea laboratoarelor furnizează fișe de instrucțiuni pentru eșantionarea diferitelor culturi, plus fișe de informații și instrucțiuni pentru pregătirea și depunerea probelor. De obicei, se sugerează ca eșantioane atât din domeniile bune, cât și din cele problematice să fie trimise spre comparație atunci când diagnosticul este obiectivul. Deoarece experiența și cunoștințele sunt vitale în eșantionarea corectă a plantelor, consilierii sau consultanții agricoli fac adesea treaba.
- Stallion Nutrition Resursa nr. 1 pentru fermele de cai, grajduri și instructori de echitație Managementul grajdului
- Consumul de iaurt contribuie la îndeplinirea cerințelor privind aportul de nutrienți; Iaurtul în nutriție
- Carduri de antrenament pe module; Secțiunea 6 - principiile nutriției și controlului greutății; Quizlet
- Importanța nutriției pentru managementul îngrijirii rănilor Shield HealthCare
- Nutriția roșiilor; Greenlife Crop Protection Africa