Postul provoacă o scădere accentuată a concentrațiilor de leptină și efectele hipotalamice rezultate stimulează pofta de mâncare.
Termeni asociați:
- Insulină
- Glucoză
- Nivelul glucozei
- Obezitatea
- Nivelul de sânge al glucozei
- Diabetul zaharat
- Hipoglicemie
- Rezistenta la insulina
- Diabet zaharat non-dependent de insulină
Descărcați în format PDF
Despre această pagină
Depistarea și diagnosticarea diabetului de tip II
Camille Michaud MD, în diabetul de tip II pediatric, 2019
Beneficiile și provocările măsurării glicemiei în post
Datele privind glucoza la jeun oferă o stare de evaluare consecventă, cunoscută pentru interpretarea datelor și s-a dovedit că prezintă un risc pronostic mai puternic de dezvoltare a diabetului. 31 Persoanele cu zaharuri din sânge diagnosticate în repaus alimentar,> 125 mg/dL, pot fi în continuare asimptomatice din cauza hiperglicemiei. 1,4,26,27 Identificarea timpurie a zahărului din sânge cu diabet zaharat în cadrul studiilor de repaus alimentar poate duce la implementarea precoce a tratamentului și poate crește realizarea controlului glicemic precoce. O a doua vizită pentru monitorizarea completă a laboratorului nu este întotdeauna garantată din cauza conformității pacientului și, prin urmare, nu poate avea ca rezultat date decât o evaluare controlată de aport. Deoarece toleranța la glucoză în post poate fi intactă și toleranța la glucoză afectată poate să nu fie identificată înainte de o sarcină de glucoză, studiile la post pot lipsi în continuare pe cei cu risc crescut sau cu un diagnostic actual de diabet. 32
DIETA KETOGENICĂ Managementul dietetic al epilepsiei: rolul corpurilor de glucoză și cetonă
Postul și dieta ketogenică
Deși este eficientă în gestionarea tulburărilor convulsive, postul periodic nu este practic pentru gestionarea convulsiilor pe termen lung, datorită în mare parte problemelor de conformitate. În consecință, dieta ketogenică cu conținut ridicat de grăsimi cu conținut scăzut de carbohidrați (KD) a fost dezvoltată pentru a imita efectele fiziologice ale postului (cetoza) fără restricții severe ale alimentelor sau foamete. KD este eficient în gestionarea convulsiilor intratabile la copii și poate fi, de asemenea, eficient în gestionarea tulburărilor convulsive la adulți. În plus, KD este eficient în reducerea epileptogenezei și convulsiilor la modelele animale de epilepsie. Deși mecanismele prin care KD inhibă susceptibilitatea la convulsii rămân nerezolvate, sunt implicate probabil modificări ale metabolismului energetic al creierului.
Rolul corpurilor cetonice (β-hidroxibutirat și acetoacetat) și al glucozei în efectele protectoare ale convulsiei postului sau KD este în curs de investigare activă. Nivelurile crescute de cetonă plasmatică au fost asociate cu protecția convulsivă în unele studii, dar nu și în alte studii. Deoarece utilizarea cetonei în creier poate depinde de nivelurile plasmatice de cetone, glucoză și alți metaboliți, pot fi asigurate asocierile între protecția convulsivă și nivelurile cetonelor plasmatice. De asemenea, nivelurile de glucoză din sânge rămân constante în timpul tratamentului KD în unele studii, dar sunt reduse în timpul tratamentului în alte studii. Puține studii au investigat relația dintre cetone, glucoză și susceptibilitatea la convulsii în cadrul terapiilor de dietă antiepileptică pe termen lung.
Efectul vârstei, al genului, al dietei, al exercițiului și al etniei asupra rezultatelor testelor de laborator
Modificări legate de post/înfometare asupra valorilor clinice de laborator
Postul (scăderea aportului caloric) și foamea (fără aport caloric) inițiază tulburări metabolice complexe. Mulți indivizi postesc în conformitate cu cultura și tradițiile religioase, astfel încât înțelegerea efectelor postului asupra rezultatelor de laborator este primordială. În termen de 3 zile de la post, concentrațiile de glucoză cresc cu până la 18 mg/dL, în ciuda eforturilor coordonate ale organismului de a conserva proteinele. Ulterior, insulina scade rapid, în timp ce secreția de glucagon crește într-un efort de a readuce glicemia în concentrații pre-post. Individul de post suferă atât lipoliză, cât și ketogeneză hepatică. Starea de acidoză metabolică include acid acetoacetic seric crescut, β-hidroxibutirat și acizi grași și pH redus, pCO2 și bicarbonat. Necroza focală a ficatului este responsabilă de fluxul sanguin hepatic redus și filtrarea glomerulară afectată și clearance-ul creatininei; concentrații serice crescute de ALT, AST, bilirubină, creatinină și lactat [3] .
Depozitele de energie reduse ale organismului reprezintă în principal scăderi semnificative de până la 50% atât în concentrația totală, cât și în cea a triiodotironinei libere. Postul afectează în mod diferit concentrațiile de lipide. În decurs de 6 zile, colesterolul și trigliceridele cresc în timp ce concentrațiile HDL scad. Brusca crește de până la 15 ori plasma pre-rapidă în concentrațiile hormonilor de creștere au loc la începutul postului. În termen de 3 zile de la finalizarea unui post, concentrația plasmatică a hormonului de creștere revine la niveluri pre-rapide. Concentrațiile de albumină, prealbumină și complement 3 scad în timpul unui post prelungit. Cu toate acestea, aportul de proteine în urma postului readuce rapid albumina, prealbuminul și complementul 3 la concentrațiile pre-post.
Înfometarea declanșează eliberarea de aldosteron și excreția excesivă de amoniac urinar, calciu, magneziu și potasiu. În schimb, excreția urinară de fosfor din organism scade. După o perioadă scurtă de timp, 14 ore rapid, concentrațiile sanguine de acetoacetat, β-hidroxibutirat, lactat și piruvat încep să crească. Înfometarea pe termen lung care durează 40-48 de ore determină o creștere de până la 30 de ori a β-hidroxibutiratului. Se pare că înfometarea timp de 4 săptămâni a crescut semnificativ AST, creatinina și acidul uric (20-40%) și a scăzut GGT, trigliceridele și ureea (20-50%).
După un aport caloric adecvat, organismul începe să readucă constituenții din sânge la concentrații pre-post și reține sodiul ca urmare a scăderii excreției urinare atât a sodiului, cât și a clorurii. Ulterior, aldosteronul depășește concentrațiile de post, iar excreția urinară de potasiu revine încet la normal.
CONSIDERAȚII SPECIALE LA PACIENTUL PEDIATRIC
Jennifer S. Singer MD, Andrew L. Freedman MD, în complicațiile chirurgiei urologice (ediția a patra), 2010
Post preoperator
Postul este conceput pentru a minimiza riscul de aspirație a conținutului gastric la inducerea anestezică și postoperator. La copii, timpul necesar postului trebuie să echilibreze riscul aspirației cu riscul de deshidratare, în special la sugarii mici. Cele mai importante evenimente de aspirație apar la copiii mai mici supuși procedurilor urgente sau de urgență pentru ileus sau obstrucție intestinală. 24 Evenimentele de aspirație ușoară au rareori sechele clinice semnificative, importante în populația noastră de pacienți predominant ambulatori. 24 În schimb, deshidratarea complică accesul venos intraoperator și modifică hemodinamica la inducerea anestezică. Tabelul 55-1 prezintă îndrumările actuale pentru durata recomandată de post în funcție de dieta copilului. Pacienții internați preoperator pot fi suplimentați cu lichide intravenoase (IV) pentru a preveni deshidratarea.
Evaluarea siguranței, inclusiv problemele actuale și emergente în patologia toxicologică
Dieta/Post
Postul, consumul crescut sau scăzut de furaje și compoziția specifică a furajelor pot influența rezultatele experimentale și pot avea impact asupra rezultatelor patologiei clinice. Animalele pot fi postite pentru a reduce prezența lipemiei în probele de ser sau plasmă, pentru a reduce variabilitatea rezultatelor analiților sensibili la durata postului, cum ar fi glucoza și trigliceridele, precum și pentru a reduce conținutul tractului intestinal înainte de la necropsie și pentru a oferi histologie hepatică mai uniformă. Există o serie de referințe care oferă informații despre postul diferitelor specii, deși rezultatele variază între studii, cel mai probabil datorită duratei postului și a vârstei, sexului și tulpina animalelor.
În interpretarea datelor de patologie clinică, este important să se ia în considerare faptul că unele grupuri de animale pot avea greutate corporală scăzută și consum de alimente datorită efectelor administrării articolului testat, pe lângă un post peste noapte. Modificările induse de post ale rezultatelor patologiei clinice la șobolani au fost în concordanță cu hemoconcentrarea datorată consumului scăzut de apă și modificării nutriției și funcției metabolice, cele mai multe modificări apar la 16 ore și modificări minime ulterioare între 16 și 48 de ore de post.
Postul peste noapte al șobolanilor poate duce la creșterea globulelor eritrocitare, Hgb, Hct, PT și APTT, Cr, bilirubină, AST, SDH și CK și scăderea globulelor, glucozei serice, BUN, ALT, ALP, Ca 2+, colesterol, trigliceride și dioxid de carbon. Postul peste noapte al șoarecilor a dus la scăderea statistic semnificativă a greutății corporale, a glucozei (femele) și a trigliceridelor și a crescut BUN (bărbați), ALP (bărbați), AST, CK, Alb, TP și phos. Cantitatea de pierdere în greutate corporală și valori scăzute ale glucozei au fost considerate a fi adverse la șoarecii care au postit peste noapte. Șoarecii tind să se deshidrateze rapid, iar postul peste noapte peste noapte este descurajat.
Efectele postului peste noapte, hrănirii sau suplimentării cu zaharoză înainte de necropsie au fost investigate la șobolani. Scăderea activității ALP serice a fost recunoscută la șobolani după restrângerea postului sau a restricției de hrănire și este cel mai probabil asociată cu o scădere a ALP de origine intestinală, care este forma principală de ALP în circulație la șobolani. ALP scade secundar consumului scăzut de alimente sunt ilustrate în Tabelul 29.5. Furnizarea unui carbohidrat simplu șobolanilor peste noapte a fost sugerată pentru a minimiza efectele reținerii alimentelor. Glucoza din sânge, BUN, ALP, ALT și greutățile hepatice și ficatul și histologia pancreatică au diferit la șobolanii suplimentați cu zaharoză în comparație cu șobolanii cu post sau cu hrănirea cu chow, iar aceste modificări au fost considerate potențial ca având impact asupra rezultatelor studiului; prin urmare, suplimentarea cu zaharoză nu a fost recomandată.
Rezultatele unui studiu de restricție alimentară de 2 săptămâni la șobolani au arătat scăderea numărului de globule leucocitare, limfocite și trombocite, scăderea trigliceridelor, colesterolului, TP, ALT și ALP, creșterea bilirubinei serice și a tulburărilor electrolitice. Un alt studiu de restricție a furajelor de 2 săptămâni la șobolanii Sprague-Dawley a remarcat hemoconcentrarea, scăderea glucozei, creșterea ALP, ALT și AST și hemoglobinurie în grupul sever restricționat. Efectele restricției furajului asupra AST, ALT și ALP serice la șobolani sunt variabile în funcție de diferite referințe publicate.
Înfometarea și postul: Aspecte biochimice
Post prelungit
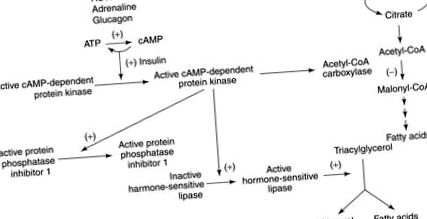
Figura 7. Lipoliza este stimulată de acțiunea glucagonului, ACTH și adrenalinei. Acest efect este mediat de proteina kinază dependentă de AMP ciclic.
Pe măsură ce oxidarea acizilor grași și formarea corpului cetonic cresc, există o reducere a producției și oxidării glucozei mediată de reglarea descendentă a activității complexului piruvat dehidrogenazei. După un post de 3 săptămâni, se observă o reducere marcată a metabolismului glucozei în tot creierul folosind tomografia cu emisie de pozitroni. Absorbția de glucoză din creier este mai mult decât înjumătățită după un post de 5 săptămâni.
După o perioadă de post mai mare de 3 săptămâni, procesul de adaptare metabolică la foamete este complet. Gluconeogeneza și glicoliza au fost minimizate în paralel cu o creștere a producției de cetonă hepatică. Rinichiul devine principalul organ gluconeogen și produce jumătate din necesarul de glucoză al organismului. Glutamina este substratul predominant pentru gluconeogeneza renală, iar produsul azotat al acestui proces asigură amoniacul necesar pentru tamponarea cetoacizilor din urină. Acest lucru economisește energie în comparație cu eliminarea intensivă a amoniacului în energie prin ciclul ureei hepatice. Ca rezultat, pierderile de azot urinar scad la 4-6 g ziua -1. Două treimi din consumul de combustibil al creierului constă din corpuri cetonice, reducând astfel semnificativ nevoia de proteoliză musculară pentru a oferi precursori gluconeogeni. Cu postul prelungit, mușchii se schimbă de la producerea corpului cetonic la oxidarea acizilor grași.
La finalizarea adaptării, există o epuizare lentă și continuă a compartimentului proteic și defalcarea țesutului adipos. Moartea va apărea atunci când nu se reumplu rezervele de combustibil prin realimentare și insuficiența energiei disponibile pentru a menține funcțiile esențiale ale corpului. Deoarece grăsimea este sursa predominantă de energie, timpul până la moarte în postul necomplicat va depinde de mărimea depozitelor de grăsimi prefabricate. La un adult normal, depozitele de grăsime vor fi suficiente pentru a susține viața aproximativ 60-70 de zile. Gradul pierderii de proteine este, de asemenea, legat de supraviețuire, iar pierderea a mai mult de jumătate din compartimentul de masă corporală slabă (aproximativ jumătate din proteina totală a corpului) este predictivă a morții.
Diabetul zaharat - o privire de ansamblu
Thundiparambil Azeez Sonia, Chandra P. Sharma, în Oral Delivery of Insulin, 2014
1.6 Diagnosticul diabetului zaharat
Nivelul mediu normal al glicemiei la om fluctuează pe parcursul zilei. Cu toate acestea, persoanelor cu vârsta peste 30 de ani li se recomandă să își verifice nivelul glucozei uneori pentru a diagnostica diabetul.
Următoarele teste sunt utilizate pentru diagnostic.
1.6.1 Test de glucoză plasmatică la jeun (FPG)
FPG măsoară nivelurile de glucoză ale unei persoane care nu a mâncat nimic timp de cel puțin 8 ore [63]. Acest test este utilizat pentru a detecta diabetul și prediabetul. Datorită comodității și costului redus, FPG este testul preferat pentru diagnosticarea diabetului.
1.6.2 Test de toleranță orală la glucoză (OGTT)
Măsurează glicemia unei persoane care a postit cel puțin 8 ore și 2 ore după ce a băut o băutură care conține glucoză [64]. Acest test poate fi utilizat pentru a diagnostica diabetul, prediabetul și diabetul gestațional.
1.6.3 Test aleatoriu al glucozei plasmatice sau zahăr aleatoriu
De asemenea, numit test ocazional al glucozei plasmatice, măsoară nivelurile de glucoză din sânge, fără a lua în considerare când persoana care a fost testată a mâncat ultima dată [65]. Împreună cu o evaluare a simptomelor, acest test poate fi utilizat pentru diagnosticarea diabetului, dar nu și pentru prediabet.
1.6.4 Testul hemoglobinei glicate sau testul A1c sau HbA1c
Testul A1c este utilizat pentru detectarea diabetului de tip 2 și a prediabetului, dar nu este sugerat pentru diagnosticul diabetului de tip 1 sau al diabetului gestațional [66]. Acest test măsoară media nivelurilor de glucoză din sânge ale unei persoane în ultimele trei luni și nu prezintă fluctuații zilnice [67]. Deoarece acest test poate fi efectuat în orice moment al zilei și nu necesită post, testul A1c este mai potrivit pentru pacienți decât testele tradiționale de glucoză [30]. Rezultatul testului A1c este de obicei raportat ca procent. Cu cât este mai mare procentul, cu atât sunt mai mari șansele de diabet [67].
Se recomandă ca rezultatele testelor pozitive pentru diabet să fie confirmate numai după un al doilea test efectuat într-o altă zi [30].
Zonele terapeutice I: sistemul nervos central, durere, sindrom metabolic, urologie, gastro-intestinal și cardiovascular
6.19.3.3.1 Anomalii ale homeostaziei glucozei
Hiperglicemia la jeun în T2DM se dezvoltă în principal ca urmare a producției crescute de glucoză endogenă datorită deficitului relativ de insulină și rezistenței hepatice la insulină. Concentrațiile crescute în circulație de glucagon, FFA și precursorii gluconeogenezei potențează o creștere a producției endogene de glucoză. În starea de repaus alimentar, absorbția periferică a glucozei și metabolismul sunt procese relativ independente de insulină. Postprandial, glucoza intră în circulația sistemică prin absorbție intestinală. În mod normal, concentrația de glucoză atinge vârful la 30-60 de minute după începerea mesei și revine la nivelurile bazale în decurs de 2-3 ore, în principal datorită suprimării producției hepatice de glucoză și stimulării absorbției periferice de glucoză. Nivelurile crescute de insulină suprimă glucagonul și FFA și reduc producția hepatică de glucoză. În T2DM, excursiile postprandiale la glucoză sunt exagerate și prelungite din cauza dublelor defecte: scăderea sensibilității la insulină și afectarea secreției de insulină. Rezultatul este suprimarea subnormală a producției endogene de glucoză și absorbția redusă a glucozei în țesutul muscular și adipos.
Manipularea tubulară proximală a fosfatului
POST/DIABET
Postul mărește excreția de fosfat urinar, care se datorează scăderii reabsorbției tubulare a Pi. Analiza Northern blot a indicat faptul că postul de 48 de ore nu a dus la scăderea expresiei renale a ARNm NaPi IIa sau NaPi III (13, 43).
Insulina stimulează cotransportul Na/Pi la marginea pensulei (52, 67). De acord, reabsorbția proximală a Pi a fost redusă în diabetul indus de streptotocină, deși fără modificări ale ARNm cotransportorilor de tip IIa sau III Na/Pi (43). Mai mult, nu a fost detectată nicio modificare a abundenței proteinei de tip IIa Na/Pi cotransportor în BBMV. La șobolanii tratați cu streptotocină, răspunsul adaptiv la o dietă cu conținut scăzut de Pi asupra cantității de cotransportatori de tip IIa Na/Pi a fost tocit indicând faptul că insulina poate avea un efect permisiv asupra răspunsului cotransportatorului de tip IIa Na/Pi la modificările dietei conținut (63).
Hipoglicemie la copil și copil
David R. Langdon MD,. Mark A. Sperling MD, în Endocrinologie pediatrică (ediția a patra), 2014
Rezistența la hormoni de creștere și deficit de IGF-1
Hipoglicemia recurentă la post este frecventă în cea mai extremă formă de rezistență la hormonii de creștere datorită absenței genetice a receptorului GH (nanism Laron). 300, 301 Hipoglicemia tinde să se amelioreze în adolescență, deși poate apărea în continuare cu postul prelungit. Frecvențe similare de hipoglicemie (45% sau mai mult) au fost raportate la cele mai mari două populații cu această afecțiune în Israel și Ecuador, sugerând că este posibil să nu fie întreaga explicație pentru nivelurile inferioare de inteligență descrise la pacienții israelieni. Vulnerabilitatea față de hipoglicemia în repaus se îmbunătățește cu tratamentul cu factor de creștere sintetic similar insulinei 1 (mecasermină), deși unul dintre efectele insulinice ale tratamentului poate fi hipoglicemia în decurs de o oră de la injectare, dacă copilul nu a mâncat.
- Despre ScienceDirect
- Acces de la distanță
- Cărucior de cumpărături
- Face publicitate
- Contact și asistență
- Termeni si conditii
- Politica de Confidențialitate
Folosim cookie-uri pentru a ne oferi și îmbunătăți serviciile și pentru a adapta conținutul și reclamele. Continuând sunteți de acord cu utilizarea cookie-urilor .
- Stabilitatea de bază - o prezentare generală Subiecte ScienceDirect
- Adulterarea alimentelor - o prezentare generală Subiecte ScienceDirect
- Dydrogesterone - o prezentare generală Subiecte ScienceDirect
- Densitate (gravitate specifică) - o prezentare generală a subiectelor ScienceDirect
- Galliformes - o prezentare generală Subiecte ScienceDirect