Proteinele corpului sunt descompuse și înlocuite continuu (cifră de afaceri; Schoenheimer, 1942), cu o rată aproximativă de 3-6 grame de proteine / kg greutate corporală/zi pentru omul adult.
Termeni asociați:
- Corpul bazal
- Glucoză
- Enzime
- Proteine dietetice
- Mutaţie
- Sinteza proteinei
- Proteine
- Aminoacizi
- Mușchi scheletic
Descărcați în format PDF
Despre această pagină
Proteine: digestie, absorbție și metabolizare
Abstract
Proteinele corpului și, prin urmare, proteinele dietetice au un rol central în plan metabolic. Proteinele dietetice sunt digerate în tractul gastro-intestinal prin acțiunea atât a enzimelor mamifere, cât și a celor bacteriene, iar peptidele mici și aminoacizii liberi sunt absorbiți în principal în intestinul subțire de un sistem integrat bine controlat. Aminoacizii absorbiți pot avea funcții fiziologice specifice, dar sunt utilizați în cantități mai mari pentru sinteza proteinelor corporale. Pe lângă aportul de aminoacizi în organism, se pot forma peptide și oligopeptide mici în timpul digestiei, care pot fi relativ rezistente la digestie și pot avea o gamă largă de bioactivități.
Compoziția corpului uman și masa musculară
Krzysztof Duda,. Jerzy A. Zoladz, în Fiziologia mușchilor și a exercițiului, 2019
1.3.2.3 Proteina corporală totală
Proteina corporală totală (TBPro) reprezintă aproximativ 14% -16% din BM, adică,
11 kg la bărbați și 9 kg la femei. TBPro este cuprins în BCM (
77%), dar și în solidele extracelulare și ECF (
După cum sa menționat mai sus, TBPro poate fi calculat pe baza TBN (determinat de NAA), pe ipoteza că fiecare 6,25 g de proteine conține 1 g de azot (adică, raportul azot-proteină se ridică la 0,16).
TBPro poate fi, de asemenea, estimat pe baza valorii TBK, măsurată prin metoda numărării întregului corp (40 K) și a conținutului de minerale osoase evaluate folosind metoda DEXA a întregului corp (ecuația (1.40), Wang și colab., 2003):
Glanda tiroida
Metabolismul azotului
Proteinele corpului sunt în mod constant degradate și resintetizate. Atât sinteza, cât și degradarea proteinelor sunt încetinite în absența hormonilor tiroidieni și, dimpotrivă, ambii sunt accelerați de hormoni tiroidieni. În prezența excesului de T4 sau T3, predomină efectele degradării și adesea există un catabolism sever al mușchilor. La subiecții hipertiroidieni, masa proteinelor corporale scade, în ciuda apetitului crescut și a ingestiei de proteine dietetice. În cazul deficitului de tiroidă, există o acumulare caracteristică a unui material de tip mucus, format din proteine complexate cu acid hialuronic și sulfat de condroitină în spații extracelulare, în special în piele. Datorită efectului său osmotic, acest material face ca apa să se acumuleze în aceste spații, dând naștere la edemul observat în mod obișnuit la indivizii hipotiroidieni și la numele de mixedem pentru hipotiroidism.
Metabolismul proteinelor
20.3.1 Sinteza și degradarea întregului corp
În cazul în care pierderile de proteine ale întregului corp se includ în proteinele din ouă sau din penele năpădite.
Dacă este negativă, sinteza netă a proteinelor din întregul corp (acumulare) este degradarea netă a proteinelor din întregul corp.
Sinteza proteinelor nete din întregul corp poate fi estimată prin echilibrul azotului. F nce, Kino și Okumura (1987) au estimat echilibrul de azot la puii cu vârsta cuprinsă între 14 și 21 de zile ca 0,29 g/zi. De asemenea, este posibilă determinarea experimentală a sintezei (acumulării) sau degradării nete a proteinelor din întregul corp, și a sintezei proteinelor din întregul corp, utilizând perfuzia unei forme radioactive a unui aminoacid nemetabolizat, cum ar fi fenil alanina sau tirozina (vezi Tabelul 20.4). Așa cum era de așteptat, sinteza sau acumularea netă de proteine este negativă la puii înfometați sau la puii cu o dietă deficitară în aminoacizi specifici (Tabelul 20.5). Sinteza proteinelor din corpul întreg este redusă în mod semnificativ de foame și este deprimată la păsări pe o dietă cu deficit de aminoacizi (Kino și Okumura, 1987; Muramatsu și colab., 1987b) (vezi Tabelul 20.5). Există o creștere concomitentă a degradării proteinelor la păsările înfometate, dar nu și la cele pe diete cu deficit de aminoacizi (Kino și Okumura, 1987; Muramatsu și colab., 1987b).
TABELUL 20.4. Efectele vârstei și ale proteinelor dietetice asupra sintezei și degradării proteinelor musculare la puii tineri
| 1 săptămână | 38 | 26 | 25 | 18 |
| 4 săptămâni | 24 | 18 | - | - |
| 6 săptămâni | 17 | 14 | - | - |
| Control | 26 | 10 | 22 | 9 |
| Dieta cu deficit de lizină | 24 | 22 | 20 | 19 |
| Control | 24 | 18 | - | - |
| Dieta completată cu proteine timp de 2 zile | 41 | 24 | - | - |
| Control | 19 | 10 | - | - |
| Dieta cu deficit de proteine | 13 | 5 | - | - |
Sursa: Bazat pe Maruyama și colab. (1978), MacDonald și Swick (1981), Urdaneta-Rincon și Leeson (2004) .
TABELUL 20.5. Efectul stării nutriționale asupra acumulării de proteine din întregul corp (sinteza netă), sinteza și degradarea la puii broiler tineri
| Studiul 1 (Muramatsu și colab., 1987b) | Sinteza proteinelor din întregul corp 1 (g/zi/kg corp greutate) | Degradarea proteinelor din întregul corp (g/zi/kg greutate corporală) | Sinteza rețelei proteice din întregul corp sau Delta (Δ) (acumulare) sau, dacă este negativă, degradarea (g/zi/kg corp greutate) |
| hrănit | 21.3 | 11.2 | 10.1 |
| Înfometat | 14.7 | 19.5 | −4,8 |
| Studiul 2 (Kino și Okumura, 1987) | Rata fracționată a sintezei proteinelor 1 (% pe zi) | Rata fracționată a degradării proteinelor (% pe zi) | Rata întregului corp de sinteză netă a proteinei sau a deltei (Δ) (acumulare) sau, dacă este negativă, degradare (g/zi) |
| Control | 23 | 18 | +5 |
| Dieta fără histidină | 17 | 18 | −1 |
| Dieta fără S-aminoacizi | 15 | 18 | −3 |
PROTEINĂ Cerințe și rol în dietă
Interacțiuni energie - proteine
Echilibrul proteinelor corporale poate fi influențat de aporturile de energie și asigurarea faptului că aporturile de energie sunt suficiente este dificilă. Aportul excesiv de energie duce la greutate și la o creștere a țesutului slab, în timp ce cu un aport prea mic, proteinele dietetice și/sau corporale sunt oxidate ca sursă de energie. Aceasta înseamnă că necesarul de proteine este o funcție a stării de echilibru energetic și influența reală este destul de marcată. Conform unei analize a bilanțului de azot (NB) asupra aporturilor de energie (EI; kcal/kg) și N (NI; mg N/kg), NB = 0,171NI + 1,006EI - 69,13. Aceasta înseamnă că aportul pentru N echilibru (cerința) va varia de la 1,4 la 0,32 g/kg/zi în funcție de dacă aporturile de energie sunt egale cu rata metabolică de repaus (RMR) sau egală cu dublul RMR. De fapt, două treimi din variabilitatea generală raportată în metaanaliza prezentată în Figura 2 (SD = 31,9 mg N/kg) ar putea fi explicată de o eroare de doar aproximativ 0,2 din rata metabolică bazală (BMR) în estimarea necesităților reale de energie ale unui subiect.
Deoarece echilibrul azotului variază în funcție de aportul de energie, se poate argumenta că necesarul de proteine poate fi definit doar în funcție de un nivel specific de aport de energie, dar care este aportul de energie adecvat? Ar trebui ca populațiile cu capse cu conținut scăzut de proteine să consume mai multă energie pentru a atinge echilibrul proteinelor corporale? Va predispune acest lucru obezității? În ce măsură variația consumului de energie la echilibrul energetic (adică cu niveluri crescute de activitate fizică) influențează echilibrul azotului? Acestea sunt întrebări dificile și în prezent fără răspuns.
Proteine: Cerințe
Balanța energetică și balanța N.
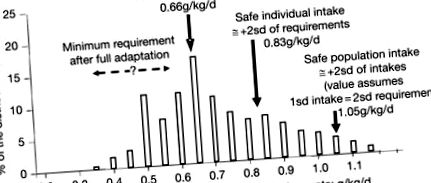
Figura 5. Distribuția valorilor raportate pentru necesitățile de proteine, care arată valorile pentru aporturile individuale și populaționale sigure. Barele reprezintă distribuția valorilor individuale ale aporturilor pentru N echilibru exprimate ca echivalente de proteine (n = 224 subiecți individuali din n = 32 studii, după o reducere de 5% a valorilor aberante), dintr-o meta-analiză a N date de bilanț. Cerința minimă după adaptarea completă nu este cunoscută, dar probabil să fie mai mică decât valoarea mediană în intervalul indicat.
PROTEINĂ Sinteza și cifra de afaceri
Ratele de sinteză a proteinelor
Rotația proteinelor din întregul corp a fost măsurată la mai multe specii. Valorile (per kg de greutate corporală pe zi) raportate la animalele mature variază de la 40 g la șoarece la 3 g la vacă și 4-5 g la om (Tabelul 1). Atât sinteza, cât și degradarea sunt semnificativ crescute la animalele tinere în creștere, cu valori de 12 g kg -1 zi -1 raportate la sugarii prematuri, scăzând la 7 g kg -1 zi -1 la copiii de 1 an.
Tabelul 1. Valori reprezentative pentru ratele de rotire a proteinelor din întregul corp (adică sinteză sau degradare) la animalele adulte
| Șoarece | 40 |
| Război | 20 |
| Iepure | 10 |
| Oaie | 6 |
| Uman | 4–5 |
| Vacă | 3 |
Rotația proteinelor din întregul corp reprezintă suma contribuțiilor din multe țesuturi diferite. Contribuția fiecărui țesut depinde de rata fracționată a sintezei proteinelor în țesut și de proporția masei proteice a corpului prezente în țesutul respectiv. Tabelul 2 prezintă date reprezentative pentru un număr de țesuturi la șobolan; valori izolate sunt disponibile pentru alte câteva specii, inclusiv pentru oameni, dar acestea nu formează încă o imagine cuprinzătoare.
Masa 2. Contribuția țesuturilor la sinteza proteinelor din întregul corp (valori medii pentru 100 g șobolani)
| Tot corpul | 100 | 34 | 100 |
| Muşchi | 45 | 17 | 23 |
| Piele | 10 | 64 | 19 |
| Ficat | 4 | 90 | 12 |
| Bun | 4 | 100 | 11 |
| Os | 3 | 90 | 8 |
| Rest | 34 | 26 | 27 |
Trebuie remarcat faptul că rotația proteinelor în diferite țesuturi este controlată independent. Astfel, o măsurare simplă a transformării proteinelor din întregul corp poate eșua în detectarea modificărilor în direcții opuse în două țesuturi diferite, cum ar fi mușchiul și ficatul.
Enzimologia la interfața membrană: enzimologia interfațială și legarea de proteină-membrană
F. Ghomashchi,. G. Lambeau, în Methods in Enzymology, 2017
6 Pregătirea hGIB
Proteina corpului de incluziune a fost preparată și sulfonată așa cum s-a descris mai devreme dintr-un vector hGIB/pAB3. Proteina sulfonată (80-100 mg) a fost dizolvată în 200-250 ml de guanidină-HCI 6 M, Tris-HCI 50 mM, pH 8,0 la temperatura camerei prin agitare. Orice proteină insolubilă rămasă a fost îndepărtată prin centrifugare la 14.000 × g timp de 15 minute la 4 ° C și supernatantul a fost utilizat pentru reîncărcare. Tubul de dializă (6-8 kDa MW cutoff, SpectraPor) a fost umplut cu soluția de proteină și dializat împotriva a 7 L de guanidină-HCI 0,9 M preîncălzită, 50 mM Tris - HCI, pH 8,0, 5 mM l-cisteină proaspăt adăugată, 5 mM EDTA, 5 mM l-metionină (pentru a evita oxidarea metioninelor sPLA2) și 5 mM detergent SB12 (N-dodecil-N, N-dimetil-3-amoni-1-propanesulfonat, Sigma 40232) la 4 ° C cu magnet agitând. A doua zi, activitatea enzimatică a unei mici alicote a fost verificată cu testul piren-PG și a fost verificată din nou după-amiaza. Dacă activitatea a crescut, dializa a fost continuată până când activitatea piren-PG a încetat să crească (
1-2 zile). Punga de dializă a fost transferată în 6,5 L de tampon de tripsină (50 mM Tris - HCI, pH 8,0, 100 mM NaCI, 1 mM CaCl2 cu 5 mM detergent SB12) și dializa a fost continuată la 4 ° C peste noapte. Conținutul pungii a fost transferat într-o sticlă de centrifugă, care a fost rotită la 15.000 × g timp de 20 de minute la 4 ° C pentru a peleta orice material insolubil.
1 coloană volum de solvent A înainte de a începe un gradient liniar de la 0% la 25% solvent B (acetonitril, 0,08% acid trifluoroacetic) timp de 40 de minute și de la 25% B la 60% B în următorii 110 minute la un debit de 1,5 ml/min. SPLA2 eluează ca un vârf ascuțit la aproximativ 49 min. Fracțiile HPLC combinate au fost diluate cu apă pentru a reduce acetonitrilul la 15-20%, iar proteina a fost liofilizată pentru a da o pulbere albă. În teste de reîncărcare mai recente, hGIB a fost produs și din vectorul pET21a cu randament similar și fără necesitatea tratamentului cu tripsină.
Proteine: sinteză și cifră de afaceri
Homeostazia proteinei din întregul corp este reglată acut la nivelul sintezei proteinelor tisulare și proteolizei în raport cu hrănirea și postul și cronic prin legătura dintre creșterea osoasă lungă și creșterea musculară, ambele supuse unor aporturi adecvate de proteine. Rotația proteinelor, mediată de mai multe sisteme proteolitice, a fost studiată cu diferite modele de identificare a izotopilor care au dezvăluit multe despre întinderea sa și implicațiile sale fiziologice. Reglarea cifrei de afaceri a proteinelor funcționează la nivelurile de expresie genică, concentrații și activitate ribozomală, în special inițierea traducerii și proteolizei și este mediată în principal de aminoacizi și insulină care împreună asigură utilizarea eficientă a proteinelor postprandiale.
- Despre ScienceDirect
- Acces de la distanță
- Cărucior de cumpărături
- Face publicitate
- Contact și asistență
- Termeni si conditii
- Politica de Confidențialitate
Folosim cookie-uri pentru a ne oferi și îmbunătăți serviciile și pentru a adapta conținutul și reclamele. Continuând sunteți de acord cu utilizarea cookie-urilor .
- Acid benzoic - o prezentare generală Subiecte ScienceDirect
- Bream - o prezentare generală a subiectelor ScienceDirect
- Cărbunele activat - o prezentare generală a subiectelor ScienceDirect
- Budgerigar - o prezentare generală Subiecte ScienceDirect
- Tratamentul alcalin - o prezentare generală Subiecte ScienceDirect