Holger Doege
‡ Institutul de Cercetare al Fundației Medicale Palo Alto, Palo Alto, California 94301, Școala de Medicină, § Departamentul GI/Hepatologie și ¶ Departamentele de Pediatrie și Genetică, Universitatea Stanford, Stanford, California 94305 și Departamentul Sciences Științe Nutritive și Toxicologie, Universitatea din California Berkeley, Berkeley, California 94720
Dirk Grimm
‡ Institutul de Cercetare al Fundației Medicale Palo Alto, Palo Alto, California 94301, Școala de Medicină, § Departamentul GI/Hepatologie și ¶ Departamentele de Pediatrie și Genetică, Universitatea Stanford, Stanford, California 94305 și Departamentul Sciences Științe Nutritive și Toxicologie, Universitatea din California Berkeley, Berkeley, California 94720
Șoimul Alaric
‡ Institutul de Cercetare al Fundației Medicale Palo Alto, Palo Alto, California 94301, Școala de Medicină, § Departamentul GI/Hepatologie și ¶ Departamentele de Pediatrie și Genetică, Universitatea Stanford, Stanford, California 94305 și Departamentul Sciences Științe Nutritive și Toxicologie, Universitatea din California Berkeley, Berkeley, California 94720
Bernice Tsang
‡ Institutul de Cercetare al Fundației Medicale Palo Alto, Palo Alto, California 94301, Școala de Medicină, § Departamentul GI/Hepatologie și ¶ Departamentele de Pediatrie și Genetică, Universitatea Stanford, Stanford, California 94305 și Departamentul Sciences Științe nutriționale și toxicologie, Universitatea din California Berkeley, Berkeley, California 94720
Theresa A. Storm
‡ Institutul de Cercetare al Fundației Medicale Palo Alto, Palo Alto, California 94301, Școala de Medicină, § Departamentul GI/Hepatologie și ¶ Departamentele de Pediatrie și Genetică, Universitatea Stanford, Stanford, California 94305 și Departamentul Sciences Științe Nutritive și Toxicologie, Universitatea din California Berkeley, Berkeley, California 94720
Hui Xu
‡ Institutul de Cercetare al Fundației Medicale Palo Alto, Palo Alto, California 94301, Școala de Medicină, § Departamentul GI/Hepatologie și ¶ Departamentele de Pediatrie și Genetică, Universitatea Stanford, Stanford, California 94305 și Departamentul Sciences Științe Nutritive și Toxicologie, Universitatea din California Berkeley, Berkeley, California 94720
Angelica M. Ortegon
‡ Institutul de Cercetare al Fundației Medicale Palo Alto, Palo Alto, California 94301, Școala de Medicină, § Departamentul GI/Hepatologie și ¶ Departamentele de Pediatrie și Genetică, Universitatea Stanford, Stanford, California 94305 și Departamentul Sciences Științe Nutritive și Toxicologie, Universitatea din California Berkeley, Berkeley, California 94720
Melissa Kazantzis
‡ Institutul de Cercetare al Fundației Medicale Palo Alto, Palo Alto, California 94301, Școala de Medicină, § Departamentul GI/Hepatologie și ¶ Departamentele de Pediatrie și Genetică, Universitatea Stanford, Stanford, California 94305 și Departamentul Sciences Științe Nutritive și Toxicologie, Universitatea din California Berkeley, Berkeley, California 94720
Mark A. Kay
‡ Institutul de Cercetare al Fundației Medicale Palo Alto, Palo Alto, California 94301, Școala de Medicină, § Departamentul GI/Hepatologie și ¶ Departamentele de Pediatrie și Genetică, Universitatea Stanford, Stanford, California 94305 și Departamentul Sciences Științe Nutritive și Toxicologie, Universitatea din California Berkeley, Berkeley, California 94720
Andreas Stahl
‡ Institutul de Cercetare al Fundației Medicale Palo Alto, Palo Alto, California 94301, Școala de Medicină, § Departamentul GI/Hepatologie și ¶ Departamentele de Pediatrie și Genetică, Universitatea Stanford, Stanford, California 94305 și Departamentul Sciences Științe Nutritive și Toxicologie, Universitatea din California Berkeley, Berkeley, California 94720
Date asociate
Abstract
Boala ficatului gras nealcoolic este o problemă gravă de sănătate legată de obezitate și de diabetul de tip 2. Pentru a investiga rezultatul biologic și potențialul terapeutic al inhibării absorbției hepatice a acizilor grași, am utilizat o tehnică de interferență ARN mediată de virus adeno-asociată pentru a elimina expresia proteinei de transport a acidului gras hepatic 5 in vivo înainte sau după stabilirea grăsimilor nealcoolice boală hepatică la șoareci. Folosind această abordare, demonstrăm aici capacitatea de a realiza o eliminare specifică, netoxică și persistentă a proteinei 5 de transport de acizi grași în ficatul șoarecilor dintr-o singură injecție de virus adeno-asociat, rezultând o reducere marcată a absorbției hepatice a acizilor grași, absorbția calorică redusă și protecția concomitentă împotriva bolilor hepatice grase nealcoolice induse de dietă. Foarte important, eliminarea proteinei de transport a acizilor grași 5 a fost, de asemenea, capabilă să inverseze boala hepatică grasă nealcoolică deja stabilită, rezultând o homeostazie globală a glucozei îmbunătățită semnificativ. Astfel, este necesară continuarea activității proteinei 5 de transport al acidului gras hepatic pentru a susține absorbția calorică și fluxul de acizi grași în ficat în timpul hrănirii cu conținut ridicat de grăsimi și poate prezenta o cale nouă pentru tratamentul bolilor hepatice grase nealcoolice.
Prevalența mondială a bolii hepatice grase nealcoolice (NAFLD) 2 este estimată în prezent la 30% din populația generală și afectează majoritatea pacienților cu obezitate și diabet de tip 2 (1, 2). La persoanele obeze, acizii grași fără ser crescut (FFA) și nivelurile ridicate de insulină duc atât la creșterea absorbției FFA de către ficat, cât și la sinteza crescută a lipidelor, rezultând acumularea de trigliceride hepatice (TG), însoțită de obicei de desensibilizarea insulinei hepatice (1, 3) implicând protein kinaza C ε (3). Strategiile actuale de tratament farmacologic pentru NAFLD se concentrează în principal pe creșterea oxidării hepatice a acizilor grași (4) și îmbunătățirea sensibilității la insulină extrahepatică (5). Cu toate acestea, niciuna dintre aceste metode de tratament nu reduce absorbția hepatică a grăsimilor dietetice și ar fi extrem de dorită o terapie nouă care vizează în mod specific inversarea NAFLD în contextul obezității.
Pe baza premiselor că NAFLD asociat cu obezitatea este determinat în principal de absorbția continuă de acizi grași mediată de proteine de către ficat și că NAFLD este un factor care contribuie la desensibilizarea insulinei din întregul corp, am susținut că blocarea proteinelor responsabile de absorbția hepatică a acidului gras ar trebui să prevină sau să inverseze steatoza hepatică, îmbunătățind astfel sensibilitatea la insulină și homeostazia glucozei. Doi membri ai familiei de proteine pentru transportul acizilor grași (FATP), FATP2 și FATP5, sunt puternic exprimate în ficat (6) și se crede că sunt implicați în primii pași de captare/activare a acizilor grași cu lanț lung (7, 8). Recent am demonstrat importanța FATP5 în metabolismul lipidelor hepatice arătând că ștergerea șoarecilor FATP5 a protejat parțial șoarecii de a dezvolta obezitate indusă de dietă bogată în grăsimi și a îmbunătăți sensibilitatea la insulină (9, 10).
Pentru a explora consecințele ablației hepatice FATP5 în contextul NAFLD pentru absorbția hepatică a acidului gras și a fluxurilor de lipide ale întregului corp, am profitat de o livrare mediată de 8 virusuri adeno-asociate (SDS) stabilizate recent (SDS) metodă pentru exprimarea ARN-ului cu ac de păr mic (sh) îndreptat către ficat (11). Folosind această abordare, am putea realiza o reducere a tăcerii specifice a FATP5 endogen la șoareci după o singură livrare de sdsAAV-shRNA constructe de expresie, având ca rezultat protecția/inversarea NAFLD și hiperglicemia la șoarecii obezi induși în dietă.
MATERIALE ȘI METODE
Anticorpi și reactivi - Acidul gras BODIPY (C1-BODIPY-C12) a fost obținut de la sondele moleculare (Eugene, OR). [14 C] Acid oleic a fost achiziționat de la ARC, Inc. (St. Louis, MO). Antiserurile policlonale împotriva termenilor C ai FATP2, -4 și -5 au fost ridicate așa cum s-a descris anterior (9, 12). Anticorpii anti-β-tubulină și enzima anti-insulină care degradează au fost achiziționați de la BD Biosciences și, respectiv, BD Transduction Laboratories. Analiza imunoblot a fost efectuată după cum sa raportat anterior (13). Toate celelalte substanțe chimice au fost obținute de la Sigma.
Construcții AAV-shRNA - Oligonucleotidele împotriva FATP5 au fost concepute așa cum s-a sugerat (14) și nu au împărtășit nicio omologie semnificativă cu alte gene din genomul șoarecelui. Toate shRNA-urile utilizate in vitro au fost exprimate de la promotorul H1 uman (construct de expresie bazat pe pSUPERIOR; OligoEngine, Seattle, WA). Secvența buclei a fost 5'-TTCAAGAGA-3 '. Vectorii AAV stabilizați dublu catenari (sds) pentru exprimarea persistentă și eficientă a shARN-urilor în ficat au fost derivați din elemente din serotipurile AAV 2, 4 și 8 (11). Particulele virale au fost generate, purificate și titrate așa cum a fost descris de Grimm și colab. (15).
Testul de absorbție a acidului gras în celulele HEK293 - Testele de absorbție a acidului gras au fost efectuate așa cum s-a descris anterior (12).
Proceduri generale pentru animale - Șoarecii C57BL/6 sau Swiss Webster au fost cumpărați de la Laboratorul Jackson (Bar Harbor, ME) și au fost climatizați timp de 1 săptămână după sosire înainte de a fi utilizați pentru experimente. Animalele au fost menținute pe un chow de laborator obișnuit (5P75, LabDiet, Richmond, IN) sau pe o dietă specială (vezi mai jos), primind hrană și apă ad libitum și ținute la 22 ° C pe o lumină de 12 h/12 h ciclu întunecat. Șoarecii knock-out FATP5 au fost generați și menținuți așa cum s-a descris anterior (9). Toate grupurile de studiu au avut vârste și greutăți inițiale comparabile. Livrările intravenoase de sdsAAV8 (5 × 10 10 sau 3 × 10 11 particule virale (v.p.), volum total 250 μl în PBS) au fost efectuate prin injecții de venă coadă folosind metodele stabilite (16). Pentru studii dietetice, șoarecii masculi de 8 săptămâni adăpostiți separat au fost hrăniți ad libitum cu o dietă bogată în grăsimi conținând 60% grăsimi (D12492, Research Diets, NJ) sau o dietă săracă în grăsimi (> D12450) conținând 10% grăsimi. Greutatea a fost măsurată săptămânal, iar consumul de alimente a fost măsurat de două ori pe săptămână. Testele standard de toleranță la glucoză și testele de toleranță la insulină, precum și gavajele lipidice au fost efectuate așa cum s-a descris anterior (17). Toate procedurile au fost aprobate de Comitetul de îngrijire a animalelor de la Institutul de Cercetare al Fundației Medicale Palo Alto și de Comitetul instituțional de îngrijire și utilizare a animalelor de la Universitatea din California Berkeley.
Pregătirea hepatocitelor - Ficateii șoarecilor au fost canulați prin vena portă și s-a făcut o incizie în vena cavă inferioară. Perfuzia hepatică cu digestie și medii de perfuzie și izolarea hepatocitelor a fost efectuată conform instrucțiunilor producătorului (Invitrogen) urmată de analize de captare a acidului gras cu lanț lung așa cum este descris (9).
Analiza lipidelor tisulare - Probele din diferite țesuturi au fost pudrate în azot lichid, iar lipidele totale au fost extrase prin metoda lui Folch și colab. (18). Trigliceridele totale au fost testate folosind un kit colorimetric (Sigma Diagnostics).
Morfologie hepatică - Criosecțiile obținute din ficatul animalelor de eliminare sau eliminare a FATP și controalele respective au fost colorate fie cu reactiv tricrom Masson, fie cu hematoxilină și eozină. Picăturile lipidice neutre au fost colorate cu BODIPY 493/503 (Molecular Probes).
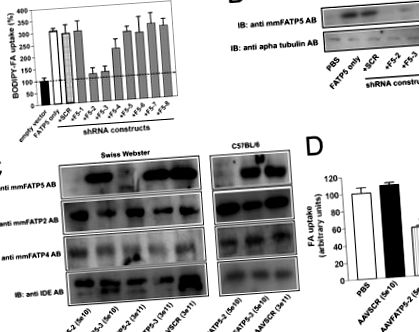
Analiză statistică - Analiza statistică a fenotipurilor knock-out FATP5 sau FATP5 knock-out versus control amestecat (SCR) sau controalelor de tip sălbatic a fost făcută prin testul t Student sau analiza testului de varianță, după caz. S.E. sunt afișate valorile. p FIG. 1A) și imunobloti (Fig. 1B), respectiv. Ambele teste au identificat două construcții (FATP5-2, FATP5-3) capabile să declanșeze un efect robust de interferență ARN. Nu am observat niciun efect pentru celelalte constructe shRNA sau controlul SCR în comparație cu celulele transfectate numai cu vectorii de expresie FATP respectivi.
Knockdown in vitro și in vivo al FATP2 și FATP5. Celulele A, HEK293 au fost co-transfectate cu vector de expresie gol (bară neagră) sau plasmide de expresie FATP5 singure (bară albă) sau în combinație cu constructele shRNA indicate. Captarea acidului gras fluorescent (FA) (C1-BODIPY-C12) a fost determinată la 2 zile după transfecție prin citometrie în flux. Fluorescența medie normalizată la vector gol. Barele de eroare indică abaterea standard. B, analiza Western blot a lizatelor celulare din co-transfecții. α-Tubulin a servit drept control al încărcării. IB, imunoblot. C, Western blot analysis of sdsAAV-shRNA-mediaed knockdown of FATP5 protein in vivo. Proteinele au fost extrase din omogenate de țesut hepatic din diferite tulpini de șoarece (C57BL/6 și Swiss Webster) la 4 săptămâni după injectare cu constructele indicate și titrurile virale și s-au testat cu antiseruri specifice pentru FATP5, FATP2, FATP4 și enzimă care degradează insulina. AB, anticorp. D, captare de acizi grași de către hepatocite izolată la 4 săptămâni după injectarea virusului. Absorbția FFA a fost determinată ex vivo folosind o analiză de absorbție a acidului gras fluorescent.
Pierderea FATP-urilor hepatice redirecționează fluxurile de lipide din dietă - Pentru a caracteriza modificările clearance-ului postprandial al lipidelor la șoarecii AAVSCR și AAVFATP5, am efectuat gavaje cu ulei care conțin [14 C] oleat trasor după un post peste noapte folosind șoareci C57BL/6 hrăniți cu un chow normal 4 săptămâni ai Aspectul inițial de 14 C în ser a fost comparabil între toate grupurile (Fig. 2A), indicativ al absorbției normale la toate animalele. Cu toate acestea, numărul 14C (Fig. 2A), precum și TG și FFA serice (datele neprezentate) au fost crescute pentru perioade prelungite în grupul de eliminare FATP5, sugerând reducerea clearance-ului lipidelor din circulație, probabil din cauza pierderii funcției hepatice FATP. La patru ore după gavaj, am constatat o scădere a absorbției de către ficatul animalelor care au fost afectate de FATP5, cu depunere crescută de lipide în inimă, mușchi scheletic și grăsime (Fig. 2B). Aceste date sunt în concordanță cu modificările observate ale conținutului total de TG hepatic după hrănirea cronică cu conținut ridicat de grăsimi (vezi Fig. 4B) și sugerează că pierderea FATP hepatice determină o redirecționare a lipidelor departe de ficat către țesuturile care se bazează pe alte paraloguri FATP, FATP6, -1 și -4. Luate împreună, aceste constatări susțin cu tărie noțiunea că FATP5 joacă un rol critic în absorbția hepatică a acidului gras și în compartimentarea lipidelor postprandiale.
Efectele eliminării FATP asupra fluxurilor de lipide postprandiale. La patru săptămâni după transducția virală, șoarecii au fost gavați cu 250 μl de ulei de măsline cu vârfuri cu 3,5 μCi de acid oleic [14 C]. Numărul de A, 14 C a fost determinat în probele de ser extrase la 0, 30, 60, 120 și 240 de minute după gavaj. B, 240 de minute după gavaj, șoarecii au fost eutanasiați, iar numărul de 14 C normalizat până la conținutul de proteine a fost determinat pentru ficat, inimă, mușchi scheletic (Sk.M.), țesut adipos alb (WAT) și lizate renale. Barele de eroare indică abaterea standard, iar asteriscurile indică p Fig. 3, A și B). Deși ficatul șoarecilor martor injectați cu PBS și AAVSCR au prezentat caracteristici tipice ale steatozei macrovasculare, atât șoarecii injectați AAVFATP5, cât și șoarecii FATP5KO (9, 10) au prezentat o protecție semnificativă cu o scădere marcată a infiltrării lipidelor (Fig. 3C) și o reducere semnificativă în conținutul total de TG hepatic (AAVSCR, 35,4 ± 1,1 μmol/g; FATP5KO, 21,9 ± 4,2 μmol/g). Pe scurt, aceste rezultate demonstrează că o singură livrare mediată de sdsAAV a expresiei shRNA produce rezultate în fenotipuri care sunt foarte comparabile cu cele ale animalelor knock-out modificate genetic și că pierderea mediată de AAV a FATP5 protejează animalele de dezvoltarea induse de dietă steatoza hepatică.
Luate împreună, am făcut trei observații importante. În primul rând, demonstrăm că expresia shRNA mediată de AAV este un instrument eficient pentru suprimarea genelor hepatice la ficatul normal și steatotic. Aceasta este o constatare importantă, deoarece acesta este primul raport despre transducția specifică ficatului și inducerea interferenței ARN netoxice, utilizând particule de serotip 8 AAA dublu catenare stabilizate și ar trebui să permită experimentelor viitoare disecarea componentelor moleculare care stau la baza fluxurilor de lipide hepatice sub fiziologie și condiții fiziopatologice. În al doilea rând, arătăm că eliminarea FATP5 mediată de AAV protejează de steatoza hepatică indusă de dieta bogată în grăsimi și redirecționează fluxurile de lipide postprandiale departe de ficat. În cele din urmă, suprimarea FATP5 este suficientă pentru a inversa NAFLD stabilit în modelul nostru de obezitate indusă de dietă și pentru a îmbunătăți homeostazia glucozei din întregul corp. Astfel, reducerea FATP-urilor hepatice fie prin terapie genetică, fie prin inhibitori moleculari mici este un instrument nou pentru redirecționarea dinamică a fluxurilor lipidice și poate oferi abordări noi pentru tratamentul NAFLD și a rezistenței la insulină.
Material suplimentar
Mulțumiri
Mulțumim lui Jon Mulholland, Kitty Lee, Corrine Davis și Reese Zasio de la Universitatea Stanford. Recunoaștem ajutorul primit de la personalul instituției de cercetare a Fundației Medicale Palo Alto.
- Deficiența de acid gras N-3 indusă de o metodă de creștere artificială modificată duce la slăbire
- Pectina ameliorează boala hepatică grasă nealcoolică indusă de dietă cu un conținut ridicat de grăsimi (untură) la șoareci
- Obezitatea este singurul factor independent asociat cu grăsime nealcoolică diagnosticată cu ultrasunete
- Compoziție proximă, profiluri de aminoacizi și acizi grași din carnea de melc marin Rapana venosa,
- Proteina din soia ameliorează simptomele bolii hepatice grase, sugerează studiul - ScienceDaily