Danica Chen
1 Departamentul de Biologie, Institutul de Tehnologie din Massachusetts, Cambridge, Massachusetts 02139, SUA;
Joanne Bruno
1 Departamentul de Biologie, Institutul de Tehnologie din Massachusetts, Cambridge, Massachusetts 02139, SUA;
Erin Easlon
2 Secția de microbiologie, Universitatea din California la Davis, Davis, California 95616, SUA;
Su-Yu Lin
2 Secția de microbiologie, Universitatea din California la Davis, Davis, California 95616, SUA;
Hwei-Ling Cheng
3 Institutul medical Howard Hughes, Spitalul pentru copii, Institutul pentru boli imune și Departamentul de genetică, Harvard Medical School, Boston, Massachusetts 02115, SUA
Frederick W. Alt
3 Howard Hughes Medical Institute, The Children's’s Hospital, Immune Disease Institute și Departamentul de Genetică, Harvard Medical School, Boston, Massachusetts 02115, SUA
Leonard Guarente
1 Departamentul de Biologie, Institutul de Tehnologie din Massachusetts, Cambridge, Massachusetts 02139, SUA;
Abstract
S-a raportat că restricția calorică (CR) crește nivelul proteinelor SIRT1 la șoareci, șobolani și oameni, iar activitatea crescută a ortologilor SIRT1 extinde durata de viață a drojdiei, viermilor și muștelor. În acest studiu, contestăm paradigma conform căreia CR induce activitatea SIRT1 în toate țesuturile, arătând că activitatea acestei sirtuine în ficat este, de fapt, redusă de CR și activată de o dietă bogată în calorii. Demonstrăm această schimbare atât prin testarea nivelurilor de SIRT1 și a regulatorilor săi de molecule mici, NAD și NADH, cât și prin evaluarea fenotipurilor unui șoarece knockout SIRT1 specific ficatului pe diferite diete. Descoperirile noastre sugerează că proiectarea mimeticilor CR care vizează SIRT1 pentru a oferi beneficii sistemice uniforme poate fi mai complexă decât imaginați în prezent.
Aportul caloric influențează durata de viață și incidența bolilor la animale (Koubova și Guarente 2003). Excesul de alimente reprezintă creșterea istorică recentă a tulburărilor metabolice la om. Dimpotrivă, restricția de calorii (CR) promovează condiția metabolică, viața lungă și protecția bolilor la modelele de rozătoare (Weindruch 1988). Au fost identificate mai multe căi genetice care guvernează dieta, metabolismul și durata de viață (Van Remmen și colab. 2001; Koubova și Guarente 2003; Kenyon 2005; Sinclair 2005).
Genele legate de drojdia SIR2, numite sirtuine, codifică deacetilaze dependente de NAD și promovează longevitatea la drojdie, viermi și muște (Chen și Guarente 2007). În sistemele model care variază de la drojdie la șoareci, sirtuinele au fost, de asemenea, asociate cu efectele salutare ale CR. Orthologul Sir2 de mamifer SIRT1 vizează numeroși factori de reglementare care afectează gestionarea stresului și metabolismul (Sinclair 2005; Chen și Guarente 2007). S-a raportat că nivelurile de SIRT1 cresc în rozătoare și țesuturile umane ca răspuns la CR (Cohen și colab. 2004; Nisoli și colab. 2005; Civitarese și colab. 2007), iar această creștere este propusă pentru a provoca modificări favorabile în toleranța la stres declanșată de această dietă. S-a propus, de asemenea, polifenol resveratrolul să imite parțial CR activând SIRT1 pentru a induce efecte benefice asupra sănătății (Baur și colab. 2006; Lagouge și colab. 2006).
Rezultate si discutii
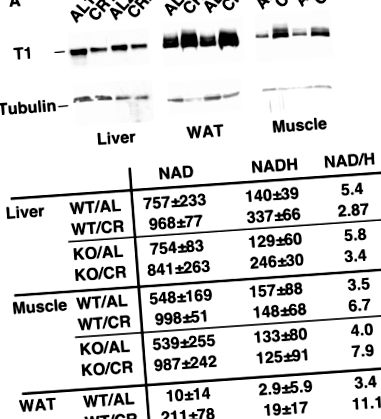
Reglarea diferențială a SIRT1 în țesuturile șoarecilor CR. (A) Expresia SIRT1 este reglată în sus în mușchi și WAT, dar reglată în jos în ficatul șoarecilor CR. Expresia SIRT1 în ficat, mușchi și WAT a șoarecilor hrăniți ad libtum sau cu restricții calorice a fost determinată prin Western blot cu anticorpul anti-SIRT1. Tubulin a fost utilizat ca control de încărcare. (B) Raportul NAD/NADH este crescut în mușchi și WAT, dar scade în ficatul șoarecilor CR. Rețineți că nivelurile de NAD și NADH sunt crescute în WAT de CR. Concentrațiile de NAD și NADH în ficat, mușchi și WAT ale șoarecilor de tip sălbatic și SIRT1 knockout hrăniți ad libitum sau cu restricții calorice sunt exprimate ca nanomoli per gram de țesut.
Șoarecii knockout specifici ficatului SIRT1 nu au fenotip evident atunci când sunt hrăniți cu o dietă chow. (A) SIRT1 este eliminat în mod specific în ficatul șoarecilor SIRT1 LKO. Exprimarea SIRT1 în ficat, mușchi și WAT a fost detectată prin Western blot cu un anticorp anti-SIRT1. Actina a fost utilizată ca control de încărcare. (B - F) Greutatea corporală, greutatea ficatului, glucoza din sânge și nivelurile de insulină (hrănite și postite) și toleranța la glucoză au fost comparate între șoarecii de tip sălbatic și SIRT1 LKO pe o dietă chow.
Apoi am testat șoarecii LKO pe o dietă occidentală bogată în calorii/bogată în grăsimi comparativ cu o dietă CR. Șoarecii LKO au prezentat o diferență foarte semnificativă în dieta occidentală în comparație cu tipul sălbatic (Fig. 3). Creșterea în greutate în timp, care indică acumularea de grăsime corporală, a fost redusă la șoarecii LKO (Fig. 3A), chiar dacă aportul de alimente nu a fost afectat (datele nu sunt prezentate). În mod corespunzător, acumularea de grăsime în WAT și ficat a fost redusă semnificativ la șoarecii LKO (Fig. 3B - D). În plus, șoarecii LKO au fost protejați de declinul fiziologic indus de dieta occidentală la șoarecii de tip sălbatic; au fost mai toleranți la glucoză și au avut niveluri mai scăzute de glucoză din sânge și insulină (Fig. 3E - G). Concluzionăm că șoarecii LKO sunt cel puțin parțial protejați de acumularea de grăsimi și de deficitele metabolice însoțitoare din dieta occidentală. Șoarecii SIRT1 KO din întregul corp, care au o dietă bogată în grăsimi, sunt, de asemenea, protejați împotriva creșterii în greutate corporală și a acumulării de grăsime în ficat (X. Li și L. Guarente, nepublicat), în conformitate cu constatările noastre folosind șoarecii LKO.
Faptul că LKO a avut un efect fenotipic la șoarecii hrăniți cu o dietă bogată în calorii, dar nu la șoarecii hrăniți cu o dietă chow normală, a sugerat că activitatea ficatului SIRT1 poate fi direct proporțională cu aportul caloric și a prezis că această sirtuină poate să nu fie funcțională. în ficatul șoarecilor de tip sălbatic pe CR. În concordanță cu această idee, șoarecii LKO au prezentat pierderea în greutate și reducerea grăsimii în timp pe CR care a fost în paralel cu tipul sălbatic (Fig. 4A, B). Reducerea dimensiunii ficatului, care este declanșată parțial de apoptoză după impunerea CR (Grasl-Kraupp și colab. 1994; James și colab. 1998), a apărut, de asemenea, în mod normal la șoarecii LKO (Fig. 4C). Mai mult, parametrii metabolici care au fost testați (glicemie, insulină și toleranță la glucoză) s-au schimbat în mod similar la șoarecii LKO (Fig. 4D - F). În cele din urmă, reglarea crescută indusă de CR a două gene gluconeogene cheie, PEPCK și glucoză 6-fosfatază (G6P), precum și coactivatorul transcripțional PGC-1α, a procedat normal la șoareci LKO (Fig. 4G).
Șoarecii SIRT1 LKO răspund la CR în mod normal. (A - F) Greutatea corporală, greutatea WAT, greutatea ficatului, nivelul glicemiei, nivelul insulinei și toleranța la glucoză au fost comparate între șoarecii de tip sălbatic și LKO pe o dietă CR. (G) Expresia PGC-1α, PEPCK și G6P au fost comparate între șoareci de tip sălbatic și LKO hrăniți cu o dietă bogată în grăsimi sau o dietă CR prin QRT - PCR.
Concluzionăm că ablația SIRT1 în ficat nu modifică cursul timpului sau nivelurile de stare de echilibru ale modificărilor fiziologice în timpul CR. Această descoperire genetică, împreună cu demonstrația că nivelurile de proteine SIRT1 și raportul NAD/NADH scad în ficatul CR, indică faptul că activitatea acestei sirtuine scade într-adevăr în ficat în timpul CR. Observația recentă că resveratrolul induce sinteza glicogenului în celulele HepG2 cultivate (Sun și colab. 2007) este în concordanță cu ideea că activitatea SIRT1 ridicată în celulele hepatice favorizează stocarea energiei.
De ce SIRT1 este reglementat de dietă în mod opus în ficat în comparație cu alte țesuturi; de exemplu, mușchiul sau WAT? CR crește activitatea metabolică în mușchi și WAT, ceea ce promovează probabil intrarea NADH în transportul de electroni și poate explica creșterile observate ale raportului NAD/NADH. Cu toate acestea, ficatul este unic în îndeplinirea funcțiilor biosintetice cheie - sinteza volumului de grăsimi și colesterol pentru organism (Canbay și colab. 2007), care are loc proporțional cu aportul caloric. Deoarece sinteza grăsimilor este un proces extrem de reductiv - adică consumă echivalenți reducători - ficatul foarte hrănit ar trebui să aibă o stare redox oxidată, iar ficatul CR o stare redox redusă. Acest efect redox va dicta un raport NAD/NADH ridicat în ficatul hrănit și un raport scăzut în ficatul CR, ceea ce este susținut de constatările noastre. După cum am arătat și mai sus, modificările raportului NAD/NADH se află în amonte de SIRT1 și, prin urmare, vor constrânge activitatea acestei sirtuine să fie ridicată în ficatul alimentat și scăzută în ficatul CR. Mai mult, nivelurile de expresie SIRT1 au fost raportate a fi coordonate la starea redox în celule (Zhang și colab. 2007), ceea ce poate explica corelația pozitivă puternică observată între nivelurile de proteine SIRT1 și raportul NAD/NADH în țesuturile CR versus AL.
Este posibil ca evoluția să fi adaptat funcția SIRT1 în diferite țesuturi la constrângerile metabolice asupra activității sale impuse de CR. În mușchi, SIRT1 activat prin CR dezacetilează PGC-1α pentru a induce mitocondriile și oxidarea grăsimilor (Gerhart-Hines și colab. 2007) și, de asemenea, previne apoptoza (Luo și colab. 2001; favorizează mobilizarea grăsimilor (Picard et al. 2004). În ficat, reprimarea SIRT1 de către CR are, de asemenea, sens fiziologic. În primul rând, deoarece SIRT1 coactivează LXR, activitatea redusă a acestei sirtuine în CR va scădea sinteza grăsimilor (Li și colab. 2007). În al doilea rând, activitatea SIRT1 redusă poate activa apoptoza hepatică, despre care se știe că apare ca răspuns la CR (Grasl-Kraupp și colab. 1994; James și colab. 1998). În al treilea rând, în timp ce deacetilarea SIRT1 a PGC-1α activează biogeneza mitocondrială în mușchi, deacetilarea acestui coactivator de către SIRT1 nu afectează expresia genei mitocondriale în ficat (Rodgers și colab. 2005). Astfel, nu ar trebui să existe niciun cost în producția de energie asociat cu reducerea activității SIRT1 în ficat în timpul CR.
S-a sugerat că deacetilarea SIRT1 a PGC-1α în ficat este importantă pentru inducerea gluconeogenezei în timpul postului (Rodgers și colab. 2005; Rodgers și Puigserver 2007). Cu toate acestea, descoperirile noastre indică faptul că glicemia și insulina nu sunt modificate la șoarecii LKO, cel puțin într-un post pe termen lung (24 de ore). Mai mult, în timpul stării de echilibru CR două enzime cheie ale gluconeogenezei, PEPCK și G6P, precum și PGC-1α în sine, sunt induse în mod normal la șoarecii LKO. Evident, nivelul crescut de PGC-1α în timpul CR este suficient pentru gluconeogeneză, chiar și în absența coactivării SIRT1. Aceste descoperiri sunt în concordanță cu demonstrația recentă că resveratrolul și noile clase de activatori SIRT1 nu induc gluconeogeneză la animalele dozate (Baur și colab. 2006; Lagouge și colab. 2006; Milne și colab. 2007). Rămâne posibil ca SIRT1 să fie necesară pentru gluconeogeneză în perioade mai scurte după post, dar acest lucru va necesita studii suplimentare.
Descoperirile noastre pot avea implicații importante pentru dezvoltarea activatorilor SIRT1 ca mimetici CR. Orice activator SIRT1 sistemic poate avea efectul nedorit de a induce sau cel puțin să nu prevină sinteza grăsimilor și a colesterolului în ficat. Această posibilitate poate explica de ce mai multe categorii de activatori SIRT1 nu reduc greutatea corporală (Milne și colab. 2007). Cu toate acestea, activarea SIRT1 în țesuturile metabolice, cum ar fi mușchii și adipocitele, poate compensa parțial efectele nefavorabile ale acumulării de grăsime. De exemplu, șoarecii hrăniți cu resveratrol pe o dietă bogată în grăsimi nu dobândesc ficat gras și prezintă de fapt fiziologie hepatică îmbunătățită și funcție metabolică (Baur și colab. 2006; Lagouge și colab. 2006). Descoperirile noastre ridică posibilitatea interesantă ca inhibitorii SIRT1 vizați în mod specific ficatului pot fi benefice în tratarea obezității. Astfel de inhibitori pot ajuta, de asemenea, la atenuarea efectelor secundare nedorite în ficatul agoniștilor LXR, care au fost dezvoltați pentru a crește transportul invers al colesterolului și efluxul din țesuturile periferice.
Pe scurt, arătăm că reglarea SIRT1 prin dietă este mai complicată decât imagina inițial. Deși s-a presupus că activitatea SIRT1 crește în general în timpul CR, arătăm că în ficat activitatea acestei sirtuine scade de fapt. Reglarea activității SIRT1 în timpul RC nu este numai specifică țesutului, ci și regiunii specifice în țesuturile neomogene, cum ar fi creierul (D. Chen și L. Guarente, nepublicat). Reducerea activității SIRT1 în ficatul CR se corelează cu rolul redus al acestui organ în sinteza grăsimilor. SIRT1 se poate așeza astfel în mod proeminent în redistribuirea resurselor în timpul CR de la creștere, metabolism și reproducere până la întreținere și supraviețuire.
Materiale și metode
Șoarecii knockout SIRT1 au fost descriși anterior (McBurney și colab. 2003). Șoarecii knock-out specifici ficatului SIRT1 au fost generați prin încrucișarea unei alele SIRT1 conținând un exon 4 floxat (Cheng și colab. 2003) cu șoareci care exprimă Cre conduși de promotorul de albumină specific ficatului. Toți șoarecii au fost adăpostiți pe un ciclu de lumină: întuneric de 12: 12 ore la temperatura controlată (25 ± 1 ° C). Animalele în vârstă de trei până la patru luni (n = 10) au fost fie hrănite ad libitum, fie au fost supuse unei diete cu restricție calorică de 40% timp de până la 3 luni, care a fost oferită zilnic seara. Datele experimentelor CR au fost colectate dimineața. Dieta occidentală bogată în grăsimi a fost furnizată de OpenSource Diets (D12079B). Toate procedurile la animale au fost în conformitate cu comitetul de îngrijire a animalelor MIT.
Sângele a fost colectat din venele cozii a câte 10 șoareci per grup și păstrat pe gheață până la centrifugare (1500g, 15 minute la 4 ° C). Plasma a fost utilizată imediat pentru teste sau stocată la -80 ° C până la analiză. Concentrațiile de glucoză au fost determinate cu ajutorul glucometrului OneTouch Ultra (LifeScan). Nivelurile de insulină au fost măsurate utilizând trusa EIA pentru insulină cu șoarece ultrasunetos (Alpco Diagnostics).
Pentru testul de toleranță la glucoză, șoarecii au fost postiti peste noapte și injectați intraperitoneal cu o soluție salină de glucoză la 1 g/kg greutate corporală. Nivelurile de glucoză plasmatică au fost măsurate înainte și la 20, 40, 60 și 120 de minute după injectarea glucozei.
Prepararea și analiza ARN și proteine
ARN-ul total a fost extras din țesuturi prin TRIZOL (Invitrogen) și a fost purificat în continuare cu mini-kit RNeasy (Qiagen). Pentru analiza PCR în timp real, ADNc a fost sintetizat din ARN total prin transcriptază inversă SuperScript III (Invitrogen) cu primeri aleatori. ADNc a fost supus analizei PCR cu primeri specifici genei în prezența CYBR verde (Bio-Rad). Abundența relativă de ARNm a fost obținută prin normalizare la nivelurile de ciclofilină.
Proteinele din țesuturile șoarecilor au fost extrase în tampon RIPA (1% Triton X-100, 150 mM NaCI, 5 mM EDTA, 10 mM Tris 7.0) conținând un cocktail inhibitor de protează (Sigma). Extractele de proteine au fost supuse centrifugării la 14.000 rpm timp de 10 min. Anticorp SIRT1 (diluție 1: 1000; Biotehnologii de stat). Anticorp SREBP1c (Santa Cruz Biotechnologies).
Măsurarea NAD și NADH
NAD și nucleotidele NADH au fost măsurate așa cum s-a descris (Lin și colab. 2004). Aproximativ 10 mg de țesuturi înghețate au fost omogenizate în 300 μL de tampon de extracție acid pentru a obține concentrația de NAD sau tampon alcalin pentru a obține concentrația de NADH. Două sute patruzeci de microlitri de supernatant au fost neutralizați cu 120 pl de tampon. Concentrația de nucleotide a fost măsurată fluorimetric într-o reacție enzimatică de ciclism folosind 2-5 μL de probă.
- Ce efect are restricția calorică asupra creierului Thorne
- De ce chiar și persoanele subțiri pot beneficia de restricții de calorii
- Sunbursts roșii cherry galbene (5 bucăți) Informații despre calorii, grăsimi, carbohidrați și proteine la
- Cum arată 500 de mese calorice
- De ce numărul de calorii pentru Fitness Tracker este conectat peste tot pe hartă