Walter D Longo
1 Andrus Gerontology Center, Universitatea din California de Sud, Los Angeles, California, SUA
Luigi Fontana
2 Departamentul de Medicină Internă, Școala de Medicină a Universității Washington, St. Louis, Missouri, SUA
3 Divizia Nutriție și Îmbătrânire, Istituto Superiore di Sanità, Roma, Italia
Abstract
O descoperire importantă din ultimii ani a fost că stilul de viață și factorii de mediu afectează inițierea, promovarea și progresia cancerului, sugerând că multe tumori maligne pot fi prevenite. Studiile epidemiologice sugerează cu tărie că adipozitatea excesivă, scăderea activității fizice și dietele nesănătoase sunt actori cheie în patogeneza și prognosticul multor tipuri de cancer comune. În plus, restricția calorică (CR), fără malnutriție, s-a dovedit a fi, în general, eficientă în prevenirea cancerului la tulpinile de rozătoare de laborator. CR moderat cu debut la adulți reduce, de asemenea, incidența cancerului cu 50% la maimuțe. Nu se cunoaște dacă efectele antitumorigene ale RC se vor aplica oamenilor, dar CR are ca rezultat o reducere consistentă a nivelurilor circulante ale factorilor de creștere, hormoni anabolici, citokine inflamatorii și markeri de stres oxidativ asociați cu diferite tumori maligne. Aici, discutăm legătura dintre intervențiile nutriționale și prevenirea cancerului, concentrându-ne pe mecanismele care pot fi responsabile de aceste efecte la sistemele simple și la mamifere, în vederea dezvoltării agenților de chemoprevenție.
INTRODUCERE
90% din decesele provocate de cancer la om (8, 9).
Modificările metabolice, hormonale și ale factorilor de creștere asociate cu creșterea consumului de alimente, scăderea activității fizice și adipozitatea excesivă afectează reglarea și expresia genelor implicate în repararea ADN, proliferarea și diferențierea celulelor sau apoptoza, permițând celulelor să acumuleze daune și mutații, să supraviețuiască, proliferează și în condiții permisive, suferă o transformare malignă (10, 11). Aceste efecte dăunătoare pot fi potențate de expunerea la agenți cancerigeni non-genotoxici (de exemplu, etanol, zaharină, 1,4-diclorobenzen, 17beta-estradiol, arsenic și beriliu) care induc leziuni celulare, prin inflamație, stres oxidativ crescut și secreția de hormoni anabolici, imunosupresia și activarea căilor de transducție a semnalului care duc la instabilitate genomică, pierderea controlului proliferării și rezistență la apoptoză (12).
Restricția calorică (CR) fără malnutriție este cea mai puternică și reproductibilă intervenție fiziologică pentru creșterea duratei de viață și protejarea împotriva cancerului la mamifere (13, 14). CR reduce nivelurile unui număr de hormoni anabolici, factori de creștere și citokine inflamatorii, reduce stresul oxidativ și proliferarea celulară, îmbunătățește autofagia și mai multe procese de reparare a ADN-ului (13, 14). Prin urmare, înțelegerea mecanismelor metabolice și moleculare responsabile de efectul de prevenire a cancerului mediat de CR are potențialul de a conduce la medicamente și terapii pentru prevenirea și tratamentul cu spectru larg al cancerului. Aici, discutăm intervențiile nutriționale care s-au dovedit a preveni cancerul și a ameliora prognosticul cancerului. De asemenea, descriem căile și mecanismele genetice care par a fi cruciale pentru efectele CR și discutăm dovezile pentru efectele potențial protectoare, dar și dăunătoare la om.
NUTRIȚIA ȘI CANCERUL
Adipozitate excesivă și risc de cancer
Mai multe studii epidemiologice au arătat în mod constant asocieri între adipozitate și risc crescut de cancer al endometrului, sânului (postmenopauză), colonului, esofagului (adenocarcinom), rinichi (celule renale), pancreas, vezicii biliare și ficat (10, 23). Nu se observă nicio asociere între adipozitate și riscul de a dezvolta cancer pulmonar și de prostată, în timp ce cancerul de sân premenopauzal este invers corelat cu indicele de masă corporală (10, 21).
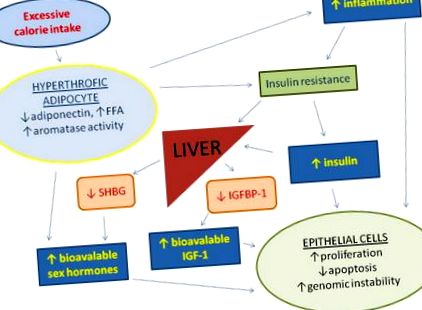
Aportul excesiv de calorii și stilul de viață sedentar promovează hipertrofia țesutului adipos, reduc producția de adiponectină și măresc acizii grași liberi circulanți (FFA) și inflamația, ducând la rezistență la insulină și hiperinsulinemie compensatorie. Creșterea concentrației serice de insulină determină o reducere a sintezei hepatice a proteinei 1 de legare a factorului de creștere asemănător insulinei (IGFBP1) și a globulinei de legare a hormonilor steroizi (SHBG), ceea ce duce la biodisponibilitatea crescută a factorului de creștere a insulinei 1 (IGF-1) și a hormonilor sexuali. Țesutul adipos este, de asemenea, o sursă majoră de estrogeni extra-glandulari. Nivelurile circulante crescute de insulină, IGF-1, hormoni sexuali și citokine inflamatorii promovează proliferarea celulară, instabilitatea genomică și inhibă apoptoza în multe tipuri de celule.
Restricție calorică și cancer
În 1909, Moreschi a publicat prima lucrare științifică care a raportat că CR inhibă dezvoltarea tumorilor transplantate la șoareci (53). Ulterior, datele au arătat că CR, definită ca o reducere a aportului de calorii sub aportul obișnuit ad libitum fără malnutriție, inhibă tumorile spontane, induse chimic și induse de radiații în mai multe modele animale de cancer (54-60). Mai recent, s-a demonstrat că CR 30% cu debut la adulți reduce morbiditatea și mortalitatea cauzată de cancer și la primatele neumane. Incidența cancerului (în principal adenocarcinomul gastro-intestinal) a fost redusă cu 50% la maimuțele CR, comparativ cu cea din martori (61). Vârsta la care se începe RC, severitatea RC și tulpina/fundalul genetic al animalelor determină amploarea prevenirii sau întârzierii cancerului (54-60, 62). La rozătoare, reducerea cu 15% -53% a aportului de calorii sub aportul obișnuit ad libitum a determinat o reducere liniară proporțională cu 20% -62% a incidenței tumorilor (63). Cu toate acestea, efectele RC asupra cancerului nu sunt omogene. Unele tipuri de cancer prezintă un răspuns mai mare la RC decât altele, iar o mică parte a tumorilor este rezistentă la efectele CR (54, 56, 57, 60, 62).
CR provoacă mai multe adaptări metabolice/hormonale cheie, care modifică expresia mai multor gene și căi de semnalizare (reglarea ascendentă a anumitor gene/căi de semnalizare și reglarea descendentă a altora, așa cum este indicat de săgeți), care produc adaptări celulare majore (de exemplu, o reducerea proliferării celulare, eliminarea crescută a organelor sau celulelor deteriorate prin autofagie sau apoptoză, reglarea în sus a sistemelor de reparare a ADN-ului și stabilitatea genomică) care duc la o incidență redusă a cancerului (vezi textul). T3 = triiodotironină; PI3K = fosfatidilinozitol-3 kinază; AKT = kinază AKT, cunoscută și sub numele de protein kinază B; S6K1 = proteină kinază ribozomală S6 1; mTOR = țintă de rapamicină la mamifere; MAPK = proteina kinază activată cu mitogen; NRF2 = factori de transcripție NF-E2 factor 2 legat; SIRT-1 = reglarea informațiilor de tip împerechere silențioasă 2 omolog 1; AMPK = proteină kinază activată cu adenozin monofosfat (AMP); FOXO = Factori de transcriere a furcii; PTEN = fosfatază și tensin omolog.
Reglarea endocrină a cancerului prin semnale asemănătoare insulinei
Factorul de creștere asemănător insulinei (IGF-1), un factor de creștere produs în principal din ficat, acționează sinergic cu alți hormoni anabolizanți (de exemplu insulină, steroizi sexuali) și, în raport cu disponibilitatea caloriilor și proteinelor, pentru a regla metabolismul energetic, celula proliferarea, diferențierea celulară, dimensiunea corpului și longevitatea (31, 35, 36). În plus, IGF-1 exercită un efect mitogen puternic asupra unei varietăți de celule canceroase, prin creșterea ratei de proliferare și inhibarea apoptozei (31, 88).
Restricția calorică pe termen lung, dar nu exercițiul de rezistență, scade concentrația serică de IGF-1 cu aproximativ 30-40% la rozătoare, iar această reducere mediată de CR a nivelurilor de IGF-1 se crede că joacă un rol cheie în protejarea împotriva cancerului și încetinirea îmbătrânire (11, 64, 89-90). Efectul protector puternic mediat de CR împotriva carcinogenezei la rozătoare este inversat prin infuzarea hormonului de creștere sau IGF-1 (91-93), subliniind în continuare rolul critic al acestor factori de creștere în patogeneza cancerului. În plus, șoarecii eliminabili ai receptorului hormonului de creștere (GHR), care au concentrații serice scăzute de IGF-1, prezintă o
Reducerea cu 50% a sarcinii tumorale și a incidenței cancerelor letale, în acord cu rezultatele piticului Snell cu deficit de hormon de creștere (GH), în care cancerul este fie redus, fie amânat (94, 95). O rată mai mică de mutație la șoarecii pitici Ames cu vârstă mijlocie cu deficit de GH a fost observată la rinichi, ficat și intestin, oferind unele explicații mecaniciste pentru întârzierea bolilor neoplazice (96). În schimb, șoarecii supraexprimând GH au concentrații foarte mari de IGF-1, mărirea corpului a crescut până la 100%, incidența crescută și setarea precoce a tumorilor și o reducere marcată a duratei de viață comparativ cu frații lor normali (97). Cu toate acestea, reducerea reglementării semnalizării IGF-I poate explica doar o parte din efectele deficiențelor CR, GH și GHR în protejarea împotriva cancerului. Creșterea corticosteronului mediată de CR, de exemplu, poate juca, de asemenea, un rol important în prevenirea cancerului, deoarece adrenalectomia inversează efectele de protecție împotriva cancerului ale CR, iar suplimentarea cu glucocorticoizi restabilește inhibarea (98).
Rolul IGF-1 în patogeneza unor cancere umane este susținut de studii epidemiologice, care au constatat că concentrațiile serice ridicate de IGF-I sunt asociate cu un risc crescut de mai multe tipuri de cancer comune, inclusiv cele ale prostatei, sânului și colon. (99). O incidență crescută a tumorilor a fost, de asemenea, observată la pacienții acromegalici, care au niveluri crescute de IGF-I (100). Nutriția este unul dintre principalii regulatori ai nivelurilor de IGF-1 circulante. Postul la oameni reduce semnificativ concentrația serică de IGF-1 în intervalul observat la pacienții cu deficit de GH (101), dar CR sever pe termen lung nu reduce nivelurile circulante de IGF-1 la bărbații și femeile sănătoase de vârstă mijlocie dacă aportul de proteine este mare (102, 103). În schimb, vegetarienii stricți care consumă o dietă proteică moderat restricționată (
0,75 g de proteină/kg greutate corporală/zi) prezintă concentrații serice semnificativ mai mici de IGF-1 total și liber (102). Mai mult, reducerea aportului de proteine la persoanele care practică CR severă cu aport ridicat de proteine (
OBIECTIVELE MOLECULARE A RESTRICȚIEI CALORIE
Deoarece CR extinde durata de viață a tuturor modelelor majore de organisme utilizate pentru a studia îmbătrânirea, căile de răspuns nutrienți care reglează îmbătrânirea și instabilitatea genomică dependentă de vârstă în aceste organisme pot oferi informații despre mecanismele care leagă CR și reducerea cancerului. Deși viermii și muștele sunt organisme model excelente pentru a studia îmbătrânirea, rețeaua lor celulară în mare parte nedivizorie și fenotipurile tumorale rare își limitează valoarea în studiile mecanismelor tumorigenezei dependente de vârstă. Prin contrast, S. cerevisiae simplu poate oferi dovezi pentru mecanismele moleculare fundamentale ale instabilității genomice dependente de vârstă, în timp ce șoarecii pot fi studiați pentru a determina dacă mecanisme similare se aplică mamiferelor. Aici, vom revizui căile și mecanismele majore considerate a conecta CR și instabilitatea genomică și/sau cancerul.
Căile care mediază extensia longevității dependente de CR reglează instabilitatea genomică și fenotipurile asemănătoare cancerului în S. cerevisiae
S. cerevisiae are avantajele de a fi poate cel mai simplu și cel mai bine caracterizat model de sistem pentru studierea îmbătrânirii. După cum sa observat la mamifere (114), mutațiile, care cresc odată cu vârsta la S. cerevisiae de până la 10 ori, sunt reduse cu CR (115-117). Ștergerea fie a TOR/SCH9, a omologilor de drojdie a țintă mamifere rapamicină (mTOR), respectiv a kinazei S6 (S6K) și/sau a genelor AKT, și reglarea descendentă a Ras/adenilil ciclazei (AC)/calea protein kinazei A (PKA) amână această creștere dependentă de vârstă a mutațiilor spontane (118-120). În special, reglarea descendentă a căilor Tor/Sch9 și Ras/AC/PKA este necesară pentru a prelungi durata de viață a drojdiei printr-un mecanism care implică reglarea în sus a factorilor de transcripție a rezistenței la stres descriși mai jos.
În plus față de sistemele de stres oxidativ, căile Tor/Sch9 și Ras/AC/PKA reglează expresia unui număr de gene de reparare a ADN-ului (125). Printre acestea se numără gena REV1, care funcționează în sistemul de reparare a translației predispus la erori, împreună cu polimeraza Polzeta. Sistemul Rev1/Polzeta este responsabil pentru o parte majoră a mutațiilor ADN dependente de vârstă (119). Dovezile sugerează că calea Tor/Sch9 promovează generarea de superoxizi și reduce protecția anti-oxidantă prin reglarea descendentă a Msn2/4 și Gis1. Aceste modificări duc la creșterea deteriorării oxidative a ADN-ului, dar și la creșterea expresiei genei REV1, care, împreună, promovează mutații punctiforme dependente de vârstă (119). Activarea Rev1/Polzeta predispusă la erori pare să genereze mutații punctuale ca parte a unui proces necesar pentru a preveni rearanjările cromozomiale brute potențial mai dăunătoare care apar atunci când replicarea este blocată. Nu se cunoaște dacă Rev1/Polzeta este implicat în efectul dependent de CR asupra protecției ADN.
Căi moleculare care mediază efectele anticanceroase ale restricției calorice
Studiile efectuate pe drojdie, viermi și muște indică faptul că insulina și căile IGF-I pot fi importante pentru îmbătrânire și cancer la mamifere (Figura 3). La șoareci, mutațiile genelor Prop-1 sau Pit-1, care cauzează deficiențe severe în GH și IGF-I, extind durata de viață cu 25 până la 65% și provoacă nanism (126, 127). Aceste deficiențe par să medieze efectele mutațiilor Prop-1 și Pit-1 asupra longevității, deoarece șoarecii care nu pot elibera GH ca răspuns la hormonul de eliberare a hormonului de creștere trăiesc, de asemenea, mai mult (128). De fapt, șoarecii pitici cu GH cu plasmă ridicată, dar cu șoareci knet-out receptori IGF-I femele heterozigoți cu IGF-I (GHR/BP nul) cu 90% mai mici trăiesc mai mult decât controalele de tip sălbatic (129, 130).
Concluzii și direcții viitoare
Probabilitatea de a dezvolta cancer este remarcabil de mare în SUA, cu aproximativ 44% dintre bărbați și
Mulțumiri
Finanțare/Sprijin: Sprijinit de numărul de subvenție UL1 RR024992 de la Centrul Național pentru Resurse de Cercetare (o componentă a Institutului Național de Sănătate și Foaia de parcurs NIH pentru cercetare medicală), de către Institutul Superiore di Sanità/Institutul Național de Sănătate Programul de Colaborare Grant, subvenții de la Ministero della Salute, un grant de la Longer Life Foundation (un parteneriat RGA/Washington University), un grant de la Bakewell Foundation și o donație de la Scott și Annie Appleby Charitable Trust.
Rolul sponsorului: Agenția de finanțare nu a avut nici un rol în analiza sau interpretarea datelor sau în decizia de a trimite raportul spre publicare.
Note de subsol
Dezvăluiri financiare: Autorii nu au avut conflicte de interese.
Declinarea responsabilității editorului: Acesta este un fișier PDF al unui manuscris neditat care a fost acceptat spre publicare. Ca serviciu pentru clienții noștri, oferim această versiune timpurie a manuscrisului. Manuscrisul va fi supus copierii, compunerii și revizuirii dovezilor rezultate înainte de a fi publicat în forma sa finală citabilă. Vă rugăm să rețineți că, în timpul procesului de producție, pot fi descoperite erori care ar putea afecta conținutul și că toate responsabilitățile legale care se aplică jurnalului se referă.
- Restricționarea caloriilor, îmbătrânirea și prevenirea cancerului Mecanisme de acțiune și aplicabilitate pentru oameni
- Sunt postul intermitent și restricția calorică aceleași mese metabolice
- BBC Radio 4 - BBC Inside Science, Calorie Restriction; Epoca Lunii; Mars Yard; IPCC
- Postul alternativ de zi și restricția calorică produc rezultate similare la oameni; Lupta împotriva îmbătrânirii!
- 7 moduri de restricționare a caloriilor sunt dăunătoare - Pregătirea mesei pe Fleek ™