Barbara Strasser
1 Divizia de Biochimie Medicală, Biocentru, Universitatea de Medicină din Innsbruck, Austria
Konstantinos Volaklis
2 Departamentul de Prevenire și Medicină Sportivă, UTM, München, Germania
Dietmar Fuchs
3 Divizia de Chimie Biologică, Biocentru, Universitatea de Medicină din Innsbruck, Austria
Martin Burtscher
4 Departamentul Științe Sportive, Secția Medicală, Universitatea Innsbruck, Austria
Abstract
Este bine cunoscut faptul că persoanele de toate vârstele beneficiază de activitate fizică regulată, ceea ce reduce riscul de boli coronariene, hipertensiune, anumite tipuri de cancer, diabet de tip 2 și multe alte boli cronice. Într-adevăr, un nivel scăzut de fitness cardiorespirator este acceptat în zilele noastre ca un predictor puternic al mortalității la persoanele sănătoase și bolnave [1-3]. Forța musculară este o componentă importantă a aptitudinii fizice cu un rol independent în prevenirea multor boli cronice. Mai multe studii epidemiologice au arătat că slăbiciunea musculară la persoanele de vârstă mijlocie și în vârstă este puternic legată de limitările funcționale și dizabilitatea fizică [4-6]. Mai mult, studiile epidemiologice sau pe termen scurt indică un potențial efect benefic al creșterii aportului de proteine la adulții vârstnici. Astfel, scopul principal al prezentei lucrări este de a oferi o imagine de ansamblu asupra rolului exercițiului fizic în sănătatea musculară la bătrânețe și de a evidenția dovezile clinice ale aportului de proteine dietetice pentru a sprijini îmbătrânirea sănătoasă.
Forța musculară și longevitatea
Biologia îmbătrânirii musculare
Mușchii scheletici umani suferă în mod inevitabil modificări remarcabile odată cu îmbătrânirea, caracterizată printr-o scădere a masei musculare și a forței de aproximativ 1% pe an de la vârsta de aproximativ 40 de ani [39]. În cele din urmă, risipa musculară va contribui semnificativ la fragilitate, imobilitate și pierderea independenței. Cu toate acestea, gradul de pierdere a mușchilor diferă foarte mult între indivizi datorită diferențelor în procesul de îmbătrânire în sine, precum și în ceea ce privește nivelurile de activitate fizică. Modificările în arhitectura musculară și compoziția tipului de fibre, în proprietățile mecanice ale tendonului și controlul vascular al mușchiului contractant sunt cele mai proeminente caracteristici asociate cu scăderea masei și funcționarea mușchilor scheletici în vârstă [40-42].
Modificări legate de vârstă în arhitectura musculară
Modificări distincte ale arhitecturii musculare apar în timpul îmbătrânirii care rezultă din inactivitate (atrofie de dezactivare) și care provin din procesul de îmbătrânire (sarcopenie senilă) [42]. În timp ce atrofia inutilizării se caracterizează doar printr-o reducere a dimensiunii fibrelor, sarcopenia prezintă atât o dimensiune redusă a fibrelor, cât și un număr redus de fibre. În plus, lungimea fasciculului și unghiul de penație scad odată cu îmbătrânirea [43]. Observația conform căreia secțiunea transversală fiziologică (volumul muscular împărțit la lungimea fasciculului) scade odată cu uzarea și îmbătrânirea indică, de asemenea, o pierdere mai accentuată de sarcomeri în paralel decât sarcomerele în serie (lungimea fasciculului) [42].
Modificări legate de vârstă în compoziția tipului de fibre
Reducerea volumului muscular la vârstnici rezultă din reducerea unităților motorii și a fibrelor musculare. În timp ce dimensiunea fibrelor musculare de tip 1 este aproape menținută, dimensiunea fibrelor de tip 2 scade [44]. Cu toate acestea, pierderea fibrelor rămâne principalul motiv pentru reducerea masei musculare și a forței odată cu îmbătrânirea. Fibrele de tip 2 par să fie deosebit de predispuse la creșterea denervării odată cu înaintarea în vârstă [45]. Cu toate acestea, pierderea de fibre este cel puțin parțial prevenită, deoarece neuronii motori de tip 1 formează conexiuni cu fibrele denervate de tip 2. În consecință, neuronii motori de tip 1 se măresc în detrimentul fibrelor de tip 2 [45]. Descărcarea musculară (dezafectare) provoacă o tranziție lentă până la rapidă, indicată de creșterea izoformelor cu lanț greu de miozină rapidă (MHC), precum și de izoformele cu lanț ușor de miozină rapidă (MLC) [46]. Spre deosebire de neutilizare, îmbătrânirea în sine are ca rezultat o tranziție rapidă-lentă, explicată parțial prin denervarea fibrelor de tip 2 și glicarea MHC [47].
Mecanisme propuse
Răspunsul fiziologic la antrenamentul de efort
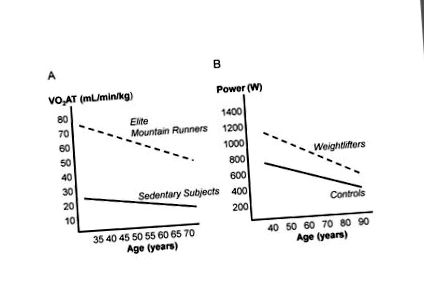
Scăderea legată de vârstă a pragului anaerob (VO2AT) la alergătorii de munte și subiecții sedentari (A) și puterea maximă la ridicătorii de greutate și subiecții de control sedentar (B); (modificat de la ref. 58, 59).
Tipul de rezistență al exercițiului
Tipul de rezistență al exercițiului
Proteine alimentare, mușchi și îmbătrânire sănătoasă
Rezistența anabolică a MPS la îmbătrânire - importanța exercițiului
Beneficiile clinice ale suplimentării cu proteine
Atrofia musculară este un efect nefericit al îmbătrânirii și al multor boli și poate compromite funcția fizică și afecta procesele metabolice vitale [89]. Intervențiile pentru sarcopenie includ exercițiile fizice și nutriția [90, 91], deoarece ambele au un impact pozitiv asupra anabolismului proteinelor, dar îmbunătățesc și alte aspecte care contribuie la bunăstarea la adulții sarcopenici în vârstă, cum ar fi funcția fizică, calitatea vieții și anti- stare inflamatorie [92]. Antrenamentul de rezistență duce la o creștere reală a masei corporale slabe și a forței musculare la adulții în vârstă sănătoși și, prin urmare, este considerat a fi cea mai bună metodă de exercițiu pentru tratamentul sarcopeniei [93]. Dovezi în creștere susțin creșterea absorbției proteinelor musculare prin intervenții nutritive, împreună cu o manipulare contracțională adecvată [94]. De importanță pentru adulții mai în vârstă, ridicarea greutății reduse stimulează efectiv ratele MPS la un nivel comparabil cu sarcinile tradiționale mari, pe lângă alte beneficii, cum ar fi capacitatea aerobă îmbunătățită [95].
Mușchiul îmbătrânit este, de asemenea, un predictor semnificativ al căderilor și fracturilor asociate cu o pierdere a independenței la bătrânețe [107, 108]. Astfel, intervențiile anabolice împotriva sarcopeniei sunt deosebit de relevante în această cohortă, deoarece este mai răspândită la pacienții vârstnici cu fractură de șold [109]. Deși subnutriția energetică a proteinelor prezice un rezultat slab la pacienții cu fractură de șold, creșterea consumului de energie și proteine are un efect favorabil asupra evoluției postoperatorii la persoanele în vârstă cu fracturi de șold [110]. Pe scurt, clinicienii nu ar trebui să treacă cu vederea beneficiul exercițiului combinat și al ingestiei de proteine. Stimularea musculară este esențială pentru a preveni risipa musculară, pentru a menține funcția musculară normală și pentru a reduce inflamația la pacienții spitalizați; acestea sunt modalități cruciale de atenuare a dezvoltării infecției și a mortalității. În plus, există o nevoie clară de aport de proteine dietetice peste actualul ADR la persoanele în vârstă, în special în perioadele în care masa musculo-scheletică este compromisă, cum ar fi imobilizarea, experții recomandând între 1,2 și 2,0 g/kg de masă corporală pe zi [111]. .
Cantitatea de proteine, calitatea și momentul consumului
Metabolismul triptofan-kinureninei și activarea imună la îmbătrânire
Activarea imună în timpul îmbătrânirii influențează metabolismul aminoacizilor [120]. Deși mai puțin de 1% din triptofanul alimentar este utilizat pentru sinteza proteinelor, metabolismul triptofanului ar putea avea o relevanță deosebită la vârstnici. Triptofanul aminoacid esențial nu este numai singurul precursor al serotoninei și, prin urmare, este important pentru starea de spirit și cognitivă, dar este, de asemenea, legat de inflamație și activarea imunitară prin așa-numita cale kynurenine (KP), care este adesea reglată sistematic atunci când răspunsul imunitar este activat [121]. Citonina de tip Th1 interferon-gamma, printre alte căi biochimice, induce descompunerea triptofanului de către enzima indoleamină 2,3-dioxigenază (IDO-1). Ca urmare a activității IDO-1 accelerată, nivelurile de indoleamine triptofan și serotonină devin diminuate și acest lucru poate crește riscul de, de exemplu, tulburări cognitive. Sistemul imunitar activat la persoanele în vârstă poate fi detectat prin creșterea concentrațiilor de kinurenină la triptofan (Fig. 2).
Procesul de îmbătrânire implică căi pro-inflamatorii care includ activarea axei celulelor T-macrofage în cadrul răspunsului imun mediate celular (de tip Th1) în care formarea citoninei de tip Th1 interferon-γ (IFN-γ ) este de cea mai mare relevanță. IFN-y stimulează un spectru larg de căi biochimice care sunt direcționate pentru a opri creșterea nedorită a agenților patogeni sau a celulelor maligne. Printre acestea, conversia aminoacizilor esențiali triptofan în kinurenină este un element cheie, care, pe de o parte, este implicat într-o inhibare a feedback-ului activării celulelor T prin intermediul celulelor T reglatoare și, astfel, imunosupresoare. Pe de altă parte, cataboliții generați de această strategie pot avea un impact asupra sistemului nervos central atunci când compușii neuroactivi se acumulează și cascadele pro-inflamatorii, inclusiv formarea de specii reactive de oxigen (ROS), interferează cu semnalizarea neuroendocrină, care controlează starea de spirit și comportamentul.
Restricția energetică are ca rezultat în mod clar triptofan plasmatic scăzut și, prin urmare, disponibilitatea acestuia, care poate submina metabolismul serotoninei, KP și, ulterior, sistemul imunitar [122]. Mai mult, fluxul de triptofan în KP hepatic este sporit de aminoacizi concurenți, cum ar fi leucina [123]. Deși o dietă bogată în proteine oferă mai mult triptofan pentru KP, disponibilitatea triptofanului pentru creier este redusă paradoxal, deoarece triptofanul concurează cu ceilalți aminoacizi neutri mari (LNAA) pentru transportul peste bariera hematoencefalică [124]. De exemplu, un mic dejun bogat în proteine induce o scădere semnificativă a raportului triptofan total plasmatic la raportul LNAA [125]. Deși aceste modificări se aplică aportului acut de proteine, un aport ridicat de proteine limitează disponibilitatea triptofanului pentru CP cerebral, poate influența în continuare sinteza serotoninei și poate perturba memoria și cunoașterea, precum și somnul și starea de spirit, ceea ce crește în cele din urmă riscul de a dezvolta demență și depresie (Fig. 3).
Pe de altă parte, exercițiul fizic moderat, un stimul puternic pentru a modula metabolismul triptofanului, ar putea fi util în îmbunătățirea stării de dispoziție [126]. În timpul exercițiului, intrarea triptofanului în creier prin bariera hematoencefalică este favorizată de utilizarea musculară crescută a aminoacizilor cu lanț ramificat (BCAA) și a acizilor grași plasmatici ridicați. Acest lucru ridică raportul dintre triptofan nelegat și BCAA urmat de o creștere substanțială a disponibilității triptofanului la nivelul creierului, ducând în consecință la concentrații mai mari de serotonină în unele zone ale creierului [127]. Rezultatele recente arată că exercițiul de anduranță regulat determină, de asemenea, adaptări în metabolismul kinureninei prin creșterea expresiei musculare scheletice a kinureninei aminotransferazei, care mută metabolismul kinureninei departe de metaboliții neurotoxici ai kinureninei, precum acidul chinolinic, la producția de acid kinurenic. Prin această metodă, se previne încrucișarea kinureninei prin bariera hematoencefalică și întreruperea plasticității neuronale, ceea ce poate avea implicații pentru recomandările de exerciții pentru pacienții cu tulburări depresive [128].
Triptofan-cinurenină, sarcopenie și longevitate
Procesul de îmbătrânire este însoțit de activare imunitară cronică și inflamație, iar sarcopenia poate reprezenta o consecință a unei strategii de contrareglare a sistemului imunitar de a atenua procesul de activare imună. Astfel, defalcarea triptofanului ar putea reprezenta un punct de control important. Privarea de triptofan poate suprima procesele de activare imună prin restricționarea biosintezei proteinelor și inducerea celulelor T reglatoare de către metaboliții kinureninei [129, 130]. S-a observat descompunerea accelerată a triptofanului la pacienții sănătoși [131, 132]. Poate fi legat de diagnostice clinice specifice care sunt frecvente la bătrânețe, cum ar fi bolile cardiovasculare, infecțiile cronice sau cancerul. De asemenea, nu numai pierderea imunocompetenței, ci și scăderea capacităților cognitive și a memoriei și riscul mai mare de dispoziție depresivă se pot dezvolta pe baza deficitului de triptofan din cauza descompunerii accelerate. Astfel, aceste simptome pot reprezenta efecte secundare ale evenimentelor imunobiochimice care derivă din activarea imună cronică.
De mult timp, terapia imunosupresivă și/sau antiinflamatorie a fost discutată ca o abordare profilactică și terapeutică pentru a reduce afecțiunile asociate vârstei și pentru a crește durata de viață [133, 134]. O rată mai mare de descompunere a triptofanului și niveluri serice mai mici de triptofan au fost descrise ca fiind asociate cu o durată de viață reziduală redusă la persoanele cu risc cardiovascular, iar acest lucru a fost adevărat nu numai pentru mortalitatea cardiovasculară, ci și pentru mortalitatea generală [135, 136]. În mod interesant, proprietățile imunomodulatoare ale rapamicinei și resveratrolului sunt, de asemenea, responsabile pentru capacitatea lor de a suprima defalcarea triptofanului și activarea IDO-1, care au fost observate în celulele mononucleare din sângele periferic uman in vitro [137, 138]. În timp ce exercițiile fizice intense pot provoca activarea imună cronică și pot fi implicate în dezvoltarea funcției imune afectate [139], activitatea fizică moderată și antrenamentul muscular pot fi considerate strategii eficiente împotriva supraîncărcării cu antioxidanți, dar în ce măsură ar putea fi capabil să combată modificările asociate îmbătrânirii în metabolismul triptofan rămâne de demonstrat.
Concluzie
Forța musculară reprezintă un rol independent în prevenirea bolilor cronice, unde slăbiciunea musculară este puternic legată de limitările funcționale și dizabilitatea fizică. Mai mult, forța musculară scăzută a fost recunoscută ca un factor emergent de risc pentru mortalitatea prematură dincolo de factorii de risc tradiționali, cum ar fi hipercolesterolemia, obezitatea, hipertensiunea și fumatul. Din motivele de mai sus și pentru că se știe că forța musculară scade odată cu înaintarea în vârstă, exercițiile de tip rezistență și de rezistență sunt prescrise în prezent de numeroase organizații de sănătate pentru a îmbunătăți condiția fizică și pentru a contracara efectele adverse ale îmbătrânirii asupra parametrilor de sănătate, inclusiv riscul de morbiditate și mortalitate [140-142]. În plus, utilizarea suplimentelor de proteine dietetice poate spori și mai mult anabolismul proteinelor, dar poate contribui și la un stil de viață mai activ, sprijinind astfel bunăstarea și îmbătrânirea activă a populației în vârstă.
- Rob Goodwin Fitness Rezistență Rezistență Longevitate Sănătate
- Efect de economisire a proteinelor prin creșterea lipidelor dietetice la tinerii pesti hibrizi tambatinga
- Rolul consumului de sare și potasiu dietetic în sănătatea și bolile cardiovasculare O revizuire a
- Rolul microbiomului în medierea efectelor asupra sănătății componentelor dietetice Journal of Agricultural
- Secțiunea B Rolul constituenților dietetici nonutritivi - dietă, nutriție și cancer - NCBI