Sirt3 SUMOylation suprimă activitatea sa catalitică în mitocondrii
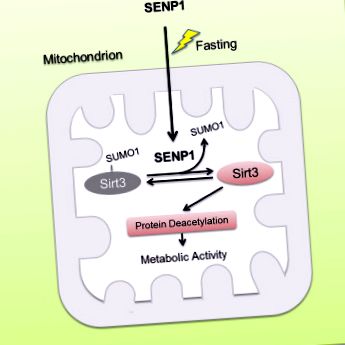
Postul induce translocația SENP1 în mitocondrii în de-SUMOilat Sirt3
Axa SENP1-Sirt3 promovează oxidarea acizilor grași și producerea de energie
Mutația Sirt3 SUMOylation antagonizează obezitatea indusă de HFD prin cheltuieli de energie
rezumat
Sirt3, ca o deacetilază dependentă de nicotinamidă adenină dinucleotidă mitocondrială (NAD), este necesară pentru adaptarea metabolică mitocondrială la diferite stresuri. Cu toate acestea, modul de reglare a activității Sirt3 care răspunde la stresul metabolic rămâne în mare parte necunoscut. Aici, raportăm Sirt3 ca o proteină SUMOilată în mitocondrii. SUMOilarea suprima activitatea catalitică Sirt3. SIR3 cu deficit de SUMOilare prezintă o dezacetilare crescută a proteinelor mitocondriale și o oxidare crescută a acizilor grași. În timpul postului, proteaza SUMO-specifică SENP1 se acumulează în mitocondrii și de-SUMOilează rapid și activează Sirt3. Deficitul de SENP1 are ca rezultat hiper-SUMOilarea Sirt3 și hiper-acetilarea proteinelor mitocondriale, ceea ce reduce adaptarea metabolică mitocondrială care răspunde la post. Mai mult, descoperim că postul induce translocația SENP1 în mitocondrii pentru a activa Sirt3. Studiile efectuate pe șoareci arată că mutația Sirt3 SUMOylation reduce masa grasă și antagonizează obezitatea indusă de dieta bogată în grăsimi (HFD) prin creșterea fosforilării oxidative și a cheltuielilor de energie. Rezultatele noastre arată că semnalizarea SENP1-Sirt3 modulează activarea Sirt3 și metabolismul mitocondrial în timpul stresului metabolic.
Abstract grafic
- Descărcare: Descărcați imaginea de înaltă rezoluție (104 KB)
- Descărcare: Descărcați imaginea la dimensiune completă
Anterior articolul emis Următorul articolul emis
- Enteropatia care pierde proteina - o prezentare generală a subiectelor ScienceDirect
- Rolul complexului mitocondrial IV în obezitatea dependentă de vârstă - ScienceDirect
- Protein kinaza C-beta O conexiune emergentă între excesul de nutrienți și obezitate - ScienceDirect
- Pomparea cu proteine funcționează pentru exerciții fizice și sănătate
- Bare de arahide Nougat Toate bare naturale de proteine VLC anti-subțire; Nashua Nutrition