Tânărul H. Youn
Profesor asociat, Departamentul de Fiziologie și Biofizică, Universitatea din California de Sud, Școala de Medicină Keck, Los Angeles, California, SUA & Academic internațional, Departamentul de Biochimie și Biologie moleculară, Școala de Medicină a Universității Kyung Hee, Seul, Coreea, Universitatea din Sud California Keck School of Medicine
Abstract
Homeostazia extracelulară K + a fost explicată prin mecanisme de feedback în care modificările concentrației extracelulare K + determină excreția renală K + direct sau indirect prin stimularea secreției de aldosteron. Cu toate acestea, acest lucru nu poate explica calureza indusă de masă care apare adesea fără creșterea concentrației plasmatice de K + sau aldosteron. Studii recente au produs dovezi care susțin un control avansat în care detectarea intestinului de K + din dietă crește excreția renală de K + (și absorbția extrarenală de K +) independent de concentrațiile plasmatice de K +, și anume, un „factor intestinal”. Această revizuire se concentrează pe aceste noi descoperiri și discută rolul factorului intestinal în reglarea acută și cronică a K + extracelular, precum și în efectele benefice ale aportului ridicat de K + asupra sistemului cardiovascular.
INTRODUCERE
REGULARE ACUTĂ A POTASIULUI EXTRACELULAR
Provocări în homeostazia K +
În comparație cu alți electroliți majori, K + are un raport mai mare între aportul alimentar și dimensiunea bazinului extracelular (adică, cifra de afaceri), reprezentând o provocare homeostatică semnificativă. Acest lucru se datorează, parțial, unui mic pool extracelular K +; doar 2% din totalul corpului K + este distribuit în ECF și restul predominant în ICF. Prin urmare, o masă bogată în K + ar crește substanțial extracelular [K +] în absența unei reglementări adecvate, provocând un risc de hiperkaliemie. Pentru a face față acestei provocări, sistemul homeostatic K + este foarte eficient la eliminarea plasmei K + în timpul aportului alimentar K +. Rinichii cresc excreția de K + odată cu creșterea aportului de K +. Cu toate acestea, în primele 4-6 ore după o sarcină K + acută, doar jumătate din doza administrată apare în urină, sugerând că țesuturile extrarenale joacă, de asemenea, un rol important în eliminarea unei sarcini extracelulare acute K + (10). Luând în considerare provocările pentru homeostazia K +, este posibil să nu fie întâmplător că insulina, care este secretată de substanțele nutritive ingerate după masă (adică, atunci când K + din dietă este absorbită), promovează absorbția K + de către țesuturile extrarenale și, astfel, previne o creștere excesivă de plasmă [K +].
Controlul de feedback al homeostaziei K +
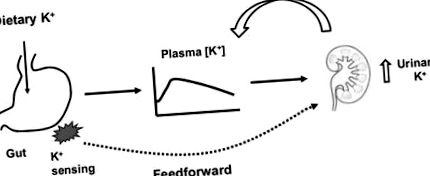
Conform viziunii tradiționale, extracelular [K +] este factorul major în reglarea excreției renale de K + (11, 12). [K +] extracelular crește în timpul aportului alimentar de K +, iar această creștere stimulează excreția renală de K + (Figura 1) prin acțiunea sa directă asupra secreției de K + în canalul colector (11). În plus, creșterea extracelulară [K +] stimulează secreția de aldosteron, stimulând în continuare secreția și excreția renală de K +. Creșterea excreției renale de K + va avea apoi tendința de a restabili extracelular [K +]. În schimb, în timpul restricției K +, scăderea plasmei [K +] scade excreția renală de K +, care va servi apoi la menținerea extracelulară [K +] în intervalul său normal. Astfel, menținerea homeostaziei K + a fost înțeleasă în mod tradițional pe baza conceptului unui control de feedback negativ.
O diagramă schematică care ilustrează feedback vs. controlul avansat al homeostaziei K +.
Controlul avansat al homeostaziei K +
Feedback vs. control de alimentatie
Controlul alimentării înainte în sistemul homeostatic al glucozei
CONTROLUL ALIMENTĂRILOR ÎNAINTE ÎN HOMEOSTAZA POTASIULUI
Controlul avansului de către insulină
Controlul feedforward activat de dieta K +
Studiul lui Lee și colab. (8) au oferit o perspectivă semnificativă asupra reglării acute a homeostaziei K +. În starea de repaus alimentar, perfuzia sistemică de K + a crescut plasma [K +], a crescut excreția renală de K + și, eventual, absorbția celulară a K +. Aceste efecte ale plasmei [K +] ar fi importante pentru a limita creșterea plasmei [K +] în timpul aportului de K + și pentru a normaliza plasma [K +] atunci când consumul de K + încetează (Figura 2). Cu toate acestea, creșterile plasmatice [K +] în timpul perfuziei K + au fost mari (adică 1,3 mM cu o rată de perfuzie de 100 mg/kg/h) în starea de repaus alimentar. În timpul unei mese (de exemplu, aportul K + dietetic), insulina ajută la prevenirea creșterii excesive a plasmei [K +] prin stimularea absorbției celulare extrarenale a K + (1, 28): creșterea plasmei [K +] cu perfuzie sistemică K + în timpul unei mese a fost redus la
0,6 mM, indicând efectele asupra mesei și/sau insulinei. În cele din urmă, când K + a fost administrat intragastric cu o masă, au existat dovezi ale unui factor intestinal care crește în continuare clearance-ul plasmatic al K +, rezultând o creștere nesemnificativă a plasmei [K +].
O figură schematică care ilustrează efectele plasmei [K +] per seinsulină și factorul ipotetic intestinal asupra creșterii plasmei [K +] în timpul aportului de K +.
Sensibilitatea intestinală a K + stimulează calureza după masă
Aportul alimentar K + poate crește excreția renală K + fie prin creșterea plasmei [K +] (vedere tradițională), fie prin activarea unui mecanism independent de plasma [K +], sau prin ambele mecanisme. Oh și colab. (9) au evaluat aceste mecanisme în timpul aportului normal de K + din dietă la șobolani. După un post peste noapte, șobolanii au fost hrăniți cu o cantitate mică (
15% consum zilnic) de dietă care conține fie 0%, fie 1% normal K +, și s-au măsurat excreția plasmatică [K +] și renală K +. Într-un al treilea grup, șobolanii au fost hrăniți cu dieta 0% K + și KCl a fost perfuzat pentru a se potrivi cu profilul plasmatic [K +] cu cel al grupului 1% K +. Hrănirea cu 1% K + a crescut semnificativ excreția renală de K +, asociată cu ușoare creșteri ale plasmei [K +] (
0,2 mM). În grupul cu dietă 0% K + cu infuzie cu KCl, excreția renală de K + a fost semnificativ mai mică decât cea din grupul de 1% K +, în ciuda profilurilor plasmatice [K +] plasmatice. Acest studiu indică faptul că creșterile postprandiale ale excreției renale de K + nu pot fi pe deplin explicate de modificările plasmatice [K +], iar detectarea intestinului K + din dietă a fost o componentă majoră pentru reglarea excreției renale de K +. Nivelurile de aldosteron plasmatic nu au fost modificate nici prin hrănirea mesei, nici prin conținutul de K + din dietă. Astfel, a existat o creștere a excreției renale K + în timpul aportului alimentar K + independent de nivelurile plasmatice de K + sau aldosteron, doi factori care au fost priviți ca regulatori clasici ai excreției renale K +. Aceste descoperiri sunt în concordanță cu conceptul de efecte ale factorului intestinal sau cu un control avansat al homeostaziei extracelulare K +.
MECANISMELE EFECTULUI FACTORULUI
Sunt peptide intestinale implicate?
Mecanismele exacte care stau la baza efectelor factorului intestinal sunt necunoscute. O idee simplă este că intestinul poate crește (sau scădea) secreția unui factor umoral la detectarea K + din dietă pentru a crește excreția renală de K +. Există suficiente dovezi ale interacțiunilor dintre tractul gastro-intestinal și rinichi; există multe peptide și hormoni intestinali eliberați ca răspuns la aportul de substanțe nutritive și ioni care afectează funcțiile renale (29). Studii recente au sugerat o axă intestin-renală în reglarea excreției renale a fosfatului (30, 31). La fel ca K +, fosfatul este un electrolit cu un raport ridicat dintre aportul alimentar și dimensiunea bazinului extracelular (adică o rată mare de rotație). Deși nivelul fosfatului plasmatic nu este la fel de strâns controlat ca [K +] după masă, există dovezi că există o substanță fosfaturică în intestin, care poate fi eliberată pentru a crește excreția de fosfat renal în timpul aportului alimentar de fosfat (30). Astfel, mecanisme analoge pot fi implicate în reglarea celor doi electroliți majori cu o rotație mare (și provocare homeostatică).
Creierul este implicat?
O ipoteză alternativă este că detectarea intestinului a aportului de K + este transmisă creierului, iar creierul reglează manipularea renală și/sau extrarenală a K +. Există dovezi semnificative că creierul este implicat în homeostazia K +, după cum a fost excelent analizat de Rabinowitz (37). Îndepărtarea unui rinichi (adică uninefrectomia) la șobolani anesteziați cauzează
Creșterea de 2 ori a excreției de Na + și K + în rinichiul rămas. O serie de studii elegante realizate de Humphreys și colegii (38-40) au demonstrat că aceste efecte sunt mediate de hormonul de stimulare a γ-melanocitelor (MSH), a cărui secreție din hipofiză este stimulată după uninefrectomie. Îndepărtarea aportului nervos aferent renal a împiedicat creșterea γ-MSH după uninefrectomie (38), ceea ce indică un rol important al unei căi neuronale aferente de la rinichi. Ocluzia ureterală unilaterală, ca și nefrectomia unilaterală, a dus la creșteri mari ale excreției de Na + și K + de către rinichiul contralateral (40). Aceste date sugerează că creierul monitorizează continuu starea excreției renale de Na + și/sau K + 2 și efectuează ajustările corespunzătoare, după caz. În plus, creierul poate monitoriza aportul alimentar de K + (input) și poate face ajustări în excreția renală K + (output) pentru a menține echilibrul K +. Astfel, hipotalamusul poate monitoriza atât intrarea și ieșirea K +, cât și coordona aceste semnale pentru a regla manipularea renală (și/sau extrarenală) a K + prin intermediul hormonilor hipofizari (9). Studiul nostru preliminar (Oh YT, Youn JH; date nepublicate) a arătat că adaptarea K + la aportul de K + modificat a fost afectată la șobolanii hipofizectomizați, în concordanță cu ideea că creierul este implicat în detectarea aportului de K +.
Oh și colab. (9) au examinat dacă nivelurile plasmatice de γ-MSH sunt modificate în timpul aportului alimentar de K +, o condiție prealabilă pentru un mediator al efectelor asupra factorului intestinal, așa cum sa discutat mai sus. Nivelurile plasmatice de γ-MSH (sau γ-MSH) nu au fost modificate nici de o masă, nici de un conținut de K + dietetic, oferind niciun sprijin pentru rolul γ-MSH în efectele factorului intestinal. În acest studiu, peptida MSH studiată a fost γ2-MSH, deoarece a fost măsurată sau administrată în studiile lui Humphreys și colegilor săi. Pe baza secvenței genetice a POMC și a siturilor potențiale de scindare a reziduurilor dibazice, s-au prezis trei peptide MSH (γ1, γ2 și γ3-MSH) (41). Cu toate acestea, acolo unde γ1 și γ3-MSH au fost izolate din celulele pituitare ale rozătoarelor (42, 43), γ2-MSH nu, ceea ce duce la sugestia că γ2-MSH ar putea să nu existe la rozătoare (44). Prin urmare, rolul potențial al γ-MSH ca mediator al efectelor factorului intestinal va trebui explorat în continuare și/sau extins la studii cu γ1- și γ3-MSH. În plus, alte peptide hipofizare pot fi implicate în reglarea excreției renale de K + prin K din dietă + .
Țintele potențiale ale unui factor intestinal la rinichi
Wang și colegii săi au demonstrat că epuizarea K + crește fosforilarea mediată de protein tirozin kinază a ROMK, ceea ce determină retragerea canalelor K + din membrana apicală pentru a reduce secreția și excreția K +, iar aceste efecte sunt mediate de creșteri ale NADPH oxidazei și producția de anioni superoxizi (5, 48). Un studiu recent al acestui grup a demonstrat în continuare că toate aceste modificări au avut loc cu plasmă normală [K +] la șobolani și șoareci menținuți pe o dietă scăzută (0,1%) K + (49). Studiul nostru anterior a arătat, de asemenea, că lipsa modestă de K + crește expresia PTK și fosforilarea ROMK în absența unei scăderi a concentrațiilor plasmatice de K + sau aldosteron (50). Pe de altă parte, consumul unei diete bogate în K + timp de 1-3 zile a scăzut fosforilarea ROMK mediată de PTK (51). Luate împreună, aceste date sugerează că NADPH oxidaza din rinichi poate fi o altă țintă potențială a unui factor intestinal. Dacă acest lucru este adevărat, activitatea NADPH oxidazei și producția de anion superoxid în rinichi ar putea fi modificate acut după masă pentru a explica creșterile rapide ale excreției renale de K +.
Rolul factorului intestinal în adaptarea cronică K +
Adaptare renală K +
Când aportul alimentar K + este crescut sau scăzut, rinichii răspund prin creșterea sau scăderea corespunzătoare a excreției K +, respectiv (11, 52). Această așa-numită „adaptare K +” este critică pentru echilibrul cronic K + și a fost bine recunoscută de câteva decenii. În rinichi, K + este filtrat la nivelul glomerulului, iar sarcina K + filtrată este aproape complet reabsorbită în nefronul proximal. Sub aport normal sau ridicat de K +, K + este secretat în conducta de colectare corticală (CCD), reprezentând majoritatea K + excretat. Sub o dietă scăzută de K +, nu există reabsorbție a K + în CCD. Astfel, secreția de K + în CCD este extrem de adaptabilă la aportul K + din dietă și este locul principal de reglare a excreției de K + (52). Mecanismele moleculare care stau la baza adaptării renale la K + au fost studiate pe larg, după cum a analizat Paul Welling în acest număr al Jurnalului. Astfel, sistemul efector este bine caracterizat, deși semnalul pentru adaptarea renală K + (sau modul în care organismul simte aportul K + din dietă) este neclar (13).
Adaptarea țesuturilor extrarenale la aportul scăzut de K +
Unele țesuturi extrarenale, cum ar fi mușchiul scheletic și ficatul, cresc absorbția K + ca răspuns la insulină (1, 28), constituind un mecanism important al homeostaziei extracelulare K + după masă și aportul K +. Cu câțiva ani în urmă, Choi și colab. a introdus o tehnică nouă pentru cuantificarea acțiunii in vivoinsulinei asupra absorbției celulare a K +, denumită „clema K +” (53, 54). În această metodă, plasma K + este menținută constantă în timpul perfuziei de insulină, variind perfuzia exogenă de K +. Viteza de perfuzie K + necesară pentru prinderea plasmei K + este o măsură a acțiunii insulinei pentru a crește rata de absorbție celulară a K + (54). Folosind această tehnică, am demonstrat la șobolani că absorbția celulară de K + stimulată de insulină, precum excreția renală de K +, este suprimată profund în timpul privării de K + (50, 53, 54), indicând eforturile concertate ale organismului de a conserva K + extracelular. Astfel, adaptarea K + are loc atât în rinichi, cât și în țesuturile extrarenale ca răspuns la modificările aportului de K +.
Un semnal comun pentru adaptările renale și extrarenale?
Interesant este faptul că Choi și colab. a găsit o corelație puternică între gradul de modificare a excreției renale de K + și absorbția extrarenală de K + în timpul privării de K + (54), sugerând un semnal sau factor comun pentru aceste modificări. Chen și colab. a demonstrat că aceste modificări ale manipulării K + renale și extrarenale au avut loc în absența modificărilor concentrației plasmatice de K + sau aldosteron atunci când aportul de K + a fost redus la 1/3 din control (50). Astfel, se pare că organismul a fost capabil să simtă aportul redus de K +, chiar și fără modificări ale extracelularului [K +] și a scăzut tratamentul renal și extrarenal al K + pentru conservarea extracelulară a K +. Aceste date susțin rolul unui factor intestinal în adaptarea K + renală și extrarenală (vezi mai jos).
Factorul intestinal poate explica inducerea rapidă și inversarea unei stări de conservare K +
Modificări ale excreției urinare de K + cu aport modificat de K +. Șobolanii au fost menținuți pe o dietă de control 1,0% K + timp de 3 zile, o dietă modestă restricționată K + (0,33% K +) pentru următoarele 3 zile și, din nou, dieta de control pentru ultimele 3 zile. Animalele erau adăpostite individual și aveau acces gratuit la alimente numai noaptea (18:00 - 06:00). Excreția urinară de K + a fost determinată pentru perioadele absorbante (6 PM - 6 AM, noapte) și postabsorbtive (6 AM - 6 PM, zi). Datele sunt mijloace ± SE (n = 4).
Diagramele schematice care ilustrează o scădere a excreției renale de K + după o lipsă peste noapte de K + (A) sau inversarea sa rapidă după o hrănire peste noapte cu o dietă normală de 1% K + (B). În efectul factorului intestinal Athe (cu 1% K + masă) pentru a spori excreția renală K + din hrănirea anterioară scade în timp, rezultând o scădere profundă a excreției K + după o restricție K + peste noapte (0% K + masă; adică, fără activarea factorului intestinal).
Două faze ale adaptării K +
Majoritatea studiilor anterioare pe animale cu privire la modificările moleculare asociate cu privarea de K + au folosit săptămâni de privare de K + totală. Multe modificări observate în aceste studii pot reprezenta cele rezultate din hipokaliemie, posibil diferite de cele responsabile de adaptările timpurii care apar fără modificări ale plasmei [K +]. Deoarece adaptările K + pot apărea în decurs de o zi de aport modificat de K + și în absența plasmei [K +], este important să se studieze modificările moleculare la rinichi (și țesuturile extrarenale) în condiții normale [K +]. devreme în timpul privării totale de K + sau cu privare parțială de K +. Aceste modificări ar dezvălui mecanisme moleculare implicate în efectele factorului intestinal și ar ajuta la identificarea semnalului pentru aportul K + din dietă.
EFECTE BENEFICIALE ALE POTASIULUI DIETIC
Efectele dietelor ridicate de K + asupra scăderii tensiunii arteriale au fost recunoscute de mult (57, 58). În plus, există suficiente dovezi că aportul alimentar ridicat de K + are efecte benefice asupra accidentului vascular cerebral și a bolilor cardiovasculare (57, 58), dar mecanismele moleculare de bază nu sunt bine înțelese. Tinerii și colegii au propus ipoteza că efectele benefice ale aportului crescut de K + din dietă sunt cauzate de creșterea concentrației extracelulare de K + ([K +]), pe baza observațiilor in vitro că nivelurile ridicate de K + exercită efecte celulare pentru a inhiba formarea radicalilor liberi, proliferarea mușchilor netezi și formarea trombului (58). Cu toate acestea, efectele benefice ale suplimentării cu K + au fost observate în studiile clinice fără o creștere a plasmei [K +] (59). De exemplu, suplimentarea cu potasiu (60 mmoli KCl/70 kg greutate corporală) timp de 3 zile nu a modificat serul [K +], dar a redus semnificativ reactivitatea trombocitelor la bărbați și femei sănătoși, oferind o legătură potențială între aportul de K + și accident vascular cerebral ocluziv). Într-un alt studiu, creșterea potasiului alimentar (30 mmoli pe zi) a scăzut semnificativ tensiunea arterială la voluntarii normotensivi fără a modifica plasma [K +] (61). Aceste constatări sugerează că efectele benefice ale aportului alimentar de K + pot fi mediate de un mecanism independent de plasmă [K +] (62).
Mulțumiri
Note de subsol
Declinarea responsabilității editorului: Acesta este un fișier PDF al unui manuscris neditat care a fost acceptat spre publicare. Ca serviciu pentru clienții noștri, oferim această versiune timpurie a manuscrisului. Manuscrisul va fi supus copierii, compunerii și revizuirii dovezilor rezultate înainte de a fi publicat în forma sa finală citabilă. Vă rugăm să rețineți că, în timpul procesului de producție, pot fi descoperite erori care ar putea afecta conținutul și că toate responsabilitățile legale care se aplică jurnalului se referă.
1 Termenul „factor intestinal” este utilizat în acest articol pentru a se referi în general la un mecanism activat prin detectarea intestinului a aportului de K + care îmbunătățește excreția renală de K + și absorbția extrarenală de K +, independent de plasmă [K +]. Natura exactă a acestui mecanism este în prezent necunoscută; factorul poate implica reglarea neuronală, nu neapărat umorală, așa cum ar putea indica numele.
2 Studiile lui Humphreys și ale colegilor s-au concentrat în mare parte pe rolul γ-MSH în reglarea excreției de Na + și, prin urmare, rolul γ-MSH în reglarea excreției K + este mai puțin clar.
- Mănâncă banane în fiecare zi pentru bărbații care consumă potasiu; s Health Magazine Australia
- Consiliere dietetică sau supliment de potasiu pentru creșterea aportului de potasiu la pacienții cu sânge ridicat
- Consumul de potasiu în aportul zilnic al sarcinii, interval normal; Efecte
- Aport zilnic de calorii Câte calorii ar trebui să mănânc pentru a slăbi
- Frontiere Rolul diversității dietei și al indicilor dietei asupra rezultatelor alergiilor Pediatrie