Bo-mi Song
1 Departamentul de biologie moleculară, Universitatea din Texas Southwestern Medical Center, Dallas, Texas 75390-9148 și
Leon Avery
2 Departamentul de Fiziologie și Biofizică, Virginia Commonwealth University, Richmond, Virginia 23298-0551
Contribuțiile autorului: B.-m.S. cercetare proiectată; B.-m.S. cercetări efectuate; LA. a contribuit cu reactivi/instrumente analitice nepublicate; B.-m.S. și L.A. date analizate; B.-m.S. și L.A. a scris ziarul.
Abstract
Introducere
Epidemia crescândă de obezitate și tulburări de alimentație necesită studiul mecanismelor de reglare a aportului alimentar. Aportul de alimente este reglementat de diverse intrări de mediu și interne, cum ar fi factorii senzoriali, starea nutrițională, procesarea emoțională, luarea deciziilor și învățarea (Berthoud, 2004; Zheng și Berthoud, 2008). Studierea mutanților al căror aport alimentar este modificat în diferite condiții a avansat mult înțelegerea mecanismelor de reglare (Barsh și Schwartz, 2002).
Caenorhabditis elegans, viermele rotund consumator de bacterii, este un organism model atractiv pentru studierea reglării aportului alimentar. Manipularea genetică este ușoară, iar anatomia este simplă (Schafer, 2005). Comportamentele de hrănire la C. elegans au fost bine caracterizate și sunt supuse analizei cantitative. Mai mult, moleculele care controlează consumul de alimente sunt, de asemenea, cel puțin parțial conservate în C. elegans (Douglas și colab., 2005; Tu și colab., 2008; Kaun și Sokolowski, 2009).
Faringele, un tub neuromuscular, este organul de hrănire din C. elegans. Faringele este format din opt mușchi și 20 de neuroni de 14 tipuri. Cei cinci mușchi faringieni mari sunt conectați prin joncțiuni gap și constituie cele trei părți funcționale ale faringelui, corpusului, istmului și bulbului terminal, care sunt dispuse de la anterior la posterior (vezi Fig. 5) (Albertson și Thomson, 1976) . Corpusul preia alimentele din mediu și acumulează alimentele în istmul anterior prin contracția și relaxarea ulterioară. Hrana acumulată este transportată la becul terminal printr-o mișcare peristaltică a istmului posterior. Râșnița din becul terminal zdrobește alimentele pentru absorbția nutrienților în intestin. Mușchii faringelui prezintă două mișcări de hrănire, pompare și peristaltism de istm (IP). Pomparea este o contracție sincronizată și relaxare ulterioară a corpusului, a istmului anterior și a bulbului terminal (vezi Fig. 5 A). Peristaltismul istmului este o mișcare peristaltică a istmului posterior (vezi Fig. 5 B).
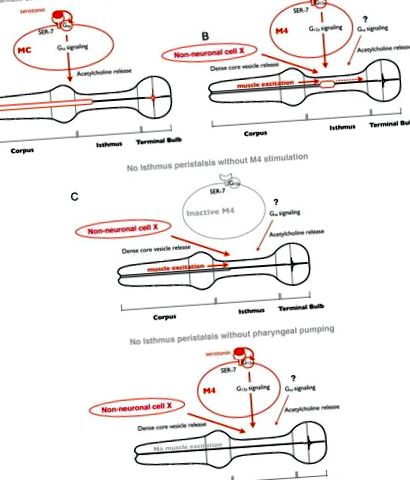
Model de reglare a hranei cu serotonina. A, Ca răspuns la serotonină, SER-7 din celula MC își activează autonom calea de semnalizare Gsα în aval, care ulterior stimulează pomparea faringiană prin activarea transmisiei colinergice de la MC la mușchii faringieni. B, Ca răspuns la serotonină, SER-7 în M4 (și eventual în M2) își activează căile G12α în aval într-o manieră autonomă celulară, care ulterior activează M4. Stimulul de la M4 activ, alături de eliberarea veziculelor dense cu miez controlat de o cale neidentificată, activează peristaltismul istmului. Calea de semnalizare Gsα și transmisia colinergică în aval contribuie, de asemenea, la activarea peristaltismului istmului, dar locurile lor de acțiune nu au fost caracterizate. Având în vedere că expresia SER-7 în M4 rata de peristaltism a istmului complet restaurată în mutantul ser-7 nul, este plauzibil ca eliberarea veziculelor dense de miez din celulele neidentificate să fie activă în mod constitutiv, mai degrabă decât declanșată de serotonină. C, Stimulii de la un neuron activ M4 și de la partea anterioară a faringelui, excitați prin pompare, sunt necesari pentru a activa peristaltismul istmului. În absența oricărui stimul, peristaltismul istmului nu apare.
Ca și alte animale, C. elegans activează aportul de alimente prin activarea mișcărilor de hrănire ca răspuns la hrană (bacterii) (Croll, 1978). Dintre cele 14 tipuri de neuroni faringieni, doar MC și M4 sunt esențiale pentru pomparea rapidă normală și, respectiv, pentru peristaltismul istmului (Avery și Horvitz, 1987, 1989). Cu toate acestea, mecanismele prin care neuronii faringieni activează hrănirea ca răspuns la bacterii sunt necunoscute. Aici, am încercat să înțelegem mecanismele prin studierea procesului prin care serotonina activează hrănirea, din următoarele motive: În primul rând, serotonina este un semnal alimentar supus care controlează hrănirea în C. elegans. Serotonina imită efectele alimentelor în controlul comportamentelor multiple, inclusiv activarea pompării faringiene (PP) (Horvitz și colab., 1982). Serotonina crește pomparea faringiană ca răspuns la bacterii (Sze și colab., 2000). În al doilea rând, serotonina activează pomparea printr-un receptor SER-7 de tip 5-HT de tip 7, care este exprimat în mai mulți neuroni faringieni, inclusiv MC și M4 (Hobson și colab., 2006). De fapt, pentru a activa pomparea, serotonina necesită transmiterea colinergică de la MC la mușchii faringieni (Raizen și colab., 1995). Mai mult, expresia SER-7 în M4 crește posibilitatea ca serotonina să activeze și peristaltismul istmului.
Materiale și metode
Metode generale și tulpini
Cu excepția cazului în care se specifică altfel, C. elegans a fost cultivat la 19 ° C așa cum este descris de Brenner (1974). Toți viermii folosiți erau hermafroditi. Numai în textul principal este afișat numele genei. Au fost utilizate următoarele alele mutante.
Mutații nule.
Mutațiile nule au fost după cum urmează: mod-1 (ok103) V, ser-4 (ok512) I, ser-1 (ok512) III, ser-7 (tm1325) X, eat-2 (ad465) II, gsa-1 pk75 ) I, acy-1 (pk1279) III, gpa-12 (pk322) X, dgk-1 (sy428) X, pkc-1 (nj3) V, unc-13 (s69), unc-31 (e928), tph -1 (mg280).
Mutații hipomorfe.
Mutațiile hipomorfe au fost după cum urmează: kin-2 (ce179) X, cha-1 (p1152) IV.
Mutații de câștig de funcție.
Mutațiile câștigului funcției au fost următoarele: gsa-1 (ce81gf) I, acy-1 (ce2gf) III, HS: gsa-1 (Q227L), punc-17: gpa-12 (Q205L), punc- 17: rho-1 (G14V), punc-17: pkc-1B (A160E).
Tratamentul medicamentos și testul de hrănire
Analiza hrănirii bacteriilor
Biologia moleculară și construcția tulpinilor transgenice
Analiza video și testarea statistică
Testarea efectelor asupra peristaltismului istmului este complicată de faptul că majoritatea tratamentelor care afectează peristaltismul istmului afectează și pomparea, iar peristaltismul istmului depinde neliniar de pompare. Prin urmare, pentru a compara ratele de peristaltism de istm în două seturi de date, am cerut ca ratele de pompare din acele seturi de date să se suprapună și apoi am întrebat dacă peristaltismul de istm diferă între seturile de date la aceeași rată de pompare. La a doua întrebare s-a răspuns prin potrivirea parabolelor la date. Ambele seturi de date s-au potrivit simultan cu următorul model:
xi și yi sunt rate de pompare și peristaltism de istm pentru viermele i, Di este o variabilă indicator (fictivă) care este 0 dacă viermele i se află în setul de date 1 și 1 dacă viermele i se află în setul de date 2 și a, b, c și d sunt parametrii de montaj. Dacă peristaltismul de istm diferă între cele două seturi de date, (c, d) va diferi de (0, 0). Acest lucru a fost testat calculând statistica F după cum urmează:
unde c, d sunt estimările celor mai mici pătrate ale lui c și d; σc, σd și ρ sunt estimări ale SE ale lui c, SE ale lui d și ale corelației dintre c și d din regresia liniară; și n1, n2 sunt numerele de puncte din seturile de date 1 și 2.
Nivelul de semnificație este probabilitatea cozii superioare a unei distribuții F standard cu 2 și n1 + n2 - 2 df. [Deoarece c și d sunt pătrate în calculul F, orice abatere de la (0, 0) dă un F pozitiv, deci acesta este un test cu o singură coadă.]
Prezentarea datelor
Rezultate
Peristaltismul de istm este cuplat cu pompa faringiană precedentă
Receptorul serotoninei SER-7 activează separat cele două mișcări de hrănire, în principal prin activarea neuronilor faringieni MC și M4
Am întrebat care receptor mediază efectul serotoninei examinând ratele de hrănire a mutanților nuli ai receptorului serotoninei ca răspuns la serotonină. Dintre cei cinci mutanți nuli ai receptorului serotoninei, doar mutantul ser-7 nu a reușit să pompeze rapid în prezența serotoninei (Fig. 1 G; date neprezentate; t (197) = 8,4, p Fig. 1 G) și cealaltă serotonină mutanți ai receptorilor. au avut puține sau deloc modificări ale ratei de peristaltism a istmului ca răspuns la serotonină (datele nu sunt prezentate). Pentru a afla dacă SER-7 afectează peristaltismul istmului, am comparat gsa-1 (gf) și gsa-1 (gf); ser-7 animale mutante. gsa-1 codifică Gsα. Mutația câștigului funcției gsa-1 a fost suficientă pentru a activa pomparea, chiar și în absența SER-7 (Fig. 1 H, 2 2 B). Deși gsa-1 (gf) și gsa-1 (gf); ser-7 pompat la aceeași rată în prezența serotoninei, rata peristaltismului istmului a fost mai mică în gsa-1 (gf); ser-7 decât în gsa-1 (gf) (Fig. 1 H; F (2,49) = 10,7, p = 0,0001). Aceste rezultate sugerează că semnalizarea serotoninei prin SER-7 activează ambele mișcări de hrănire și că serotonina activează peristaltismul istmului separat de pomparea faringiană.
Celula SER-7 activează autonom pomparea faringiană prin semnalizarea Gsα
SER-7 este un receptor de serotonină de tip 7 (5-HT7). Receptorul 5-HT7 este un receptor cuplat cu proteina G care se crede că este cuplat la Gsα și G12α (Kvachnina și colab., 2005). În favoarea ipotezei că semnalizarea Gsα este în aval de SER-7, expresia heterologă a ADNc-ser-7 a crescut nivelul de cAMP intracelular (Hobson și colab., 2003), o indicație a semnalizării Gsα active. Astfel, am emis ipoteza că SER-7 activ în MC și M4 crește ratele de hrănire prin activarea căilor de semnalizare Gsα și G12α.
Am testat apoi dacă semnalizarea G12α activează peristaltismul istmului prin calea raportată anterior (Fig. 3 A). Hiley și colab. (2006) și McMullan și colab. (2006) au raportat că un rol al RHO-1 este de a activa neurotransmisia în aval de G12α prin legarea directă și inhibarea DGK-1 în C. elegans (Hiley și colab., 2006; McMullan și colab., 2006). Am testat dacă RHO-1 crește peristaltismul istmului prin același mecanism testând dacă F25N, o mutație a RHO-1 care perturbă domeniul esențial pentru inhibarea DGK-1, blochează creșterea indusă de G14V (o mutație constitutivă activă) a peristaltismului istmului rată. Într-adevăr, punc-17: RHO-1 (G14VF25N) nu a reușit să crească peristaltismul istmului (Fig. 3 C). Mai mult, mutația nulă dgk-1 a restabilit rata de peristaltism a istmului transgenicelor care exprimă punc-17: RHO-1 (G14VF25N) la rata transgenicilor care exprimă punc-17: RHO-1 (G14V) (Fig. 3 G; ratele de peristaltism ale istmului [punc-17: RHO-1 (G14V)] și dgk-1; [punc-17: RHO-1 (G14VF25N)] animale transgenice au fost de 37,8 ± 2,0 și 41,4 ± 3,5, respectiv), sugerând că RHO-1 activează peristaltismul istmului prin inhibarea DGK-1.
În cele din urmă, am testat dacă SER-7 în M4 activează peristaltismul istmului activând semnalizarea G12α într-o manieră autonomă celulară. Pentru aceasta, am întrebat dacă expresia GPA-12 sau RHO-1 activă constitutiv în M4 restabilește peristaltismul istmului stimulat de serotonină în gsa-1 (gf); ser-7 (tm1325) animale mutante. În sprijinul ipotezei noastre, expresia transgenelor a restabilit cel puțin parțial ratele de peristaltism ale istmului (Fig. 3 H; F (2,21) = 6,3, p = 0,007) (Fig. 3 I; F (2,27) = 8.7, p = 0.001) (comparația ratelor de peristaltism a istmului între gsa-1 (gf); control ser-7 și gsa-1 (gf); ser-7; [pser-7b: rho-1 (G14V)] viermi mutanți). Împreună, aceste date susțin ipoteza că SER-7 în M4 activează rata peristaltismului istmului prin activarea căii de semnalizare G12α într-o manieră autonomă celulară.
Calea de semnalizare Gsα activează pomparea prin transmisie colinergică de la MC la mușchii faringieni
Discuţie
Descoperirea noastră că serotonina activează MC și M4 prin mecanisme care implică căile de semnalizare Gsα și G12α, împreună cu studii anterioare (Reynolds și colab., 2005; McMullan și colab., 2006), sugerează că mecanismul prin care căile de semnalizare ale proteinelor G cresc neuronal activitatea este conservată pe scară largă în tot sistemul nervos la C. elegans.
De asemenea, am constatat că, în ciuda reglării neuronale separate, peristaltismul istmului a fost cuplat cu pompa precedentă. Cum sunt cuplate cele două mișcări de hrănire? Un studiu anterior de imagistică cu calciu a raportat că o undă de calciu anterioară-posterioară se deplasează selectiv în istmul posterior în timpul peristaltismului istmului (Shimozono și colab., 2004), sugerând că unda de calciu dictează contracția musculară. Când apare o pompă, semnalul electric care excită mușchii faringieni pentru a provoca pomparea se deplasează de la corp la becul terminal (Raizen și Avery, 1994; Shimozono și colab., 2004). Observațiile că uciderea M4 are ca rezultat eșecul peristaltismului istmului (Avery și Horvitz, 1987) și că peristaltismul necesită pompare sugerează că inducerea undei de calciu care provoacă peristaltism necesită atât excitație musculară în timpul pompării, cât și stimularea de către M4 (Fig. 5 B, C ). Acest model explică modul în care mișcările de alimentare pot fi reglate separat, dar cuplate.
Este posibil ca faringele să fi evoluat pentru a regla mișcările de hrănire în acest mod pentru a susține hrănirea eficientă. Reglarea separată a celor două rate de hrănire permite viermilor să ajusteze raportul dintre peristaltismul istmului și pomparea faringiană (raportul IP-PP) în funcție de densitatea alimentelor. Când alimentele sunt rare, raportul IP-PP ar scădea deoarece viermii trebuie să ia alimente cât mai activ posibil, dar nu trebuie să înghită frecvent. Cu toate acestea, atunci când alimentele sunt abundente, raportul ar crește, deoarece viermii nu trebuie să lucreze atât de mult pentru a lua alimente, dar trebuie să înghită frecvent, astfel încât faringele anterior să nu se umple. De fapt, am observat că raportul mediu IP-PP tinde să fie mai mare atunci când faringele pompează lent (Fig. 1 D). Mai mult, regulatorii de hrănire pe care i-am găsit pot fi clasificați în două grupuri: primul grup, cum ar fi componentele căilor de semnalizare Gsα sau dgk-1, crește ambele rate de hrănire atunci când sunt activate sau inhibate. Al doilea grup, cum ar fi gpa-12 (Fig. 3 E, F), pkc-1 (datele nu sunt prezentate) și unc-31 (Fig. 4 F), a scăzut peristaltismul istmului, dar a crescut pomparea faringiană atunci când este suprimată. Pentru a ajusta raportul IP-PP în funcție de densitatea alimentelor, activitatea celui de-al doilea grup poate fi suprimată selectiv atunci când alimentele sunt puține.
Cuplarea celor două mișcări de hrănire susține, de asemenea, hrănirea eficientă prin coordonarea acestora. Alimentele acumulate prin pompare sunt transportate de la istmul anterior la polizor în becul terminal prin peristaltismul istmului. Astfel, peristaltismul istmului ar fi inutil în absența pompării, iar cuplarea peristaltismului istmului la pompa precedentă poate servi pentru a preveni astfel de mișcări inutile de alimentare.
Câteva întrebări interesante rămân de răspuns. De exemplu, prin ce mecanisme sunt determinate frecvența și momentul apariției mișcărilor de hrănire? Cum arată un singur mușchi de istm două mișcări de hrănire diferite? Studii suplimentare pentru a răspunde la aceste întrebări ne pot determina să înțelegem modul în care sistemul nervos și mușchii interacționează pentru o reglare sofisticată a mișcărilor musculare.
- Suplimente nutriționale pentru îmbunătățirea stării generale de sănătate și a performanțelor aerobice
- Creșterea bebelușilor gemeni Hrănirea, dormitul și multe altele
- Creșterea rapidă în greutate și practicile de hrănire în primele 6 luni de viață sunt asociate cu disbioză
- Cardurile de costare a rețetelor mențin costurile de restaurant și de catering separate
- Noul ghid de supraviețuire a pisicii Sfaturi de hrănire PetCoach