Abstract
Anaplasma phagocytophilum invadează neutrofilele pentru a provoca infecția emergentă, anaplasmoza granulocitară umană. Aici, oferim o revizuire focalizată a interacțiunilor dintre receptorii invasin-celulă gazdă A. phagocytophilum care promovează intrarea bacteriană și căile de degradare și de membrană pe care organismul le exploatează pentru a direcționa nutrienții către organitul în care se află. Deoarece natura sa intracelulară obligatorie împiedică abordările complementare knock out, discutăm și metodele actuale utilizate pentru a studia funcția genei A. phagocytophilum și beneficiul potențial al aplicării unor instrumente noi care au studii avansate ale altor agenți patogeni bacterieni intracelulari obligați.
INTRODUCERE
Natura intracelulară obligatorie a lui A. phagocytophilum este bazată pe necesitatea sa de a parazita substanțele nutritive ale celulelor gazdă. După invazie, bacteria se află într-o vacuolă derivată din celula gazdă care o remodelează într-o nișă de protecție [1]. Traficul cu membrană este redirecționat către vacuolul ocupat de A. phagocytophilum (ApV) pentru a furniza substanțe nutritive vitale și materialul membranei celulei gazdă. Această revizuire descrie înțelegerea noastră actuală a evenimentelor moleculare implicate în invazia celulară a A. phagocytophilum și parazitismul molecular. De asemenea, discutăm provocările studierii organismului și încheiem cu un studiu al progreselor recente în manipularea genetică a altor bacterii intracelulare obligatorii și a aplicațiilor potențiale ale acestora pentru studierea A. phagocytophilum.
DEBLOCAREA UȘILOR: A. phagocytophilum invazie celulară
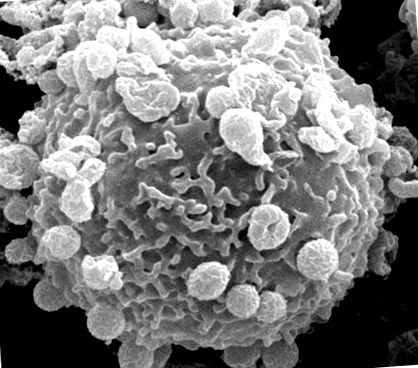
A. phagocytophilum trebuie să se atașeze și să intre în celulele gazdă pentru a supraviețui (Figura 1). Acest proces este facilitat de mai multe adezine bacteriene/invazine care recunosc cooperativ receptorii celulei gazdă și inițiază cascade de semnalizare pentru a promova internalizarea agentului patogen.
Micrografie electronică de scanare a unui neutrofil uman cu numeroase bacterii A. phagocytophilum atașate la suprafața celulei gazdă.
Receptorii celulelor gazdă
Aderența și invazia A. phagocytophilum apar și prin căi independente de PSGL-1 care implică integrină β2 și plute lipidice. Diferențele în legarea receptorilor apar atunci când interacțiunile A. phagocytophilum-neutrofile sunt examinate în condiții de flux de forfecare similare cu cele dintr-un vas de sânge [12]. În timp ce agentul patogen angajează numai PSGL-1 în condiții statice [5, 6, 13], leagă atât PSGL-1, cât și integrina β2 sub flux [12]. Plutele lipidice sunt importante platforme de semnalizare și conțin cantități îmbogățite de proteine ancorate în glicofosfatidilinozitol (GPI) și caveolin-1. Proteinele ancorate GPI sunt necesare pentru infecție, iar caveolin-1 se colocalizează cu vacuolele precoce ale A. phagocytophilum, sugerând că bacteria pătrunde în celulele gazdă la plute lipidice [14]. PSGL-1 se găsește în plute lipidice, iar mobilizarea integrinei β2 în plute lipidice a fost legată de patogeneza bacteriană [15, 16]. Cultivarea prelungită a liniilor celulare defecte de α1,3-fucosiltransferază și sialiltransferază selectează pentru organismele A. phagocytophilum care nu se mai bazează pe sLe x, PSGL-1 sau Syk pentru intrare [13, 17, 18]. Nu se cunoaște dacă această subpopulație îmbogățită constă din variante fenotipice sau genotipice care vizează integrina β2, plute lipidice sau alți receptori.
A. proteine de suprafață phagocytophilum implicate în infecție
Asp55, Asp62 și APH1235 sunt alte proteine A. phagocytophilum implicate în adeziune și invazie. Anticorpii specifici pentru Asp55 și Asp62 inhibă semnificativ infecția cu A. phagocytophilum a celulelor gazdă [21]. Deoarece receptorii Asp55 și Asp62 sunt nedefiniți, este dificil de interpretat dacă această inhibiție este specifică. APH1235 este indus în timpul hrănirii prin transmisie a căpușelor infectate și atunci când bacteriile RC neinfecțioase se transformă în forma DC infecțioasă. Rapoartele sunt contradictorii cu privire la faptul că APH1235 este expus pe suprafața bacteriană [22, 23]. Cu toate acestea, propagarea A. phagocytophilum în cultura celulară HL-60 în prezența anticorpului APH1235 reduce semnificativ încărcătura bacteriană [22].
SERVICIUL CAMEREI DE COMANDĂ: A. phagocytophilum direcționează selectiv căile degradante și de trafic de membrană către vacuola sa
Virulența nutrițională, inventată de Abu Kwaik și Bumann înseamnă că, „fără resurse nutriționale adecvate pentru supraviețuire/proliferare în gazdă, agenții patogeni bacterieni nu cauzează boli [32]”. A. phagocytophilum este auxotrofic pentru 16 aminoacizi și necesită colesterol pentru supraviețuirea intracelulară [33-36]. Nu trebuie doar să paraziteze aceste substanțe nutritive esențiale, ci și să le direcționeze către organitul său. O serie de descoperiri cheie recente au fugit pentru a ilumina strategiile de virulență nutrițională A. phagocytophilum.
Exploatarea autofagiei
Autofagia este un proces de homeostazie celulară eucariotă care digeră obiecte intracelulare nedorite, inclusiv organite deteriorate. De asemenea, vizează agenții patogeni intracelulari și, prin urmare, este un braț important al răspunsului imun înnăscut. Formarea autofagozomilor este controlată de asamblarea secvențială a proteinelor legate de autofagie (ATG) și este inițiată prin formarea unui complex care include ATG14 și BECN1 (Beclin 1) [37]. Complexul promovează formarea unei structuri numite omegasom, din care se formează fagoforul pentru a se alungi și închide conținuturi citoplasmatice cu ajutorul unei perechi de sisteme de conjugare asemănătoare ubiquitinei, dintre care unul include proteina, LC3 [37, 38].
Dovezi recente sugerează implicarea proteinelor mono- și poliubiquitinate în autofagie [41, 42]. Corpurile de incluziune care sunt prea mari pentru degradare în proteazomul 26S sunt ținte pentru autofagia selectivă și conțin proteine polubiquitinate și LC3 [42]. În plus, s-a dovedit că etichetarea bacteriilor intravacuolare cu monoubiquitină vizează bacteriile spre distrugere în autofagozom [41], deși unele bacterii precum Salmonella enterica subversează acest proces [43]. Interesant este faptul că, în timp ce ApV este decorat cu LC3, acesta nu este decorat cu proteine poliubiquitinate. Mai degrabă, ApV se colorează pozitiv pentru monoubiquitin la mamifere și, într-o măsură mai mică, celule gazdă de căpușe. Sinteza proteinelor bacteriene de novo este importantă pentru asocierea continuă a monoubiquitinei cu ApV, sugerând că acesta este un proces mediat bacterian [44]. Proteinele monoubiquitinate joacă diverse alte roluri în celulă, inclusiv dirijarea traficului endocitar [45]. Astfel, dacă Ap folosește proteine monoubiquitinate specific pentru a ajuta la fuziunea autofagozomului rămâne necunoscut.
Achiziționarea colesterolului
Genomul A. phagocytophilum nu conține nicio genă pentru sinteza lipidei A sau completul complet necesar pentru sinteza peptidoglicanului [33, 34]. Ca atare, bacteria își stabilizează membrana exterioară prin încorporarea colesterolului. Lipsa genelor legate de sinteza sau modificarea colesterolului îl obligă să deturneze colesterolul de la gazda sa de mamifere [34]. Într-adevăr, colesterolul exogen este preluat de bacterie [34], sinteza colesterolului endogen este reglată în sus în celulele infectate, iar colesterolul liber (neesterificat) este îmbogățit în vacuolul ocupat de A. phagocytophilum (ApV) [35]. Atât extracția colesterolului din membranele bacteriilor fără celule gazdă cu metil-β-ciclodextrină (MβCD), cât și adăugarea derivatului de colesterol structural, dar slab funcțional, colesterolul NBD, reduc semnificativ infecțiozitatea [34], sugerând că și colesterolul este important pentru virulența A. phagocytophilum.
Dependența de A. phagocytophilum de colesterol indică faptul că pacienții cu hipercolesterolemie pot prezenta o infecție mai severă [48]. Într-adevăr, o dietă bogată în colesterol facilitează creșterea infecției șoarecilor cu deficit de apolipoproteină E (apoE -/-) [49]. HGA este mai frecvent asociată cu persoanele în vârstă, spre deosebire de vârsta mediană a persoanelor infectate cu alți agenți patogeni transmisă de căpușe. Persoanele mai în vârstă au în general un sistem imunitar slăbit și niveluri ridicate de colesterol din sânge. Astfel, dependența de colesterol de A. phagocytophilum poate explica cel puțin parțial creșterea vârstei medii. S-a speculat că terapeutica care vizează scăderea nivelului de colesterol din plasmă ar putea ajuta la controlul HGA la această populație [35, 48, 49].
Direcționarea selectivă a GTPazelor Rab
GTPazele Rab sunt regulatori principali ai dinamicii membranei pe organite. Familia Rab este formată din aproape 70 de membri, fiecare dintre aceștia fiind implicați în controlul unei etape definite de transport vezicular [50, 51]. A. phagocytophilum vizează selectiv un subset de GTPaze Rab către vacuolul său [52]. Acest lucru oferă un mijloc de camuflaj molecular și probabil contribuie la satisfacerea bacteriei cerințelor sale nutriționale intracelulare obligatorii pentru aminoacizi și colesterol. De asemenea, este posibil să furnizeze un aport continuu de material al membranei gazdă pentru a permite extinderea membranei vacuolare astfel încât să poată găzdui populația bacteriană intravacuolară în creștere. Rab1, Rab4A, Rab10, Rab11A, Rab14, Rab22A și Rab35 se localizează în ApV [52] (Tabelul 1). Aceste Rabs direcționează traficul vezicular asociat cu reciclarea endocitică dependentă de clatrin (Rab4A, Rab35) [53], reciclarea endocitică independentă de clatrin (Rab10, Rab11A, Rab14, Rab22A) [51, 53], reticulul endoplasmatic (ER; Rab1, Rab10 )) (54] și rețeaua trans-Golgi (TGN; Rab10, Rab11A, Rab14, Rab22A) [50, 51, 53]. Acest fenomen este determinat de sinteza de proteine bacteriene și este esențial pentru ca ApV să se sustragă fuziunii lizozomale [52].
tabelul 1
Rab GTPaze care sunt recrutați în vacuola ocupată de A. phagocytophilum
- 5 alimente pe care le prepar în oala instantanee în ziua de pregătire a mesei pentru a mânca sănătos și a pierde în greutate - Organizați
- 5 Idei de mâncare sănătoasă pentru prăjituri de orez Luci; cu bucatele
- Cele mai bune 10 idei de cină pentru o masă delicioasă - NDTV Food
- 1.200 de calorii pe zi pentru un plan de masă pentru femei Diabet Marea Britanie
- Cel mai bun și mai ieftin serviciu de livrare a meselor ieftin, dar totuși gustos