Ecole Polytechnique Fédérale de Lausanne (EPFL), ISREC - Institutul elvețian pentru cercetarea experimentală a cancerului, Lausanne, Elveția
Acești autori au contribuit în mod egal la această lucrare.
Ecole Polytechnique Fédérale de Lausanne (EPFL), ISREC - Institutul elvețian pentru cercetarea experimentală a cancerului, Lausanne, Elveția
Acești autori au contribuit în mod egal la această lucrare.
Ecole Polytechnique Fédérale de Lausanne (EPFL), ISREC - Institutul elvețian pentru cercetarea experimentală a cancerului, Lausanne, Elveția
Ecole Polytechnique Fédérale de Lausanne (EPFL), ISREC - Institutul Elvețian pentru Cercetarea Experimentală a Cancerului, Facilitatea Transgenică a Șoarecilor, Lausanne, Elveția
Ecole Polytechnique Fédérale de Lausanne (EPFL), ISREC - Institutul Elvețian pentru Cercetarea Experimentală a Cancerului, Lausanne, Elveția
Ecole Polytechnique Fédérale de Lausanne (EPFL) ISREC - Swiss Institute for Experimental Cancer Research, SV2516 - Bâtiment SV, Station 19, CH - 1015 Lausanne, Switzerland === Căutați mai multe lucrări ale acestui autor
Ecole Polytechnique Fédérale de Lausanne (EPFL), ISREC - Institutul elvețian pentru cercetarea experimentală a cancerului, Lausanne, Elveția
Acești autori au contribuit în mod egal la această lucrare.
Ecole Polytechnique Fédérale de Lausanne (EPFL), ISREC - Institutul elvețian pentru cercetarea experimentală a cancerului, Lausanne, Elveția
Acești autori au contribuit în mod egal la această lucrare.
Ecole Polytechnique Fédérale de Lausanne (EPFL), ISREC - Institutul elvețian pentru cercetarea experimentală a cancerului, Lausanne, Elveția
Ecole Polytechnique Fédérale de Lausanne (EPFL), ISREC - Institutul Elvețian pentru Cercetarea Experimentală a Cancerului, Facilitatea Transgenică a Șoarecilor, Lausanne, Elveția
Ecole Polytechnique Fédérale de Lausanne (EPFL), ISREC - Institutul elvețian pentru cercetarea experimentală a cancerului, Lausanne, Elveția
Ecole Polytechnique Fédérale de Lausanne (EPFL) ISREC - Swiss Institute for Experimental Cancer Research, SV2516 - Bâtiment SV, Station 19, CH - 1015 Lausanne, Switzerland === Căutați mai multe lucrări ale acestui autor
Potențialul conflict de interese: Nimic de raportat.
Abstract
Cojile de proteine de 24 de subunități de feritină H și L pot acumula până la 4500 de atomi de fier ca Fe 3+ în toate țesuturile, dar cel mai proeminent în hepatocite și celule reticuloendoteliale ale ficatului și splinei. 1 Subunitatea feritinei H are o activitate feroxidază necesară pentru depunerea fierului. 2, 3 Traducerea ambelor subunități este reglementată de proteinele de reglare a fierului 1 și 2 (IRP1 și IRP2) ca răspuns la disponibilitatea fierului. 4 Astfel, cantitatea de feritină se adaptează la nivelurile de fier ale corpului. Fierul depozitat în feritină poate fi mobilizat înainte de degradarea feritinei. Funcția de scurgere a fierului feritinei este, de asemenea, considerată a preveni cataliza mediată de fier a speciilor reactive de oxigen (ROS), care provoacă leziuni tisulare 6 și pot cauza cancer 7 și neurodegenerare. 8
Aici, am generat șoareci care transportă site-uri loxP 5 ′ din A cincea promotor de gene și 3 'de exon 1 pentru a șterge expresia feritinei H la șoareci adulți prin cre recombinază. Am șters condiționat fișierul A cincea genă la șoareci masculi adulți care utilizează Cre sub controlul promotorului genei Mx inductibil poli - IC. 23 Aceasta elimină feritina H aproape complet în ficat, măduvă osoasă, splină și timus, dar mai puțin vizibil în alte țesuturi. Raportăm aici efectele asupra depozitării fierului, toxicitatea fierului, parametrii hematologici și viabilitatea celulară. Am explorat efectele supraîncărcării cu fier înainte sau după ștergerea feritinei H și am constatat moartea rapidă a celulelor în ficat și în fibroblastele embrionare de șoarece derivate de la șoarecii noștri. În celulele cultivate, cauza morții ar putea fi atribuită ROS, depolarizarea mitocondrială și tranziția permeabilității.
Abrevieri
ALT, alanină aminotransferază; AST, aspartat aminotransferază; A cincea genă, gena feritinei H; IRP, proteină de reglare a fierului; ROS, specii reactive de oxigen; TUNNEL, transferați etichetarea dUTP nick end.
Materiale și metode
Toate procedurile experimentale sunt disponibile ca materiale și metode suport.
Rezultate
Ștergerea condiționată a feritinei H este letală în embrioni.
Pentru a studia funcția feritinei H la șoareci adulți, am generat, prin recombinarea celulelor stem embrionare, șoareci cu o alelă modificată a feritinei H denumită A cincea loxNeo . În această alelă, promotorul feritinei H și exonul 1 sunt mărginite de situsuri loxP care flancează, de asemenea, o casetă de selecție a neomicinei între situsurile FRT (Fig. 1 de susținere). Pentru a verifica strategia noastră de direcționare a feritinei H, am încrucișat A cincea loxNeo șoareci cu nestin hemizigot - șoareci Cre1. 24 Promotorul nestin prezintă un model de expresie complex cu activitate atât în creier, cât și în linia germinativă. 24 Prin urmare, se aștepta să se producă ștergerea completă a feritinei H în A cincea loxNeo/ +;Nes-Cre1 animale. Din 38 de șoareci F2, 17 (44,7%) au fost A cincea +/ + și 21 (55,3%) au fost A cincea +/ -, confirmând ștergerea indusă de nestin - Cre. Nu A cincea -/- s-au născut șoareci, indicând o funcție esențială a feritinei H în embriogeneză. Aceste rezultate sunt cel mai bine explicate printr-o ștergere a liniei germinale a feritinei H în A cincea loxNeo/ +;Nes-Cre1 F1 generația 24 cu letalitate embrionară atunci când A cincea gena este absentă din celulele germinale. 9 Acest lucru este în acord cu studiile publicate anterior cu privire la letalitatea embrionară a deleției de feritină la șoareci.
Eliminarea feritinei H la animalele adulte induce pierderea stocării fierului.
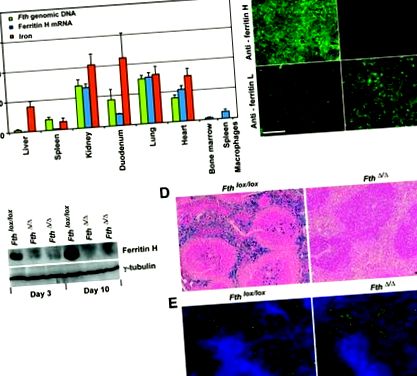
Eliminarea condiționată a feritinei H de către Mx-Cre reduce depozitarea fierului în ficat și splină. În vârstă de zece săptămâni A cincea lox/lox;Mx-Cre și control A cincea lox/lox șoarecii au fost injectați cu poli-IC pentru a activa expresia Cre. (A) În ziua 10, ștergerea feritinei H a fost evaluată în diferite țesuturi prin PCR în timp real pe ADN genomic (verde) și ADN complementar feritină H (ADNc) (albastru). Conținutul de fier țesut (roșu) a fost măsurat prin metoda batofenantrolină. Valori în A cincea Șoarecii Δ/Δ (n = 4) sunt exprimate în procente din valori în A cincea lox/lox șoareci (n = 4) stabiliți ca 100% ± deviație standard (SD). (B) Colorarea imunofluorescentă a feritinei H și L în secțiuni hepatice înghețate (ziua 10). Bară de scară = 200 μm. (C) Analiza imunoblot a feritinei H hepatice într-una A cincea lox/lox șoarecele și doi A cincea Șoareci Δ/Δ în zilele 3 și 10. (D) Secțiuni de splină înghețate colorate de albastru prusian al lui Perl în ziua 30. Bară de scară = 200 μm. (E) Secțiuni de splină înghețate colorate pentru macrofage cu anticorpi anti-CD11b și anti-F4/80, precum și 4 ′, 6-diamidino-2-fenilindol (DAPI). Bară de scară = 100 μm.
Feritina nu este necesară pentru sinteza hemoglobinei.
Majoritatea fierului este reciclat din hemoglobina eritrocitelor senescente, de către celulele reticuloendoteliale și ulterior reincorporată în hemoglobina proaspătă în celulele precursoare eritroide. Prin urmare, a fost de interes să observăm dacă deleția de feritină H indusă de Mx-Cre (Fig. 1A) ar modifica nivelurile de hemoglobină și hematocrit. A cincea Șoarecii Δ/Δ nu au prezentat nicio diferență semnificativă în comparație cu A cincea lox/lox șoareci (Tabelul 1 de susținere) și au supraviețuit timp de 2 ani fără un dezavantaj vizibil, în timp ce dimensiunea celulelor șterse a rămas neschimbată. Acest lucru sugerează că feritina H nu este esențială pentru reciclarea fierului de către macrofage și hemos eritroid - biosinteză. Am testat în continuare dacă șoarecii fără feritină H din ficat și splină au prezentat modificări ale nivelului seric al fierului și al saturației transferinei la 3, 10 și 30 de zile după deleția feritinei H (Fig. 2B). O creștere ușoară, dar semnificativă a fost observată pentru ambii parametri la șoareci experimentali versus șoareci martori.
Ștergerea feritinei H determină o creștere a fierului seric, saturația transferinei și hepcidina hepcidin 1 mARN și reprimarea mARN-ului Dcytb duodenal. (A) expresia ARNm a fost testată prin PCR în timp real în zilele 3, 10 și 30 după ștergerea feritinei H folosind primerii indicați în tabelul de susținere 2. Expresia medie (unități arbitrare) pentru A cincea lox/lox șoareci (n = 6; 3; 3) și A cincea Șoarecii Δ/Δ (n = 6; 3; 3) au fost normalizați la media geometrică a două gene martor [gliceraldehidă 3 - fosfat dehidrogenază [GAPDH] și hipoxantină - guanină fosforibosiltransferază [HPRT] în ficat; GAPDH și β - actină în intestin ) ± SD. ***P lox/lox (○) și A cincea Șoareci Δ/Δ (●) (R = 0,701 și P
Efectele ștergerii feritinei H mediate de Mx - Cre asupra expresiei genetice.
Reacție în lanț în timp real a polimerazei (PCR) în A cincea Δ/Δ versus A cincea lox/lox șoarecii la diferite puncte de timp au relevat o creștere semnificativă a hepcidinei hepatice 1 mARN (Fig. 2A). Această creștere s-a corelat cu creșterea fierului seric (Fig. 2B) și a saturației transferrinei (Fig. 2C). Dintre ARNm care codifică proteinele transportului de fier duodenal, doar ARNm DcytB a fost reprimat în mod semnificativ, în timp ce ARNm de DMT1, feroportină și hephaestin nu au prezentat nicio modificare semnificativă (Fig. 2A și datele nu sunt prezentate). ARNm hepatice ale feritinei L, transferinei și Hfe au fost neschimbate. Receptorul transferinei 1 mARN a fost ușor redus în majoritatea țesuturilor, compatibil cu destabilizarea mARN datorită inactivării IRP. 25 ARNm pentru receptorul transferinei 2, superoxid dismutaza 2 și glutation peroxidaza 1 au rămas neschimbate în ficat și intestin.
Deteriorarea severă a ficatului prin eliminarea feritinei H la animalele cu dietă bogată în fier.
Fier - Celulele induse de moartea celulelor Fth F/Δ Fibroblaste embrionare de șoarece.
Pentru a studia mecanismul toxicității celulare a fierului, am derivat A cincea Δ/Δ și A cincea +/ Δ fibroblaste embrionare de șoarece, care au prezentat rate de proliferare celulară identice și viabilitate în absența sărurilor de fier. Cu toate acestea, la expunerea la citrat feric de amoniu, A cincea Celulele Δ/were au fost de 30 de ori mai sensibile la fier (doza letală mediană [LD50] = 1,3 μg/ml) decât A cincea loxNeo/loxNeo celule (LD50 = 36 μg/mL) și de 120 de ori mai mult decât A cincea +/ Δ celule (LD50 = 151 μg/mL) (Fig. 4A). A cincea Moartea celulelor Δ/Δ ar putea fi salvată de feritina H de tip sălbatic folosind un vector inductibil (Fig. 4B). Nu a fost observată nicio salvare la exprimarea feritinei H mutante lipsite de activitate feroxidază (Fig. 4B). În toate populațiile de celule testate, valorile LD50 s-au corelat bine cu nivelurile de ARNm de feritină (Fig. 4C). Împreună, aceste date indică un rol esențial al feritinei în protecția împotriva toxicității fierului.
Supraviețuirea fibroblastelor embrionare de șoarece în mediu bogat în fier depinde de prezența feritinei funcționale H. Fibroblastele embrionare de șoarece au fost derivate din A cincea loxNeo/loxNeo și A cincea +/loxNeo șoareci, transfectați cu CMV - Cre - ER T și expuși la tamoxifen pentru a obține A cincea Δ/Δ și A cincea +/ Δ celule. (A) A cincea Δ/○ (Δ), A cincea loxNeo/loxNeo (●) și A cincea +Celulele/Δ (⋄) au fost incubate cu concentrații crescânde de citrat de amoniu feric și viabilitatea celulară măsurată după 4 zile prin testul MTS. (B) A cincea Celulele Δ/Δ au fost transfectate cu ADNc de feritină de tip sălbatic H (▪) sau o feritină H fără activitate feroxidază datorită mutațiilor 62E → K și 65H → G ((). Toxicitatea fierului a fost evaluată ca în (A). (C) Corelația dintre expresia ARNm a feritinei H și doza LD50 de citrat feric de amoniu.
Discuţie
Hepcidina 1 este esențială în reglarea absorbției intestinale a fierului și a reciclării fierului din reticulocite. 14-16, 19, 20 Rezultatele noastre care arată o corelație între inducerea ARNm hepcidin 1 și creșterea saturației fierului și transferinei pare să reflecte o semnalizare dependentă de fier sau dependentă de holo-transferină la gena hepcidin 1. 14, 32 Mai surprinzătoare este expresia diminuată a ARNm a hepcidinei 1 la animalele hrănite cu fier ridicat și apoi șterse de feritină H (Fig. 3C). Cu toate acestea, reacția adecvată a celulelor și semnalizarea genei hepcidin 1 ar putea fi modificate de leziuni hepatice severe. Noi și alții am observat că hepatocitele primare izolate în cultura celulară prezintă o expresie diminuată a ARNm-ului hepcidinei 1 și nu răspund la fierul feric în mediu (L. Vanoaica, inedit. Obs.) 14, 33, cu excepția cazului în care este tratat în câteva ore cu fier încărcat holo-transferină. 32
Afectarea hepatică acută observată în doar câteva zile de la ștergerea feritinei H la șoarecii Mx-Cre încărcați cu fier nu poate fi atribuită numai încărcării cu fier, nici activării căii interferon-α prin poli-IC, așa cum au arătat șoarecii martori fără semne de deteriorare. Rezultatele noastre în eliminarea feritinei H mediate de SA - Cre - ER specifică hepatocitelor cu tamoxifen sau cu tamoxifen plus poli - IC exclud, de asemenea, faptul că poli - IC singur provoacă leziuni hepatice. Prin urmare, moartea celulară apare direct legată de fierul eliberat la eliminarea și degradarea feritinei H. Rămâne de investigat dacă fierul eliberat este suficient pentru a provoca leziuni hepatice sau implică semnale datorate ștergerii feritinei în alte țesuturi. Faptul că șoarecii eliminați cu feritină H au hrănit o dietă normală timp de 2 luni și apoi au fost injectați cu fier dextran arată insuficiență hepatică acută susține un efect direct al toxicității fierului asupra celulelor hepatice. Interesant este faptul că ștergerea feritinei H mediată de SA - Cre - ER specifică hepatocitelor nu provoacă daune (Fig. 2). Acest lucru sugerează că hepatocitele sunt protejate deoarece macrofagele adiacente absorb cantități mari de fier eliberat (Fig. 3), ceea ce nu este cazul șoarecilor Mx - Cre.
Mulțumiri
Mulțumim Olav Zilian, Fabienne Seiler și Michel Aguet pentru sfaturi și mouse-ului Mx - Cre, Andreas Trumpp pentru mouse-ul Nes - Cre1 și pKI - Cre ER T, și Daniel Metzger și Pierre Chambon pentru mouse-ul SA - Cre - ER T2, Michael Murphy pentru mitoquinonă și Michael Reth pentru pAN - MerCreMer. Mulțumim lui Sanjiv Luther pentru colorarea macrofagelor în splină și facilității MIM a ISREC pentru histologie.
Informații suplimentare de sprijin pot fi găsite în versiunea online a acestui articol.
| HEP_23058_sm_SupDoc.doc57,5 KB | Materiale și metode de sprijin |
| HEP_23058_sm_SupFig1.tif5,1 MB | Figura 1. |
| HEP_23058_sm_SupFig2.tif5 MB | Figura 2. |
| HEP_23058_sm_SupFig3.tif18,6 MB | Figura 3. |
| HEP_23058_sm_SupFig4.tif18,6 MB | Figura 4. |
| HEP_23058_sm_SupFig5.tif3,7 MB | Figura 5. |
| HEP_23058_sm_SupFig6.tif5,7 MB | Figura suplimentară. |
| HEP_23058_sm_SupFig7.tif5,9 MB | Figura suplimentară. |
| HEP_23058_sm_SupTab1.tif959,5 KB | Supliment tabel 1. |
| HEP_23058_sm_SupTab2.tif5,4 MB | Supliment tabel 2. |
Vă rugăm să rețineți: editorul nu este responsabil pentru conținutul sau funcționalitatea oricăror informații de susținere furnizate de autori. Orice întrebări (altele decât conținutul lipsă) ar trebui să fie adresate autorului corespunzător pentru articol.
- Articol complet Biostimulantul previne pierderea randamentului și reduce daunele oxidative la plantele de tomate cultivate
- Efectul lungimii depozitării ouălor asupra ecloziunii și scăderii în greutate în incubația tipului de ouă și carne
- Leziuni hepatice induse de medicamente datorate „produselor naturale” utilizate pentru scăderea în greutate Un raport de caz
- Detoxifierea ficatului provoacă pierderea în greutate; Nutriție RSM
- Fitne Herbal Infusion Original Senna Slabire Slabire Ceai dietetic 40; THAI ETC GROUP Online Thai