María Rocío Villegas
1 Departamentul de chimie în științe farmaceutice, Facultatea de Farmacie, UCM, 28040 Madrid, Spania; [email protected]
2 Centru de investiții biomedicale în Ordinul Bioingineriei, Biomaterialelor și Nanomedicinei (CIBER-BBN), 28029 Madrid, Spania
Alejandro Baeza
1 Departamentul de chimie în științe farmaceutice, Facultatea de Farmacie, UCM, 28040 Madrid, Spania; [email protected]
2 Centru de investiții biomedicale în Ordinul Bioingineriei, Biomaterialelor și Nanomedicinei (CIBER-BBN), 28029 Madrid, Spania
María Vallet-Regí
1 Departamentul de chimie în științe farmaceutice, Facultatea de Farmacie, UCM, 28040 Madrid, Spania; [email protected]
2 Centru de investiții biomedicale în Ordinul Bioingineriei, Biomaterialelor și Nanomedicinei (CIBER-BBN), 28029 Madrid, Spania
Abstract
Utilizarea proteinelor terapeutice joacă un rol fundamental în tratamentul a numeroase boli. Stabilitatea fizico-chimică scăzută a proteinelor în condiții fiziologice pune funcția lor în pericol în corpul uman până când își ating ținta. Mai mult, mai multe proteine sunt incapabile să traverseze membrana celulară. Toate aceste fapte împiedică puternic efectul lor terapeutic. Nanomedicina a apărut ca un instrument puternic care poate oferi soluții pentru rezolvarea acestor limitări și îmbunătățirea eficacității tratamentelor bazate pe administrarea de proteine. Această revizuire discută avantajele și limitările diferitelor tipuri de strategii utilizate pentru livrarea proteinelor, cum ar fi PEGilarea, transportul în lipozomi sau nanoparticule anorganice sau încapsularea lor in situ.
1. Introducere
Trecerea de la un Pebiotic la un Pământ biotic a fost determinată de apariția unei vieți auto-susținute, auto-replicate și auto-asamblate. Organismele vii sunt sisteme complexe de bioreactoare, în care apar simultan numeroase reacții biochimice, permițând structurilor lor să se auto-asambleze, să se replice și să se transmită. Un exemplu de structuri care se auto-asamblează cu precizie și fidelitate sunt proteinele. Toate celulele umane au aceeași informație genetică, care este conținută în acidul său dezoxiribonucleic (ADN) și codifică proteinele.
Proteinele sunt fire de aminoacizi care sunt pliate în structuri tridimensionale caracteristice determinate de secvența de aminoacizi și de microambient. Aceste lanțuri formează o structură secundară caracterizată prin helice alfa și foi beta stabilizate prin legături de hidrogen intramoleculare. Structura secundară este apoi pliată într-o structură terțiară guvernată de interacțiuni hidrofobe și hidrofile, astfel încât zonele hidrofobe ale proteinei se află în miezul său și părțile hidrofile rămân expuse mediului apos de pe suprafața proteinei. Structurile foarte specifice produse de plierea proteinelor și secvențele lor precise de aminoacizi determină funcția proteinelor. Varietatea uriașă de procese chimice foarte specifice necesare vieții este obținută prin versatilitatea mare a potențialelor structuri și conformații proteice.
Proteinele au îndeplinit funcții esențiale, cum ar fi catalizarea reacțiilor biochimice [1], transducția semnalului [2], funcțiile defensive [3], funcțiile de reglare [4,5], controlul destinelor celulare [6], asigurând structura celulară și tisulară [7,8 ], ca purtători de molecule [9,10,11] și menținerea unui echilibru fin între supraviețuirea celulei și moartea programată. Din acest motiv, proteinele sunt numite „motoarele vieții”.
Celulele eucariote conțin mii de proteine care participă la funcția celulară normală [12]. Funcția lor corectă este vitală pentru menținerea homeostaziei în organism. Disfuncția proteinelor este legată de numeroase boli precum diabetul, care constă în reglarea dezechilibrată a insulinei, hemofilia care este un defect al nivelului proteinelor de coagulare, tulburări neurologice (Alzheimer [13] și boala Parkinson [14]), fibroza chistică care este legată de o pliere defectuoasă și exportul de proteine din reticulul endoplasmatic [15] și cancer (aproximativ 50% din toate tumorile umane au o proteină p53 mutantă), printre altele [16].
În consecință, utilizarea proteinelor ca molecule terapeutice apare ca o terapie atractivă și promițătoare pentru cancer [17], autoimunitate/inflamație [18], infecție [19] și tulburări genetice și a demonstrat o eficacitate ridicată pentru tratamentul numeroaselor boli [20]., 21]. Terapeuticele proteinelor includ anticorpi, citokine, factori de transcripție și enzime, printre altele.
Mai mult, proteinele pot suferi de proteoliză prin proteaze prezente în sânge și în țesuturile vii, care induc o schimbare ireversibilă a structurii lor și, prin urmare, o pierdere a funcției biologice. În plus față de stabilitatea scăzută a proteinelor, livrarea de proteine prezintă probleme suplimentare. Proteinele străine administrate intravenos pot fi adesea recunoscute de opsonine și de mulți receptori de scavenger. Opsonizarea cu lipoproteine are ca rezultat acumularea lor în hepatocite și în alte țesuturi bogate în receptori de lipoproteine. Mai mult, atașarea proteinelor complementului duce la o eliminare imediată din fluxul sanguin de către macrofage care formează sistemul fagocitar macrofagic (MPS) [26,27]. Astfel, proteinele administrate sunt adesea eliminate rapid de splină, ficat sau rinichi, unde pot fi acumulate nedorit și pot activa răspunsurile imune.
Utilizările clinice ale proteinelor sunt limitate de stabilitatea lor scăzută [22] față de temperatură, modificări ale solventului, modificări ale pH-ului, proteazei serice, cicluri de îngheț și depozitare. În plus, proteinele sunt de obicei incapabile să traverseze membranele celulare [28], pot activa răspunsurile imune și pot fi acumulate în țesuturi și prezintă un clearance rapid după administrarea intravenoasă [29]. Toate aceste probleme au dat naștere la dezvoltarea proteinelor recombinante, care încearcă să atenueze aceste limitări. Insulina recombinantă a fost prima proteină recombinantă disponibilă în comerț aprobată de FDA din SUA în 1982 [30,31,32,33,34]. În ultimii ani, între 2011-2016, Centrul de evaluare și revizuire a medicamentelor (CDER) și Centrul de evaluare și revizuire a produselor biologice (CBER) au aprobat 62 de proteine terapeutice [35].
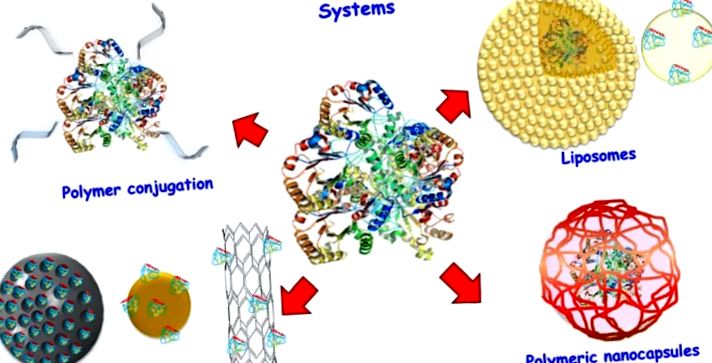
Schema diferitelor sisteme de livrare a proteinelor.
2. PEGilare
Din păcate, s-a constatat că aproximativ 25% dintre pacienți prezintă sau dezvoltă anticorpi anti-PEG anterior sau imediat după prima administrare de conjugați de proteină PEG [42,51,52]. Acest fapt implică eliminarea rapidă din sânge a proteinelor administrate și anulează eficacitatea acestora pentru tratamentele sistemice.
Un alt polimer hidrofil utilizat pentru prepararea conjugatului enzimatic este poli (vinilpirolidona) (PVP). După utilizarea sa ca expansor de plasmă în timpul celui de-al doilea război mondial [53], PVP a fost primul polimer raportat că a format conjugate polimer-medicament [54]. PVP este considerat un compus inofensiv [55] și, de asemenea, îmbunătățește timpul de circulație al enzimelor [56]. Din păcate, conjugatele PVP pot crește antigenicitatea în comparație cu enzimele libere, așa cum este cazul uricazei [57]. Ca alternativă la polimerii hidrofili, polimerii zwitterionici au fost utilizați și pentru capacitatea lor de a coordona moleculele de apă prin legarea hidrogenului. Conjugații polimerici zwitterionici au prezentat profiluri farmacocinetice similare cu sistemele PEGilate [58]. O altă opțiune este conjugarea cu dextran, care este o polizaharidă care extinde și timpul de circulație în sânge [59]. Cu toate acestea, administrarea intravenoasă de dextran poate produce anafilaxie care pune viața în pericol [60,61].
Deoarece conjugarea polimerilor este o metodă simplă și populară, este utilizată pentru multe formulări comerciale. Cu toate acestea, conjugarea polimerului blochează adesea situsurile active ale enzimelor. Astfel, enzima își pierde parțial sau complet activitatea catalitică [62]. Acest fapt, împreună cu cele menționate mai sus, constituie limitări puternice ale conjugaților polimer-proteină.
De exemplu, metoda comercială de livrare a proteinelor sunt așa-numitele sisteme de car. Acestea constau dintr-o peptidă 2843 Da capabilă să formeze un complex non-covalent cu proteina care permite transportul proteinelor biologic active în celule cu o eficiență de 60-95% [63].
3. Lipozomi
O abordare interesantă pentru livrarea proteinelor implică transportul lor în lipozomi. Lipozomii constau din vezicule concentrice cu strat strat lipidic care înconjoară compartimentele apoase. Veziculele sunt formate din fosfolipide și structura lor este similară cu cea a membranei celulare. Proteinele pot fi transportate în interiorul miezului apos al lipozomului sau pot fi altoite pe suprafața lipidelor.
Tehnicile de lipozomi funcționalizate cu proteine includ încărcarea lipozomului în miez și pe suprafață. Ca exemple, Szoka și colab. [64] a raportat o procedură tehnică pentru prepararea lipozomilor cu spații apoase mari. Această metodă le-a permis să încapsuleze materiale solubile în apă, cum ar fi proteinele, cu eficiență ridicată. Acest proces constă în formarea de vezicule lipidice atunci când un tampon apos a fost introdus într-un amestec de fosfolipide în solvenți organici. Autorii au raportat că, în ciuda faptului că solventul organic a produs denaturalizarea proteinelor, s-a păstrat o cantitate apreciabilă de activitate (41%). Pe de altă parte, încărcarea proteinelor pe suprafața lipozomilor a fost raportată pe scară largă. Shao și colab. [65] lipozomi sintetizați incluzând o porfină-fosfolipidă. Acest fosfolipid, care este capabil să chelate cobaltul, a permis captarea eficientă a proteinelor marcate cu His. Ca exemplu suplimentar, Blenke și colab. [66] dezvoltă lipozomi capabili să conjugeze azidă-proteină prin „chimie de clic”, ceea ce permite un control mai mare la locul conjugării decât chimiile de cuplare utilizate în mod obișnuit.
În plus, o problemă potențială a lipozomilor ca purtători de proteine este eliminarea rapidă a acestora de către MPS [74]. Această problemă poate fi parțial paliată prin conjugarea cu lanțuri PEG pe suprafața lipidelor. De fapt, sa demonstrat că PEGilarea lipozomilor își extinde circulația de înjumătățire de la 30 de minute la 5 ore [75]. Acest timp lung de circulație se datorează creșterii volumului hidrodinamic al sistemului și a capacității PEG de a evita răspunsul imun prin impediment steric. Cu toate acestea, un grad ridicat de funcționalizare cu PEG produce o reducere a temperaturii de topire a lipozomilor, ceea ce implică destabilizarea acestora, în timp ce o funcționalizare scăzută reduce timpul de circulație realizabil [76]. Mai mult, o administrare repetată de lipozomi PEGilați are ca rezultat o eliminare accelerată a sângelui [77]. În plus, natura lipozomilor limitează utilizarea lor clinică, deoarece lipozomii nu sunt robusti și pot elibera proteina de marfă atunci când se află într-un mediu cu o concentrație mare de lipoproteine, cum este cazul în fluxul sanguin [67,78,79] .
În ciuda tuturor acestor limitări, există truse comerciale pentru livrarea de proteine pe bază de lipozomi, cum este cazul lipofectaminei, care este un lipozom cationic capabil să transporte ADN-ul, ARNsi-ul și proteinele în celule într-o metodă rapidă, simplă și reproductibilă. [80].
4. Nanoparticule anorganice
Nanoparticulele anorganice au fost explorate ca fiind nanodispozitive interesante datorită faptului că sunt robuste și ușor modulabile. Proteinele pot fi transportate pe suprafața nanopurtătorului sau în interiorul structurilor lor, în cazul nanoparticulelor poroase. Aplicarea unor astfel de materiale necesită însă modificări chimice și/sau biologice pentru a satisface cerințele de livrare celulară, cum ar fi biocompatibilitatea și timpii de circulație lungi [81].
4.1. Nanoparticule de silice mezopor
Un exemplu de nanoparticule anorganice sunt nanoparticulele de silice mezoporoase (MSN). Aceste nanoparticule au fost, de asemenea, investigate ca purtători de proteine. Acestea se caracterizează printr-o suprafață ridicată și o dimensiune a porilor reglabilă [82], care asigură o capacitate mare de încărcare a încărcăturii și permit eliberarea unei largi varietăți de proteine [83]. Tu și colegii săi [84] au propus recent acest tip de nanoparticule pentru a furniza proteine cu diferite greutăți moleculare (12,4-250 kDa), dimensiune (2,3 × 2,6 × 4 până la 7 × 8 × 10 nm) și puncte izoelectrice (4,5-11,35) . Funcționalizarea sau nu a porilor nanoparticulelor cu grupări de amine favorizează interacțiunea electrostatică cu proteine care poartă grupuri încărcate negativ sau pozitiv. Mai mult decât atât, suprafața lor poate fi ușor modificată cu porțiuni de nichel pentru a chela proteazomii etichetați cu polihistidină. Celulele tratate cu proteazomi exogeni sunt capabili să degradeze semnificativ agregatele tau, un semn distinctiv patologic al bolii Alzheimer, comparativ cu proteazomii liberi [85]. Aceste nanoparticule au îmbunătățit eliberarea intracelulară a proteinelor impermeabile la membrană [83]. De exemplu, MSN-urile au demonstrat că sunt capabile să livreze citocrom C intracelular în celulele canceroase de col uterin uman (HeLa), ceea ce induce o moarte celulară semnificativă [86,87].
4.2. Nanoparticule de aur
- Concepții greșite despre proteine și chirurgia bariatrică - biți bariatrici
- Pulbere de proteine cu conținut scăzut de carbohidrați pentru pierderea în greutate Vanilla Garden of Life
- Ionic Whey Protein
- Cum o minge de naștere poate ajuta sarcina, travaliul și nașterea
- Cum să nu mai fii leneș și nemotivat 10 strategii rapide