Gyo-Nam Kim
1 Departamentul de Știința Alimentelor și Biotehnologie, Universitatea Kyungnam, Gyeongsangnam-do 51767, Republica Coreea
Mi-Rae Shin
2 Colegiul de Medicină Coreeană, Universitatea Daegu Haany, Gyeongsan 38610, Republica Coreea
Sung Ho Shin
2 Colegiul de Medicină Coreeană, Universitatea Daegu Haany, Gyeongsan 38610, Republica Coreea
Ah Reum Lee
2 Colegiul de Medicină Coreeană, Universitatea Daegu Haany, Gyeongsan 38610, Republica Coreea
Joo Young Lee
2 Colegiul de Medicină Coreeană, Universitatea Daegu Haany, Gyeongsan 38610, Republica Coreea
Bu-Il Seo
2 Colegiul de Medicină Coreeană, Universitatea Daegu Haany, Gyeongsan 38610, Republica Coreea
Min Yeong Kim
2 Colegiul de Medicină Coreeană, Universitatea Daegu Haany, Gyeongsan 38610, Republica Coreea
Tae Hoon Kim
3 Departamentul de Știința Alimentelor și Biotehnologie, Universitatea Daegu, 201 Daegudae-ro, Gyeongsangbuk-do 712-714, Republica Coreea
Jeong Sook Noh
4 Departamentul de Știință Alimentară și Nutriție, Universitatea Tongmyong, Busan 48520, Republica Coreea
Man Hee Rhee
5 Colegiul de Medicină Veterinară, Universitatea Națională Kyungpook, Daegu 41566, Republica Coreea
Seong-Soo Roh
2 Colegiul de Medicină Coreeană, Universitatea Daegu Haany, Gyeongsan 38610, Republica Coreea
Abstract
Lipaza pancreatică este enzima responsabilă de digestia și absorbția trigliceridelor, fiind inhibarea acesteia una dintre cele mai largi metode studiate utilizate pentru a determina activitatea potențială a produselor naturale de a inhiba absorbția grăsimilor din dietă. Scăderea aportului de energie din grăsimile dietetice prin inhibarea acestei enzime poate fi o strategie excelentă pentru prevenirea și tratarea obezității. Activitatea inhibitoare asupra enzimei lipazei pancreatice a fructului Diospyros kaki și a extractului de amestec de coajă Citrus unshiu (PCM) a fost evaluată in vitro și efectele sale anti-obezitate au fost studiate pe baza analizei parametrilor lipidici serici de la șoarecii hrăniți cu dietă bogată în grăsimi (HFD). vivo. PCM a fost administrat oral la o doză de 50 și 200 mg/kg greutate corporală timp de 6 săptămâni. În plus, activitatea lipazei pancreatice a fost evaluată folosind orlistat (control pozitiv). PCM a prezentat un efect inhibitor asupra activității lipazei cu o valoare IC50 de 507,01 μg/ml. Mai mult, triacilglicerolul seric, nivelul colesterolului total și greutatea grăsimii viscerale au fost semnificativ reduse comparativ cu șoarecii martor HFD la șoarecii tratați cu PCM 200 mg/kg (p LDL-nivel colesterol m g/d L = TC - HDL-colesterol - TG 5 .
2.4. Activitatea de eliminare radicală a DPPH a PCM
Determinarea activității antioxidante a PCM a fost efectuată prin eliminarea radicalului DPPH conform metodei Park et al. [24]. 100 μL dintr-o soluție etanolică de PCM (gol: 100 μL etanol) s-au adăugat la 100 μL dintr-o soluție etanolică de DPPH (60 μM) folosind o placă cu 96 de godeuri. Acidul ascorbic (eșantion standard) a fost preparat pentru opt concentrații (0,5, 1, 2, 5, 10, 20, 50 și 100 μg/ml). PCM a fost preparat pentru șase concentrații (5, 10, 20, 50, 100 și 200 μg/ml). Amestecul de reacție a fost incubat la întuneric la 25 ° C timp de 30 min. Densitatea optică a fost determinată folosind un cititor de microplăci model infinit M200 PRO (Tecan, Austria). Amestecul a fost măsurat spectrofotometric la 540 nm. Activitatea antioxidantă a fiecărei probe a fost exprimată în termeni de IC50 (concentrația micromolară necesară pentru a inhiba formarea radicalilor DPPH cu 50%, calculată din curba de inhibare log-doză). Activitatea de eliminare radicală a fost calculată ca procent, utilizând următoarea ecuație:
2.5. Activitatea ABTS de eliminare radicală a PCM
Activitatea de eliminare a radicalilor ABTS a diferitelor extracte a fost măsurată în conformitate cu metoda modificată a lui Re și colab. [25]. Soluția stoc ABTS a fost dizolvată în apă la concentrația de 7,4 mM. Cationul radical ABTS (ABTS) a fost produs prin reacția soluției stoc ABTS cu 2,45 mM persulfat de potasiu și lăsând amestecul să stea 14 ore la temperatura camerei în întuneric. Soluția ABTS a fost diluată cu etanol pentru a obține o absorbanță de 0,70 ± 0,02 la 750 nm. După adăugarea a 95 μL de soluție diluată de ABTS (A 750 nm = 0,70 ± 0,02) la 5 μL de probă, amestecul a fost lăsat la temperatura camerei timp de 15 min în întuneric. Absorbanta la 750 nm a fost masurata folosind un cititor de microplaci model infinit M200 PRO (Tecan, Austria). Semifabricatul a fost preparat în același mod, cu excepția cazului în care s-a folosit apă distilată în locul probei. Activitatea de eliminare radicală a fost calculată ca procent folosind următoarea ecuație:
2.6. Măsurarea inhibitorilor lipazei pancreatice porcine
Activitatea lipazei pancreatice a fost modificată din metoda raportată anterior de Kim și colab. [26]. Pe scurt, s-a preparat un tampon enzimatic prin adăugarea a 6 μL dintr-o soluție de lipază pancreatică porcină (Sigma-Aldrich) într-un tampon conținând 10 mM MOPS (acid morfolină propanesulfonic) și 1 mM EDTA, pH 6,8, la 169 μL tampon Tris ( 100 mM Tris-HCI și 5 mM CaCI2, pH 7,0). Apoi, fie 20 μL de PCM la concentrația testată (100, 250, 500 și 1000 μg/ml), fie orlistat (0,1, 0,25, 0,5 și 1 μg/ml) a fost amestecat cu 175 μL tampon enzimatic și incubat timp de 15 min la 37 ° C cu 5 μL de soluție de substrat [10 mM p-NPB (p-nitrofenil butirat) în dimetilformamidă]. Reacțiile enzimatice au fost lăsate să se desfășoare timp de 35 de minute la 37 ° C. Activitatea lipazei a fost determinată prin măsurarea hidrolizei p-NPB în p-nitrofenol. Creșterea absorbției luminii la 405 nm a fost măsurată folosind un cititor de microplăci, model infinit M200 PRO (Tecan, Austria). Inhibarea activității lipazei a fost exprimată ca scăderea procentuală a OD atunci când lipaza pancreatică porcină a fost incubată cu compușii testați. Inhibarea lipazei (%) a fost calculată conform următoarei formule:
unde A este activitatea fără inhibitor, a este controlul negativ fără inhibitor, B este activitatea cu inhibitor și b este controlul negativ cu inhibitor. Rezultatele au fost exprimate ca medie (n = 4).
2.7. Conținut total fenolic și flavonoid
Conținutul fenolic total al PCM a fost cuantificat prin modificări ușoare din metoda Folin-Ciocalteu [27]. 10 μL PCM și apă distilată 790 μL au fost agitate bine și apoi amestecate cu 50 μL de reactiv Folin-Ciocalteu timp de 1 min. După aceea s-au adăugat 150 μL de soluție de carbonat de sodiu 20% (Na2CO3) și amestecul a fost agitat timp de 2 ore la 20 ° C. În cele din urmă, absorbanța culorii rezultate a fost măsurată la 765 nm. Conținutul fenolic total a fost exprimat ca echivalenți de acid galic mg pe extract de gram. Valorile prezentate sunt media a trei măsurători. Flavonoidul a fost extras și cuantificat prin adaptarea metodei lui Lister și colab. [28]. PCM 50 μL și 500 μL dietilen glicol au fost bine amestecați. Și apoi s-a adăugat NaOH 1 N 5 μL și amestecul a fost incubat timp de 1 oră la 37 ° C. În cele din urmă, absorbanța culorii rezultate a fost măsurată la 420 nm. Conținutul de flavonoizi a fost exprimat ca mg echivalenți de naringină per gram extract. Valorile prezentate sunt media a trei măsurători.
2.8. Analize statistice
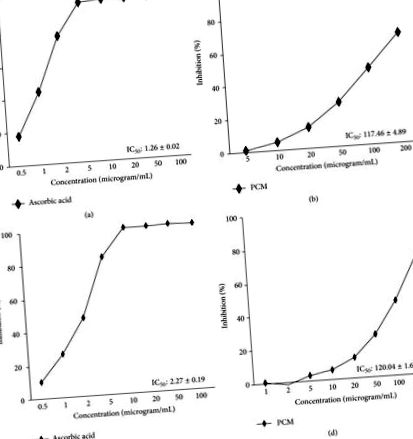
Datele sunt exprimate ca medie ± SEM. Comparațiile statistice au fost evaluate prin ANOVA unidirecțional, urmat de testul de comparație multiplă al lui Dunnett (SPSS 18.0 pentru Windows, SPSS Inc., SUA) și valorile p 1 (a) și 1 (b), IC50 a activității de eliminare a radicalilor DPPH a S-a constatat că PCM a fost de 117,46 ± 4,89 μg/ml și valoarea IC50 a acidului ascorbic (control pozitiv), deoarece un control pozitiv a fost de 1,26 ± 0,02 μg/ml. Valoarea IC50 calculată a PCM împotriva radicalului ABTS a fost stabilită ca fiind 120,04 ± 1,67 μg/mL, iar valoarea IC50 a acidului ascorbic, deoarece un control pozitiv a fost de 2,27 ± 0,19 μg/mL (Figurile 1 (c) și 1 (d)).
Activitatea de eliminare a radicalilor DPPH (a, b) și activitatea de eliminare a radicalilor ABTS (c, d). (a, c) acid ascorbic și (b, d) PCM, fruct de Diospyros kaki și extract de amestec de coajă de citrice unshiu. Fiecare experiment a fost realizat în trei exemplare. Acidul ascorbic a fost utilizat ca probă standard.
Mai mult, compusul fenolic sau flavonoidul funcționează ca un alt agent antioxidant prin chelarea ionilor metalici redox-activi, inactivarea lanțurilor de radicali liberi lipidici și evitarea conversiilor hidroperoxidului în oxiradicale reactive [30, 31]. Conținutul total fenolic a fost măsurat ca echivalenți de acid galic (GAE) cu referire la curba standard (y = 0,023x + 0,30 și R2 = 0,997) și sa dovedit a fi 29,90 ± 0,14 mg GAE/g de extract PCM. Conținutul de flavonoid a fost de 18,33 ± 0,08 mg echivalent naringin (NE)/g de extract PCM, respectiv, cu referire la curba standard (y = 0,0195x + 0,04 și R2 = 0,9999). Conținutul fenolic total a fost exprimat ca echivalenți de acid galic și conținutul de flavonoizi a fost exprimat ca echivalenți de rutină sau naringină variați în funcție de starea extractului sau stadiul de dezvoltare. Cu toate acestea, cațelul tânăr folosit în acest experiment este mai mare decât caquiul vechi folosit de un cercetător diferit în două conținuturi, pe baza studiului nostru actual [32, 33].
Inhibarea lipazei pancreatice de către PCM. Orlistat a fost utilizat ca control pozitiv. PCM, fruct de Diospyros kaki și extract de amestec de coji de citrice unshiu.
- Studiu asupra efectului fibrelor alimentare din tărâțe de grâu asupra proprietăților reologice ale aluatului -
- Studiați pentru a afla despre efectul Elevit (un supliment alimentar care conține mai multe vitamine, minerale)
- Studiu pentru evaluarea efectului asupra parametrilor inflamației sistemice și a rezultatelor și siguranței bolilor
- Efectul protector al inhibării angiotensinei II pe termen lung American Journal of Physiology-Heart and
- Lipaza pancreatică și proteina sa conexă 2 sunt reglementate de grăsimile polinesaturate dietetice în timpul