Abstract
fundal
Deși se crede că disfuncția tiroidiană cauzată de tiroidita Hashimoto (HT) este legată de eșecul implantării datorită subdezvoltării uterului receptiv, nu se știe dacă HT în sine, chiar și în starea eutiroidiană, afectează implantarea embrionului asociată cu defecte de receptivitate endometrială. Pentru a aborda dacă HT în sine poate afecta receptivitatea endometrială însoțită de modificări ale implantării, a fost stabilit un model HT eutiroidian la șoareci.
Metode
Șoarecii femele NOD au fost imunizați de două ori cu tiroglobulină și adjuvant pentru a induce modelul HT experimental. La patru săptămâni după al doilea tratament, șoarecii au fost în mod normal împerecheați, iar cei însărcinați au fost sacrificați în fereastra de implantare pentru măsurarea parametrilor tiroidieni și a hormonilor steroizi prin imunoanaliză electrochiluminiscentă și test imunosorbent legat de enzime și calculul numărului locului de implantare prin absorbția colorantului albastru Chicago . În plus, anumite caracteristici morfologice ale receptivității endometriale au fost observate prin colorarea hematoxilinei-eozină și microscopie electronică cu scanare, iar expresia altor markeri de receptivitate au fost analizate prin imunohistochimie, RT-qPCR sau Western Blot.
Rezultate
Șoarecii HT au prezentat infiltrare intratiroidiană de monocite și niveluri serice crescute de autoanticorp tiroidian fără disfuncție tiroidiană, definite ca HT eutiroidă la om. HT eutiroidian a avut ca rezultat eșecul implantării, mai puțini pinopode, maturarea pinopodului întârziată și inhibarea expresiei markerilor de receptivitate: receptorul de estrogen α (ERα), integrina β3, factorul inhibitor al leucemiei (LIF) și molecula de adeziune celulară-1 (ICAM-1). Interesant este că, în ciuda acestui răspuns de receptivitate endometrială compromis, nu au fost găsite diferențe statistice în nivelul serului de estradiol sau progesteron între grupuri.
Concluzii
Aceste descoperiri sunt primele care indică faptul că HT induce un mediu endometrial nereceptiv în starea eutiroidă, care poate sta la baza efectelor dăunătoare ale HT-ului însuși asupra implantării embrionului.
Introducere
Pentru a testa această ipoteză, acest studiu a construit un model clasic de șoarece HT [28] în care șoarecii femele NOD au fost imunizați activ cu tiroglobulina porcină (pTg) și au investigat dacă HT în sine a fost capabil să afecteze morfologia endometrului și expresia moleculară a endometrului gene legate de receptivitate însoțite de implantarea compromisă a embrionului în fereastra de implantare.
Materiale și metode
Reactivi și substanțe chimice
Tiroglobulina porcină (pTg), adjuvantul Freund complet (CFA) și adjuvantul Freund incomplet (IFA) au fost de la Sigma Chemical Co. (St. Louis, MO, SUA). Kitul TSH ELISA a fost de la Cloud-Clone Corp. (Wuhan, Hubei, China). Kituri E2 și P ELISA provin de la Cusabio Biotech Co., Ltd. (Wuhan, Hubei, China). Kitul de detectare SPlink a fost de la ZSGB-Bio (Beijing, China). Receptorii de estrogen α, integrina β3 și anticorpii GAPDH provin de la Abcam (Cambridge, MA, SUA). Receptorul de progesteron, anticorpii LIF, ICAM-1 provin de la Bioss, Inc. (Beijing, China). Reactivul TRI a fost de la Molecular Research Center, Inc. (Cincinnati, OH, SUA). Kituri de dezirribonuclează fără ribonuclează (DNază fără RNază) și kituri de transcripție inversă (RT) în timp real au fost de la Promega Corporation (Madison, WI, SUA). Light Cycler® 480 SYBR Green I Master Mix a fost de la Roche Diagnostics GmbH (Basel, Elveția). Toți ceilalți reactivi au fost cumpărați de la Sigma sau conform indicațiilor din metode.
Animale
Șoareci NOD (de 4 săptămâni, șoareci femele: 10
13 g; pisoi mici: 12
16 g) au fost achiziționate de la Nanjing Biomedical Research Institute din Nanjing University (numărul permisului: 15–0001). După 7 zile de carantină, toți șoarecii au fost ținuți în condiții specifice fără patogeni, cu acces ad libitum la apă și alimente în Centrul pentru animale de laborator al Universității de Medicină din Anhui (numărul permisului: 17–006). Toate procedurile la animale au fost efectuate în conformitate cu liniile directoare stabilite de Centrul pentru Științe Animale de Laborator și Asociația Științelor Animalelor de Laborator de la Anhui Medical University.
Imunizarea și proiectarea experimentală
Imunoanaliză electrochiluminiscentă (ECLIA)
Toate probele de ser și țesut au fost conservate la - 80 ° C până la utilizare. În plus, țesuturile endometriale au fost omogenizate în 10 μl/mg PBS și apoi supernatanții au fost colectați prin centrifugare la 15.000 × g timp de 15 minute la 4 ° C. Concentrațiile de triiodotironină liberă (FT3), tetraiodotironină liberă (FT4), TPO-Ab și Tg-Ab în ser și în supernatantul omogenat endometrial au fost testate prin imunoanaliză electrochiluminiscentă (ECLIA) utilizând un analizor de chimie clinică Cobas e411 (Roche, Mannheim, Germania) . Kituri gratuite de triiodotironină, FT4, TPO-Ab și Tg-Ab ECLIA au fost achiziționate de la Roche Applied Science. Procedurile pentru ECLIA au fost descrise în detaliu în altă parte [29]. Rezultatele au fost determinate printr-o curbă de calibrare care a fost generată în mod specific de instrument prin calibrarea în 2 puncte și o curbă master furnizată prin intermediul codului de bare al reactivului. Datele sunt exprimate ca unități picomolare internaționale per gram de hormon și per miligram de proteine ale țesutului endometrial. Toate probele au fost rulate în duplicat și media a fost utilizată ca valoare de analiză finală pentru fiecare probă. Coeficienții de variație pentru testele acestor profiluri tiroidiene au variat între 7,38 și 14,22%.
Test imunosorbent legat de enzime (ELISA)
Probele de ser rămase au fost decongelate la temperatura camerei (18-25 ° C) pentru cuantificarea TSH, E2 și P în fiecare lună folosind kiturile lor ELISA respective conform instrucțiunilor producătorului. Pentru valoarea densității optice (OD), absorbanța culorii din plăci a fost măsurată la 450 nm de către un cititor BioTek (Biotek Winooski, Vermont, SUA). Datele sunt exprimate ca picograme sau nanograme pe mililitru de hormon seric. Toate probele au fost rulate în duplicat și media a fost utilizată ca valoare de analiză finală pentru fiecare probă. Coeficienții de variație pentru testele hormonilor steroizi și TSH au variat între 7,24 și 9,84%.
Colorarea hematoxilinei și eozinei (HE) și imunohistochimie (IHC)
Glandele tiroide proaspăt colectate și uterele au fost fixate în paraformaldehidă 4% timp de 24 de ore pe un agitator și apoi încorporate în parafină. Din fiecare țesut încorporat în parafină, au fost secționate serial felii coronale (3 μm grosime). Feliile de tiroidă colorate cu hematoxilină și eozină (HE) au fost cuantificate pentru zona de infiltrare a celulelor mononucleare tiroidiene în conformitate cu un studiu anterior [30]: 0 = fără infiltrare; 1 = una sau două interstiții foliculare acumulate de celulele inflamatorii; 2 = una sau două leziuni celulare inflamatorii care ating dimensiunea foliculară; 3 = 10-40% infiltrare celulară inflamatorie; 4 = mai mult de 40% infiltrare celulară inflamatorie. În plus, colorarea HE a endometrului a fost analizată pentru observarea morfologică folosind un microscop Olympus DP80 (Olympus, Tokyo, Japonia). În fiecare uter, cel puțin 3 secțiuni necontigue au fost selectate aleator pentru a calcula numărul de glande (mărire 40 ×).
Imunohistochimia (IHC) a fost efectuată folosind setul de detectare SPlink. Secțiunile de uter cu grosimea de cinci micrometri au fost montate pe lamele, deparafinizate și rehidratate prin xilen și o serie de alcool gradat. După fiecare etapă, secțiunile au fost clătite de 3 ori cu PBS (câte 3 minute). După stingerea activității peroxidazei endogene cu 3% peroxid de hidrogen timp de 10 min, recuperarea antigenului a fost efectuată prin aburirea secțiunilor în tampon citrat 0,01 M (pH 6,0) timp de 20 min. Siturile de legare nespecifice au fost blocate cu 5% ser normal de capră timp de 30 de minute înainte de anticorpii primari specifici împotriva ERα (ab96867, 1: 250) și PR (bs23376R, 1: 500), peste noapte la 4 ° C. Diapozitivele au fost incubate timp de 30 de minute cu capră biotinilată IgG anti-iepure, urmată de incubare de 45 de minute cu complex avidină-biotină marcat cu peroxidază de hrean. Imunomarcarea a fost dezvoltată prin aplicarea diaminobenzidinei. Diapozitivele au fost contracolorate cu hematoxilină, deshidratate și montate folosind mediu de montare.
Microscopie electronică cu scanare (SEM)
Pentru a evalua morfologia pinopodului, trei uteri în ziua E5 din fiecare grup au fost tăiați longitudinal pentru a expune epiteliul luminal uterin, urmat de clătirea ușoară a suprafeței probei cu PBS și fixarea rapidă în 2,5% glutaraldehidă. Probele fixe au fost clătite de 3 ori (câte 15 min) în PBS 0,1 M, postfixate în tetroxid de osmiu 1% timp de 90 de minute fără lumină și apoi clătite ca înainte. Apoi, blocurile de țesut de 3 mm 2 au fost deshidratate printr-o serie alcoolică gradată (30, 50, 70, 80, 90, 95, 100%) și 100% acetonă de 3 ori (10 minute fiecare), uscate cu dioxid de carbon lichid în un uscător cu punct critic (Quorum K850, Marea Britanie) și acoperit cu aur de paladiu folosind un instrument de pulverizare ionică (IXRF MSP-2S, SUA) timp de 30 de secunde. Fotomicrografiile de scanare au fost obținute din trei câmpuri de suprafață selectate aleatoriu de epiteliu endometrial per probă pentru a analiza efectul HT asupra pinopodelor prin microscopie electronică de scanare (Gemini SEM 500, Zeiss, Germania). S-a înregistrat numărul de pinopode pe câmp microscopic (mărire de 5000 ×).
Reacție în lanț cu transcripție inversă-polimerază cantitativă (RT-PCR)
Western blot
analize statistice
Toate datele sunt prezentate ca medie ± SEM, cu excepția cazului în care se specifică altfel. Testul t al Studentului cu două cozi fără pereche a fost efectuat pentru a compara variabilele dintre grupuri. Prevalența sarcinii a fost evaluată prin testul exact Fisher. Siturile de implantare și scorul tiroiditei au fost comparate prin testul Mann-Whitney. Toate graficele au fost realizate utilizând software-ul GraphPad Prism versiunea 7.0 (GraphPad Software, Inc., CA, SUA). Western blot-urile și diapozitivele de imunohistochimie au fost scanate, iar abundența a fost evaluată cantitativ folosind Image-Pro Plus (Media Cybernetics, Inc., MD, SUA). Toate datele cantitative au fost analizate folosind SPSS versiunea 16.0 (IBM, Armonk, New York, SUA). p-valori
Rezultate
Construirea unui model de mouse HT eutiroid în ziua E4.5
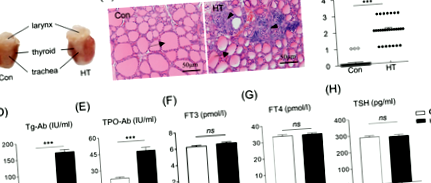
Așa cum este prezentat în Fig. 1a, șoarecii imunizați cu Tg au prezentat o mărire difuză pronunțată a tiroidei în comparație cu martorii. Secțiunile glandei tiroide colorate cu HE au arătat că șoarecii Con aveau foliculi tiroidieni intacti și aproape nici o infiltrare a celulelor mononucleare în țesutul tiroidian. Între timp, șoarecii HT au distrus foliculii tiroidieni și infiltrarea evidentă a celulelor inflamatorii în țesuturile tiroidiene (Fig. 1b). Scorarea ulterioară a gradului de infiltrare a celulelor inflamatorii intratiroidiene a arătat că severitatea tiroiditei la șoareci HT a fost semnificativ mai mare decât cea din grupul de control (P FIG. 1
Pentru a confirma modelul de șoarece eutiroidian HT, am analizat, de asemenea, concentrațiile de Tg-Ab și TPO-Ab, parametrii legați de funcția tiroidiană în ser. În modelul de șoarece HT în ziua E4.5, nivelurile serice de Tg-Ab și TPO-Ab au fost semnificativ mai mari decât la șoarecii martor (165,54 ± 7,92 UI/ml față de 12,90 ± 0,34 UI/ml, n = 28, P FIG. 2
HT eutiroidian afectează implantarea embrionilor la șoareci
Am investigat mai întâi dacă HT eutiroidian ar putea afecta implantarea embrionilor la șoareci. Dovezile vizibile macroscopice ale implantării reușite sunt site-urile de implantare localizate care pot fi vizualizate sub formă de noduli albastri prin absorbția a 0,1 ml soluție de colorant 1% Chicago Blue în ziua E4.5. Figura 3a prezintă uterii reprezentativi cu situsuri de implantare a embrionilor (săgeți negre) în ambele grupuri. Șoarecii martori au avut noduli embrionari densi cu o distribuție uniformă în țesuturile uterine. În schimb, șoarecii HT au avut mai puțini noduli embrionari, cu distribuție neregulată și distanța embrionară mai mare și chiar fără embrioni în cornul uterin. O altă analiză cantitativă prin calcularea nodulilor albastri din fiecare corn uterin a arătat că numerele viabile de implantare a embrionului în ziua E4.5 în grupul HT (13,22 ± 0,32) au fost mai mici decât cele din grupul martor (15,70 ± 0,56; p = 0,002) (Fig. 3b). Comparativ cu martorul (100%, 10/10), grupul HT a prezentat o tendință descendentă în prevalența sarcinii (90%, 9/10) (Fig. 3c).
HT eutiroidian induce morfologie endometrială compromisă la șoareci
Deoarece rezultatele de mai sus au indicat că HT eutiroidian a scăzut competența implantării embrionilor, am evaluat apoi efectul HT eutiroidian asupra morfologiei endometriale în ziua E4.5 ca o indicație a receptivității uterine prin observarea HE și SEM.
(1) HT eutiroidian provoacă modificări în histologia endometrială a șoarecilor
Figura 4A (a, c) arată că endometrul a fost compus din epiteliul luminal, epiteliul glandular și stroma. Așa cum este prezentat în Fig. 4A (b, d), șoarecii martor au prezentat decidualizare normală cu epiteliu luminal îngrijit și complet, un volum mare de celule stromale mari și împrăștiate și glande abundente și extinse cu secreție în stromă. În schimb, șoarecii HT au dezvăluit o decidualizare eșuată cu un lumen uterin deschis și neregulat, dezvoltare incompletă a epiteliului luminal, celule dense stromale și mai puține glande. Un studiu recent care a folosit un model de șoarece a constatat că glandele uterine joacă un rol esențial în implantarea și decualizarea la timp, asigurând astfel viabilitatea embrionilor și succesul sarcinii [32]. Aici, cuantificarea numărului de glandă endometrială/secțiune transversală (N/CS) în uteri a arătat că HT eutiroidian a dus la o reducere semnificativă (53,33 ± 6,64 N/CS) în comparație cu uterul de control (22,33 ± 6,94 N/CS, n = 3, p = 0,032) (Fig. 4B).
(2) HT eutiroidian afectează dezvoltarea pinopodilor endometriali la șoareci
Am analizat apoi epiteliul luminal al uterilor tratați cu FA și Tg pentru prezența pinopodelor de către SEM. Așa cum se arată în FIG. 5A (a, c), suprafața endometrială a șoarecilor martor a prezentat o densitate relativ mare de pinopode, în timp ce suprafața luminală a șoarecilor HT a prezentat o reducere semnificativă a numărului de pinopode. Figura 5A (b, d) ilustrează suplimentar pinopode complet dezvoltate cu capete terminale caracteristice în formă de cupolă la șoareci Con. Șoarecii cu HT, cu toate acestea, au prezentat pinopode anormale cu o suprafață încrețită sau semisferică în membrana apicală și o distribuție rară a pinopodelor mature. Analiza statistică a indicat faptul că numărul de pinopode din fiecare câmp microscopic (N/EMF) din grupul HT a scăzut semnificativ (43,18 ± 5,39 N/EMF) comparativ cu grupul de control (94,45 ± 5,96 N/EMF, p FIG. 5
HT eutiroidian nu modifică concentrația serică de E2 sau P la șoareci
Stabilirea receptivității endometriale este mediată în mod coordonat de steroizii estradiol (E2) și progesteron (P). În acest studiu, am măsurat nivelurile serice de E2 și P în dimineața zilei E4.5. Așa cum se arată în FIG. 6a, nu am observat o diferență semnificativă în concentrația serică de E2 între grupuri. Concentrațiile de P au fost, de asemenea, similare (Fig. 6b).
Efectele HT eutiroidiene asupra nivelului seric de E2 și P la șoareci. A Efectele HT eutiroidian asupra concentrației de E2 în ser. b Efectele HT eutiroidiene asupra concentrației de P în ser. Datele sunt prezentate ca medie ± SEM; n = 28, ns, nesemnificativ, vs. Con
Efectele HT eutiroidiene asupra endometrului ERα și expresia PR la șoareci
Pentru a investiga efectul HT eutiroidian asupra receptivității endometriale, analiza IHC a arătat că imunomarcarea ERα în grupul HT a fost imunopozitivă și redusă semnificativ în nucleul celulelor epiteliale și stromale. Interesant este faptul că nivelul PR endometrial nuclear în celulele stromale a fost comparabil între grupurile martor și grupurile HT (Fig. 7a). În concordanță cu analiza IHC, analiza Western blot a arătat că, comparativ cu martorul, proteina ERα eutiroidă HT reglată în jos (p FIG. 7
HT eutiroidian inhibă expresia integrinei β3, ICAM-1 și Galectin-3 în endometrul șoarecelui
Pentru a investiga în continuare efectul HT eutiroidian asupra receptivității endometriale în fereastra de implantare, a fost analizată expresia integrinei β3, LIF și ICAM-1. Rezultatele RT-PCR au ilustrat că abundența ARNm a integrinei β3, LIF și ICAM-1 a fost semnificativ redusă la șoarecii HT comparativ cu controalele (p = 0,031, p = 0,012, p = 0,025, respectiv; FIG. 8a). Rezultatele Western Blot au susținut acest rezultat și, comparativ cu controalele, abundența integrinei β3, LIF și ICAM-1 în endometru în ziua E4.5 au fost reglate în jos la șoarecii HT (p = 0,017, p = 0,016, p FIG. 8
Discuţie
Concluzii
În concluzie, am explorat efectele HT în sine asupra reproducerii din perspectiva implantării embrionului, care este o etapă critică a sarcinii. Rezultatele noastre au sugerat că HT eutiroidiană afectează implantarea embrionilor prin inducerea defectelor de receptivitate endometrială, inclusiv morfologia modificată și exprimarea perturbată a ERα, integrina β3, LIF și ICAM-1 în endometru. Descoperirile noastre ar putea oferi o bază utilă pentru studierea HT eutiroidian în pierderea sarcinii. În plus, acest studiu s-a concentrat asupra uterului receptiv, care este unul dintre factorii de bază pentru implantarea cu succes a embrionilor. Alți factori principali relevanți pentru reglarea implantării embrionilor, cum ar fi blastocistii competenți, ar trebui să fie analizați în studii ulterioare.
- Tiroidita Hashimoto la adolescenți; atingețiENDOCRINOLOGIA
- Keto este bun pentru Hashimoto; s Boală; Căpitanul de călătorie
- Cum afectează băutura excesivă vindecarea oaselor rupte - ScienceDaily
- Mamiferele nu numai animalele care hrănesc embrionul în timpul gestației - ScienceDaily
- Consumul pe termen lung de dietă bogată în grăsimi afectează coordonarea motorie fără a afecta generalitatea