Nicholas T. Hertz
1 Institutul medical Howard Hughes și Departamentul de farmacologie celulară și moleculară, Universitatea din California San Francisco, San Francisco, CA 94158, SUA
2 Program absolvent în chimie și biologie chimică, Universitatea din California San Francisco, San Francisco, CA 94158, SUA
Amandine Berthet
3 Gladstone Institute of Neurological Disease, Universitatea din California, San Francisco, San Francisco, CA 94158, SUA
Martin L. Sos
1 Institutul medical Howard Hughes și Departamentul de farmacologie celulară și moleculară, Universitatea din California San Francisco, San Francisco, CA 94158, SUA
Kurt S. Thorn
6 Departamentul de Biochimie, Universitatea din California, San Francisco, San Francisco, CA 94158, SUA
Al L. Burlingame
5 Departamentul de chimie farmaceutică, Universitatea din California, San Francisco, San Francisco, CA 94158, SUA
Ken Nakamura
3 Gladstone Institute of Neurological Disease, Universitatea din California, San Francisco, San Francisco, CA 94158, SUA
4 Departamentul de neurologie și programe postuniversitare în neuroștiințe și științe biomedicale, Universitatea din California, San Francisco, San Francisco, CA 94158, SUA
Kevan M. Shokat
1 Institutul medical Howard Hughes și Departamentul de farmacologie celulară și moleculară, Universitatea din California San Francisco, San Francisco, CA 94158, SUA
Date asociate
rezumat
Mitocondriile au fost implicate mult timp în patogeneza bolii Parkinson (PD). Mutațiile din kinaza mitocondrială PINK1 care reduc activitatea kinazei sunt asociate cu defecte mitocondriale și duc la o formă autosomală recesivă de PD cu debut precoce. Abordările terapeutice pentru îmbunătățirea activității PINK1 nu au fost luate în considerare, deoarece nu sunt cunoscute site-uri de reglementare alosterice pentru PINK1. Aici arătăm că o strategie alternativă, o abordare neo-substrat care implică trifosfatul analogic al kinetinei ATP (KTP), poate fi utilizată pentru a crește activitatea ambelor mutante legate de PD PINK1 G309D și PINK1 wt. Mai mult decât atât, arătăm că aplicarea precursorului kinetinei KTP la celule are ca rezultat creșteri semnificative biologic ale activității PINK1, manifestate ca niveluri mai ridicate de recrutare Parkin la mitocondriile depolarizate, motilitate mitocondrială redusă la axoni și niveluri mai mici de apoptoză. Descoperirea neo-substraturilor pentru kinaze ar putea oferi o modalitate neapreciată până acum pentru reglarea activității kinazei.
Introducere
Boala Parkinson (PD) se caracterizează prin pierderea neuronilor dopaminergici (DA) în substanța neagră, o regiune din creierul central care este critică pentru controlul motor (Lang și Lozano, 1998). Disfuncția mitocondrială a fost strâns legată de PD prin mai multe mecanisme (Nunnari și Suomalainen, 2012; Rugarli și Langer, 2012), inclusiv mutații în kinaza specifică mitocondriilor indusă de PTEN kinaza 1 (PINK1) (Valente și colab., 2004) și mitocondriile -ubicitină ligază E3 asociată Parkin (Kitada și colab., 1998). PINK1 joacă un rol important în repararea disfuncției mitocondriale, răspunzând la daune la nivelul mitocondriilor individuale. În mitocondriile sănătoase, PINK1 este degradat rapid de proteaza ParL (Meissner și colab., 2011); dar în prezența depolarizării membranei interne, PINK1 este stabilizat pe membrana exterioară, unde recrutează și activează Parkin (Narendra și colab., 2010), blochează fuziunea și traficul mitocondrial (Clark și colab., 2006; Deng și colab., 2008; Wang și colab., 2011) și, în cele din urmă, declanșează autofagia mitocondrială (Geisler și colab., 2010; Narendra și colab., 2008; Youle și Narendra, 2011). Calea PINK1 a fost, de asemenea, legată de inducerea biogenezei mitocondriale și de reducerea apoptozei induse de mitocondrie în neuroni, ultimul fenotip datorat cel puțin parțial efectului PINK1 asupra motilității mitocondriale, un fenotip specific neuronului (Deng și colab.)., 2005; Petit și colab., 2005; Pridgeon și colab., 2007; Shin și colab., 2011; Wang și colab., 2011).
Persoanele homozigote pentru mutațiile pierderii funcției PINK1 pot dezvolta o formă de PD cu debut precoce care rezultă din pierderea neuronală DA foarte selectivă și, în cel puțin un caz clinic, împărtășește patologia corpului Lewy a PD sporadice (Gautier și colab., 2008; Geisler și colab., 2010; Haque și colab., 2008; Henchcliffe și Beal, 2008; Petit și colab., 2005; Samaranch și colab., 2010). Lucrările recente au arătat că din 17 mutații PINK1 relevante din punct de vedere clinic, acele mutante care afectează activitatea catalitică, dar nu afectează clivajul sau localizarea subcelulară au cel mai dramatic efect asupra viabilității neuronilor, susținând în continuare un rol pentru activitatea PINK1 în prevenirea neurodegenerării (Song et. al., 2013). Unul dintre cele mai comune mutanți catalitici, PINK1 G309D, arată un
Scăderea cu 70% a activității kinazei și abrogă efectul neuroprotector al PINK1 (Petit și colab., 2005; Pridgeon și colab., 2007). Cu toate acestea, activitatea catalitică PINK G309D mai scăzută poate fi salvată prin supraexprimarea PINK1 wt și creșterea activității PINK1 prin PINK1 wt supraexpresia reduce apoptoza indusă de stresosporină și stres oxidativ în mai multe linii celulare, sugerând că activitatea PINK1 îmbunătățită o strategie terapeutică eficientă pentru PD (Arena și colab., 2013; Deng și colab., 2005; Kondapalli și colab., 2012; Petit și colab., 2005; Pridgeon și colab., 2007).
Recunoscând potențialul terapeutic al activării căii PINK1/Parkin, am început să investigăm mecanismele de activare farmacologică a PINK1. Activarea moleculelor mici a kinazelor se realizează de obicei prin legarea situsurilor de reglare alosterice: de exemplu, produsele naturale, cum ar fi esterii de forbol, se leagă de domeniul de legare a lipidelor PKC și recrutează kinaza de membrană (Castagna și colab., 1982; Nishizuka, 1984); separat, proteina kinază activată AMP (AMPK) este activată prin legarea AMP la un situs alosteric (Ferrer și colab., 1985; Hardie și colab., 2012). Cu toate acestea, PINK1 nu conține situri de legare a moleculelor mici cunoscute. O altă strategie potențială ar putea implica manipularea siturilor de interacțiune cu proteinele sau a sitului activ, dat fiind faptul că au fost identificați liganzi sintetici care se leagă de siturile de andocare a proteinelor pe kinaza PDK1 (Hindie și colab., 2009; Wei și colab., 2010) și, separat, că activitatea Src poate fi controlată prin complementarea chimică a unui situs de reziduu catalitic activ, permițând ca ATP să fie acceptat numai atunci când imidazolul a fost furnizat mutantului Src (Ferrando și colab., 2012; Qiao și colab., 2006). Cu toate acestea, aceste abordări nu au fost aplicabile PINK1, deoarece nu sunt disponibile date structurale pentru PINK1.
Ne-am îndreptat apoi atenția asupra site-urilor din PINK1 despre care se știe că își modifică funcția sau stabilitatea. Patru mutații asociate bolii PINK1, inclusiv G309D, apar într-o inserție neobișnuită în pliul kinazei canonice. PINK1, precum și mai mulți ortologi, împărtășesc 3 astfel de inserții mari (> 15 AA) în domeniul kinazei N-terminale (Figura S1A) (Cardona și colab., 2011; Mills și colab., 2008) care oferă majoritatea contactelor la inelul de adenină al ATP. S-a demonstrat că inserțiile în situl activ al mai multor enzime modifică specificitatea substratului. Într-un exemplu, deubiquitinaza UCH-L5 poate hidroliza lanțuri mai mari de ubiquitină numai atunci când o buclă> 14 AA este prezentă în situsul activ (Zhou și colab., 2012). Într-un alt exemplu, ingineria proteinelor de alchil guanină ADN alchiltransferază prin inserarea unei bucle în situsul activ permite recunoașterea unui substrat de guanină modificat cu O6 mărit care nu este acceptat de enzimă fără inserția buclei (Heinis și colab., 2006). În lumina acestor constatări, cele trei inserții în subdomeniul N-terminal de legare a adeninei PINK1 ne-au făcut să credem că PINK1 ar putea prezenta, de asemenea, specificitatea substratului modificată.
Având în vedere posibilitatea ca nucleotidele, altele decât ATP, să fie substraturi pentru kinaze, am observat că CK2 poate utiliza mai multe substraturi ca fosfo-donatori: GTP, precum și ATP, deși activitatea sa cu GTP este mult mai mică (Niefind și colab., 1999) . Deși este neobișnuit ca proteinele kinazice eucariote să accepte substraturi alternative în situsul de legare ATP, kinazele proiectate cu o singură mutație la reziduul gatekeeper tolerează adesea analogii ATP cu substituții în poziția N6 (Liu și colab., 1998; Shah și colab. ., 1997). Important, nici o kinază de tip sălbatic pe care am studiat-o anterior nu a arătat capacitatea de a accepta analogi ATP N 6 modificați (Figura S1B).
Am descoperit că, spre deosebire de orice kinază pe care am studiat-o, PINK1 acceptă neosubstratul N 6 furfuril ATP (kinetin trifosfat sau KTP) cu eficiență catalitică mai mare decât substratul său endogen, ATP. De asemenea, am constatat că precursorul metabolic al acestui neo-substrat (kinetina) poate fi preluat de celule și transformat în forma nucleotidică trifosfat, ceea ce duce la recrutarea Parkin accelerată la mitocondriile depolarizate, la diminuarea motilității mitocondriale în axoni și la suprimarea apoptozei în celule neuronale derivate de la om, toate într-o manieră dependentă de PINK1.
Rezultate
PINK1 acceptă N6 modificat ATP analog kinetin trifosfat (KTP)
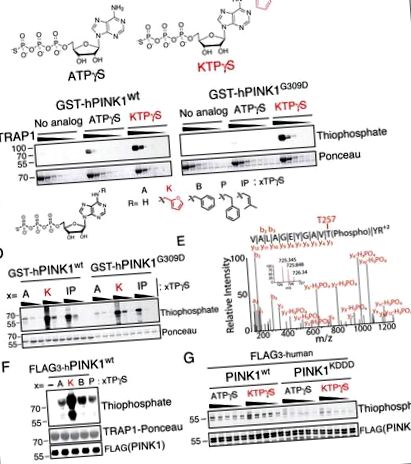
Am exprimat atât PINK1 wt, cât și PINK1 G309D GST domeniu kinază marcată (156–496PINK1) în E. coli (Figura S2A) și am efectuat teste kinazice cu o serie de analogi neo-substrat. Așa cum era de așteptat, PINK1 G309D a afișat activitate redusă cu ATP; interesant, totuși, incubația cu N6 furfuril ATP (kinetin trifosfat sau KTP) (Figura 1A) a condus la niveluri crescute de transfosforilare a chaperonei mitocondriale hTRAP1 (reziduuri 60-704) (Figura 1B) și autofosforilare atât cu PINK1 G309D, cât și cu PINK1 wt (Figurile 1C, D). Folosind o strategie de captare și eliberare a fosfopeptidelor (Blethrow și colab., 2008; Hertz și colab., 2010), am putut identifica situl de autofosforilare T257 (Kondapalli și colab., 2012) folosind KTP ca donator de fosfo pentru PINK1. Figura 1E), care a arătat că acest neosubstrat este capabil să susțină fosforilarea substratului dependent de PINK1 de bună-credință.
(A) Structura chimică a substratului kinazei adenozin trifosfat cu gamma tiofosfat (ATPγS) și neo-substrat kinetin trifosfat gamma tiofosfat (KTPγS).
(B - D) Testul kinazei PINK1 (B), cu substrat 60-704TRAP1 (1 mg/ml scăzând cu 1/3) și 500 μM nucleotid indicat (C) sau (D), PINK1 singur (4,3 μM) 100, 200, 400 μM nucleotidă analizată prin imunoblotare pentru TRAP1 și PINK1 marcate cu tiofosfo.
(E) Situl de autofosforilare PINK1 identificat prin captarea peptidelor specifice și LCMSMS găsite numai cu PINK1 wt și KTPγS indicând faptul că această nucleotidă este utilizată ca substrat de bună-credință
(F) PINK1 produs SF21 a fost incubat cu 60-704TRAP1 și nucleotida indicată (structura prezentată în panou C) și analizate ca în (B - D)
(G) Testul kinazei PINK1 cu nucleotida indicată (250 - 1250 μM în trepte de 250 μM) analizată ca în (B - D) dezvăluie o activitate de fosforilare mult redusă cu PINK1 KDDD (benzile 11-20), autofosforilarea crescută a fost observată cu neo-substrat KTPγS față de substratul endogen ATPγS.
Deoarece KTP ar trebui să concureze cu concentrațiile de ATP intracelulare milimolare pentru a funcționa, am efectuat un test de concurență cu γ-tiofosfat marcat KTP versus ATP. Am constatat că semnalul KTPγS a persistat chiar și atunci când ATP a fost prezent la o concentrație de 4 ori mai mare decât KTPγS (2 mM față de 0,5 mM) (Figura S2H) sugerând că PINK1 poate fi activat de KTP în prezența ATP celular.
KTP este produs în celule umane la tratamentul cu precursorul kinetinului KTP
Rezultatele noastre care arată creșteri in vitro ale activității PINK1 folosind KTP ne-au determinat să investigăm capacitatea de a realiza o activitate sporită a PINK1 în celule. O provocare majoră a activării PINK1 în celule este că analogii ATP precum KTP nu sunt permeabili la membrană; cu toate acestea, lucrările anterioare au arătat că anumite citokinine pot fi preluate de celulele umane și transformate în forma nucleotidică trifosfat (Ishii și colab., 2003). În plus, lucrările recente efectuate în celule care exprimă alele CDK2 mutante hipomorfe au arătat că activitatea CDK2 ar putea fi crescută în celule prin furnizarea de precursori analogi nucleotidici care pot fi convertiți în forma nucleotidică trifosfat și sunt capabili să se încadreze în situl activ CDK2 hipomorf (Merrick și colab., 2011).
Primul pas în bioconversie este ribozilarea citokininei într-o formă 5'-monofosfat, care poate fi mediată de adeninfosfibrozil transferază (APRT) (Kornberg și colab., 1955; Lieberman și colab., 1955b) (Figura 2A). În urma protocoalelor stabilite (Parkin și colab., 1984), am incubat fie adenină, kinetină, fie metil-kinetină N 9 martor negativ (9MK) cu 5'-fosforibosil pirofosfat (PRPP) și APRT și am analizat reacția prin LCMS (Figura 2B) . Adenina s-a transformat rapid în AMP, obținând o conversie aproape completă (84%) după 10 minute de timp de reacție; conversia kinetinei în KMP (Figura 2B, C) a fost semnificativ mai lentă, necesitând 150 de minute pentru a fi convertite jumătate. Compusul de control 9MK nu este convertit în KMP chiar și după 16 ore de incubare (Figura 2B), în timp ce kinetina a fost complet convertită în KMP în acest interval de timp. Acest experiment a demonstrat că ribosilarea kinetinei este biosintetic posibilă utilizând calea enzimatică pentru producția de AMP.
(A) Schema reacției de ribozilare a kinetinei la KMP prin APRT și PRPP urmată de conversia celulară la KTP.
(B) Analiza LCMS a producției de AMP (adenină) sau KMP (kinetin și 9MK) prin analiza LCMS relevă faptul că kinetina poate suferi ribozilare mediată de APRT la KMP, dar N 9 metil-kinetina nu poate.
(C) Analiza LCMS a reacției kinetinei; vârful major reprezintă vârful KMP + H la 428,3 m/z.
(D) Analiza HPLC a standardelor (ADP, GTP, ATP, KDP, KTP, BTP) sau a lizatului celular al celulelor HeLa tratate cu DMSO sau kinetin cu adăugare de 250 μM BTP * relevă un pic nou prezent în celulele tratate cu kinetin la 31,39 minute.
(E) Spectrul de absorbție al picului la 31,39 minute în celulele tratate cu kinetină, comparativ cu spectrul de absorbanță al KTP în standard.
(F) Zoomul analizei HPLC a lizatului celular tratat cu DMSO sau kinetin cu adăugare de BTP sau a lizatului celular kinetin cu adăugare de BTP și adăugarea de KTP relevă o creștere a vârfului care coeluează cu KTP (186%) unde BTP scade la 76% din suprafața inițială sugerând că vârful este KTP.
(G) Analiza imunoblotului cu anticorpii indicați pentru fosforilarea pe serina 62 a Bcl-xL relevă o creștere după tratamentul cu kinetină.
tabelul 1
Concentrația măsurată a nucleotidelor în lizatele celulare HeLa. Vezi și Figura 2 și Figura S3
- Bloatedconstipated Guppy - Întrebări despre hrănirea și postul de boală și pește de pește de apă dulce
- 10 caracteristici ale aplicației de activitate ascunsă care vă vor duce la fitness la nivelul următor
- Despre noi - vindecarea bolilor de inimă
- 5 Probleme majore legate de nutriție ale copiilor preșcolari
- Activitate; Bellabeat