Abstract
Obiectivul acestui studiu randomizat, dublu-orb, controlat cu placebo a fost de a testa ipoteza că administrarea acestui nou supliment oral pe o perioadă de șase luni va crește creșterea părului la femeile adulte cu părul subțire auto-perceput asociat cu o dietă slabă, stres, influențe hormonale sau cicluri menstruale anormale. Rezultatele preliminare ale acestui studiu au fost prezentate în altă parte
METODE
Subiecte. Studiul a înscris femei cu vârsta cuprinsă între 21 și 75 de ani, cu pielea de tip I până la IV Fitzpatrick, care, în general, aveau o stare bună de sănătate, dar s-au plâns de părul subțire auto-perceput. Subiecții participanți și-au exprimat dorința de a menține o frecvență consistentă de șamponare, tăierea și culoarea părului și au convenit să nu-și schimbe substanțial dieta curentă, medicamentele sau rutina de exerciții pe durata studiului. Femeile aflate la vârsta fertilă au fost obligate să utilizeze o formă de control al nașterii acceptată din punct de vedere medical în timpul studiului.
Subiecții au fost excluși de la participare dacă au avut antecedente de alergie sau intoleranță la pește, fructe de mare, acerola, orice șampon sau balsam de păr; ați alăptat, a fost însărcinată sau intenționați să rămâneți gravidă în timpul studiului; au participat la un alt studiu de cercetare clinică; a început utilizarea hormonilor pentru controlul nașterii sau terapia de substituție hormonală în ultimele șase luni; au fost în prezent supuși unei forme de tratament pentru subțierea părului, inclusiv medicamente sau terapie ușoară în ultimele trei luni; sau a utilizat medicamente eliberate pe bază de rețetă despre care se știe că afectează ciclul de creștere a părului în ultimele șase luni. Subiecți cu alte tulburări ale căderii părului, cum ar fi alopecia areata, alopecia cicatricială și alopecia androgenetică; boli necontrolate auto-raportate, cum ar fi diabetul, hipertensiunea, hipertiroidismul sau hipotiroidismul; hepatită activă auto-raportată, deficit imunitar, virusul imunodeficienței umane sau boală autoimună; sau orice afecțiune dermatologică activă cunoscută, care, în opinia investigatorului, ar putea pune subiectul la un risc mai mare sau să interfereze cu evaluările clinice, au fost, de asemenea, excluse.
Proceduri. În timpul vizitei de bază, criteriile de includere/excludere au fost revizuite și fiecare subiect a acordat consimțământul în cunoștință de cauză și a semnat un formular de lansare a fotografiei. A fost obținut un istoric medical de la fiecare subiect, medicamente concomitente și instrucțiuni privind stilul de viață și fiecare subiect a fost supus unui examen fizic și teste de sarcină. Scalpul a fost examinat pentru a exclude prezența oricăror stări de confuzie ale scalpului. Anchetatorul a selectat o suprafață de aproximativ 4cm 2 a scalpului de-a lungul osului frontalis la joncțiunea liniilor frontale și laterale. Această locație a fost identificată pentru evaluări ulterioare utilizând o locație în trei puncte notată pe fiecare pacient în funcție de măsurătorile luate de la cantusul medial, cantusul lateral și groapa pielii preauriculare până la joncțiunea liniei părului și fotografiată digital (camera Nikkon SLR 200/300 cu un Canfield EpiFlash ). După vizita inițială, subiecții s-au întors pentru evaluare după 90 ± 7 și 180 ± 7 zile. În acel moment, examinarea fizică, semnele vitale și fotografiile digitale au fost repetate. În plus, subiecții au completat chestionare de autoevaluare (Tabelele 1) și au fost întrebați cu privire la posibilele evenimente adverse.
TABELUL 1
| 1. Volumul total de păr | 1 □ | 2 □ | 3 □ | 4 □ | 5 □ | 6 □ | 7 □ |
| 2. Acoperirea scalpului | 1 □ | 2 □ | 3 □ | 4 □ | 5 □ | 6 □ | 7 □ |
| 3. Grosimea corpului părului | 1 □ | 2 □ | 3 □ | 4 □ | 5 □ | 6 □ | 7 □ |
| 4. Moliciunea corpului părului | 1 □ | 2 □ | 3 □ | 4 □ | 5 □ | 6 □ | 7 □ |
| 5. Strălucirea părului | 1 □ | 2 □ | 3 □ | 4 □ | 5 □ | 6 □ | 7 □ |
| 6. Numărul de păr pierdut în ziua medie | 7 □ | 6 □ | 5 □ | 4 □ | 3 □ | 2 □ | 1 □ |
| 7. Forța unghiilor | 1 □ | 2 □ | 3 □ | 4 □ | 5 □ | 6 □ | 7 □ |
| 8. Rata de creștere a unghiilor | 1 □ | 2 □ | 3 □ | 4 □ | 5 □ | 6 □ | 7 □ |
| 9. Păstrarea umezelii pielii | 1 □ | 2 □ | 3 □ | 4 □ | 5 □ | 6 □ | 7 □ |
| 10. Linii fine și riduri faciale | 1 □ | 2 □ | 3 □ | 4 □ | 5 □ | 6 □ | 7 □ |
| 11. Moliciunea pielii | 1 □ | 2 □ | 3 □ | 4 □ | 5 □ | 6 □ | 7 □ |
| 12. Rezistența pielii | 7 □ | 6 □ | 5 □ | 4 □ | 3 □ | 2 □ | 1 □ |
| 13. Creșterea părului pentru sprâncene | 1 □ | 2 □ | 3 □ | 4 □ | 5 □ | 6 □ | 7 □ |
| 14. Creșterea genelor | 1 □ | 2 □ | 3 □ | 4 □ | 5 □ | 6 □ | 7 □ |
| 15. Netezimea pielii | 1 □ | 2 □ | 3 □ | 4 □ | 5 □ | 6 □ | 7 □ |
| 16. Sănătatea generală a pielii | 7 □ | 6 □ | 5 □ | 4 □ | 3 □ | 2 □ | 1 □ |
Material de testare. Subiecții au fost randomizați în mod dublu-orb pentru a primi noul supliment oral (Viviscal ® Maximum Strength) sau placebo. Viviscal conține complex marin AminoMar C ™, un amestec de rechin și pulbere de moluste, o formă organică de silice derivată din Equisetum sp. (coada calului), vitamina C derivată din Malpighia emarginata (cireșă acerolă), celuloză microcristalină (E460), aromă naturală de portocală, stearat de magneziu, hipromeloză și glicerol. Tratamentul placebo a constat în tablete inerte cu aspect similar. Subiecții au fost instruiți să ia câte un comprimat din tratamentul atribuit în fiecare dimineață și un comprimat în fiecare seară cu apă după masă.
Măsuri de eficacitate. Obiectivul primar a fost modificarea numărului de fire terminale și de peri în zona țintă a scalpului. Obiectivul secundar a fost modificarea chestionarelor de autoevaluare a pacienților după tratament (Tabelele 1).
Măsuri de siguranță. Măsurile de siguranță au inclus rapoarte spontane de evenimente adverse și orice evenimente adverse dezvăluite în timpul evaluărilor clinice și orice modificări observate în timpul examinărilor fizice.
analize statistice. Parametrii principali ai punctului final măsurați în timpul fiecărei evaluări au fost comparați cu datele de bază folosind un test t asociat. Comparațiile între tratamentele active și cele cu placebo au fost făcute utilizând analiza varianței (ANOVA). Parametrii punctului final secundar au fost comparați utilizând analiza top box. Diferențele au fost considerate semnificative la nivelul p≤0,05.
Etică. Acest protocol de studiu și acordul de consimțământ informat au fost revizuite și aprobate de un comitet de revizuire instituțională. Consimțământul scris a fost obținut de la toți participanții înainte de participarea lor la orice activități legate de studiu. Acest studiu a fost realizat în conformitate cu liniile directoare aplicabile pentru protecția subiecților umani pentru cercetare, așa cum este subliniat în United States Food and Drug Administration (FDA) 21 CFR Partea 50, cu standardele acceptate pentru bune practici clinice și cu practicile standard ale Ablon Skin Institute Research Center.
REZULTATE
Eficacitate. Subiecții au fost randomizați pentru a primi medicația activă (N = 10) sau placebo (N = 5). Vârsta medie (SD) a subiecților din grupurile de tratament activ și placebo a fost de 49,9 (8,5) ani și respectiv 47,6 (17,0) ani și nu au fost semnificativ diferite între ele. Toți subiecții s-au descris ca fiind caucazieni, cu excepția unuia care era hispanic.
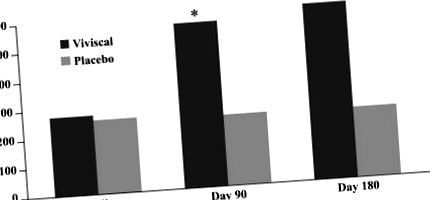
Modificarea numărului de fire de păr vellus. Utilizarea unui nou supliment oral a fost asociată cu o creștere semnificativă a numărului de fire terminale de păr după 90 și 180 de zile de tratament.
În ceea ce privește autoevaluările subiecților, subiecții tratați în mod semnificativ mai mult studiați au perceput îmbunătățiri în volumul total de păr, acoperirea scalpului și grosimea corpului părului după 90 de zile (Tabelul 3). Îmbunătățiri suplimentare după 180 de zile au inclus strălucirea părului, păstrarea umezelii pielii și netezimea pielii.
TABELUL 3
Modificări ale chestionarului de autoevaluare, medie (SD)
- Un studiu dublu-orb randomizat, controlat cu placebo, privind studiul siguranței, reactogenității și
- TINELE FEMEI ARABE MÂNCĂ O DIETĂ SĂNĂTOASĂ O STUDIE DIETARĂ CALITATIVĂ ÎN DOMENIUL STUDENȚILOR DE LA GĂȘTILE COLEGIOASE
- Un studiu transversal asupra obezității și a factorilor de risc asociați în rândul femeilor de pe piața centrală a
- Un studiu pentru a evalua eficacitatea și siguranța Ocrelizumab la adulți cu progresiv primar
- Un studiu de fază III randomizat, dublu-orb, în grup paralel, comparând SB4 cu referința etanercept