Abstract
FUNDAL: Studiile de șoareci de legătură și knock-out sugerează că receptorul melanocortinei-3 (MC3R) este o genă candidată pentru obezitate.
OBIECTIV: Pentru a evalua dacă mutațiile MC3R stau la baza obezității morbide.
SUBIECTE ȘI METODE: Codificarea MC3R și regiunile de flancare 5 ′ au fost secvențiate la 48 de subiecți și variantele detectate au fost genotipate la 252 finlandezi cu obezitate morbidă (IMC ≥40 kg/m 2). Schimbările de gel au fost utilizate pentru a examina dacă o mutație în promotorul supus modifică legarea factorului GATA.
REZULTATE: Au fost găsite trei variante comune MC3R: o variantă 17C> A, care schimbă Thr6 → Lys în 16%, o 241G> O variantă care schimbă Val81 → Ile în 15% și o substituție −239A> G în locul de legare GATA în 21% din subiectii. Alte patru variante au fost detectate în regiunea de flancare 5 ′. Frecvențele celor trei variante comune nu au diferit între subiecții obezi și contol. Dintre obezi, variantele 17C> A și 241G> A au fost moștenite și asociate cu un raport crescut insulină-glucoză (P Mutația G.
CONCLUZII: Variantele genei MC3R sunt frecvente și nu explică obezitatea morbidă umană. Aceste variante s-au asociat cu modificări subtile în debutul creșterii în greutate, hiperleptinemie și raporturi insulină - glucoză. Mutația −239A> G elimină legarea GATA-4 la regiunea promotorului MC3R.
Introducere
Proporția de grăsime corporală este reflectată de nivelurile de leptină și insulină circulante, iar homeostazia pe termen lung a greutății corporale se realizează prin integrarea acestor semnale hormonale de către centrele hipotalamice. 1,2,3 Neuropeptidele derivate din precursorul ACTH pro-opiomelanocortina (POMC) și receptorii melanocortinei (MCR) joacă un rol cheie în acest control complex al apetitului și al greutății corporale. 1,2 MC3R și MC4R sunt ambele exprimate în zone creierului implicate în reglarea echilibrului energetic. 2 MC4R joacă un rol important în homeostazia energetică, întrucât întreruperea sa vizată provoacă hiperfagie și obezitate la șoareci. 4 mutații MC4R stau la baza până la 4% din obezitatea severă cu debut precoce sau obezitatea la adulți. 5.6 Legătura observată între obezitate și regiunea cromozomială 20q13 face, de asemenea, gena MC3R o genă candidată plauzibilă pentru obezitatea umană. În plus, întreruperea MC3R la șoareci are ca rezultat creșterea masei grase, hiperleptinemie și rezistență la insulină. 8,9 Am examinat dacă mutațiile genei MC3R stau la baza obezității morbide și/sau sunt asociate cu modificări ale parametrilor metabolici.
Subiecte și metode
Între anii 1989-1995 a fost colectată o cohortă de 252 pacienți obezi morbid (IMC ≥ 40 kg/m 2, 182 femei/70 bărbați, vârsta 21-67 ani, prevalența diabetului zaharat și a hipertensiunii arteriale 24 și respectiv 45%). 10 Istoria dezvoltării greutății a fost evaluată prin chestionar. Pentru detectarea mutației, 1400 pb din regiunea de flanșare 5 ′ și întreaga regiune de codificare a genei MC3R au fost secvențiate la 48 de subiecți, iar variantele detectate au fost genotipate în restul cohortei. Probele de sânge de la 312 de donatori de sânge sănătoși (153 de femei și 159 de bărbați) de la Serviciul finlandez de transfuzie a sângelui de la Crucea Roșie au servit drept controale pentru estimarea frecvențelor de alele în populația de fond. Concentrațiile de leptină au fost determinate prin radioimunotest (Linco Research Inc., St Charles, MO, SUA) cu CV intra și între teste mai mici de 5%. Nivelurile de glucoză, insulină și lipide au fost măsurate așa cum s-a descris anterior. 10
Secvențierea ADN și genotiparea
După PCR, gena MC3R a fost secvențiată folosind perechi de primeri: 5 ′ - IndexTerm TGACCAGAGCAGACTACTTTCA-3 ′ și 5 ′ - IndexTerm TGAGCAAAGACAACAGCCACT-3 ′; 5 ′ - IndexTerm TCTTCTTCCACCCCAGACTC-3 ′ și 5 ′ - IndexTerm GCAAGACAGGGGATGTGTTA-3 ′; 5 ′ - IndexTerm CCCTTGGCCAATATGAAAAA-3 ′ și 5 ′ - IndexTerm CCAGATACGTCTTTTGGATGC-3 ′; 5 ′ - IndexTerm TCTCTACCCTCCCCATCCTT-3 ′ și 5 ′ - IndexTerm GGGCATTGGACACACTTACC-3 ′; 5 ′ - IndexTerm CATCGTCAGTCTGCTGGAAA-3 ′ și 5 ′ - IndexTerm GAGCATCATGGCGAAGAAC-3 ′; și 5 ′ - IndexTerm CTCGGAGAGCACAAATGGTCA-3 ′ și 5 ′ - IndexTerm TCACGTGGATGGAAAGTCAA-3 ′. Secvențierea a fost efectuată utilizând secvențierul ADN ABI Prism 377. Genotiparea variantelor −239A> G, 17C> A și 241G> A au fost efectuate folosind enzime de restricție AlwEu, HpyCH4IV și BseDI, respectiv electroforeză pe gel.
Test de schimbare a mobilității electroforetice (EMSA)
Proteinele nucleare au fost preparate 11 dintr-o celulă tumorală Sertoli de șoarece MSC-1, limfom cu celule T Jurkat și linii de fibroblaste NIH 3T3, exprimând GATA-4 și GATA-6 (MSC-1), GATA-3 (Jurkat) și niciun GATA cunoscut proteine (NIH-3T3). Probele au fost preparate prin recoacerea oligonucleotidelor 5 ′ - IndexTerm TTTCTATGTAAACAAGATAAAAACTGCTCCTCCT-3 ′ (corespunzând nucleotidelor −253 la −220) și 5 ′ - IndexTerm AGGAGGAGCAGTTTTTATCTTGTTTACATAGAAGGATAAAAACTGCTCCTCCT-3 ′ și 5 ′ - IndexTerm AGGAGGAGCA-GTTTTTATCCTGTTTACATAGAAA-3 ′ (MCR3mut, −239A> mutația G subliniată) și 5 ′ - IndexTerm CCCATAAAGATAGGGA-3 ′ și 5 ′ - IndexTerm TCCCTATCTTTATGGG-3 ′ (corespunzător nucleotidelor −182 la −163 ale genei steroidogene -1) . Una dintre oligonucleotidele fiecărei sonde a fost marcată la 5 ′ cu [γ- 32 P] ATP înainte de recoacere. Reacțiile de legare au fost efectuate așa cum este descris. 13 Anticorpii provin de la Santa Cruz Biotechnology Inc. (Santa Cruz, CA).
Analize statistice
Testul de sumă Mann-Whitney a fost utilizat pentru a analiza diferențele dintre mediile de grup și testul exact al lui Fisher pentru distribuțiile de frecvență.
Rezultate
Variante genice MC3R
Două mutații frecvente au fost găsite în regiunea de codificare MC3R: nucleotida 17C> Un aminoacid 6 în schimbare din treonină în lizină și 241G> Un aminoacid 81 în schimbare din valină în izoleucină. Cinci variante suplimentare, -939G> C, -911G> A, -803T> C, -373G> T și -239A> G au fost detectate în regiunea supusă promotorului. Varianta −239A> G a fost localizată într-un site de legare a factorului de transcripție GATA consens 13 (aaacaAGATAaaaact), cuprinzând nucleotidele −244 până la -228 ale genei MC3R (formă alelică comună cu caractere aldine și subliniate).
Frecvențele genotipului pentru variantele 17C> A, 241G> A și −239A> G nu au diferit între obezitatea morbidă și populația martor (Tabelul 1A).
Varianta −239A> G și legarea GATA
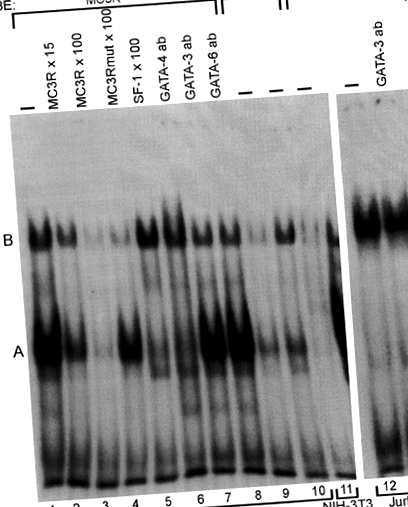
În EMSA, extractele nucleare care conțin abundent GATA-4/GATA-6 au dat o bandă puternic retardată A cu sonda de tip sălbatic (Figura 1, banda 1), în timp ce testele care utilizează oligonucleotida MC3Rmut au dezvăluit doar un complex proteină-ADN slab (Figura 1, benzile 9 și 10). Într-un exces de oligonucleotidă MC3R sau SF-1 nemarcată, banda A a fost clar atenuată (Figura 1, benzile 2, 3 și 5) indicând legarea specifică și sugerând că, din diferitele proteine GATA, GATA-4 este responsabilă pentru formarea banda A. MC3Rmut nemarcat nu a modificat formarea benzii A (Figura 1, banda 4). În experimentele de supershift, anticorpul GATA-4 a abolit banda A, indicând faptul că GATA-4 se leagă de sonda MC3R, în timp ce nici GATA-3 și nici GATA-6 nu au provocat niciun supershift (Figura 1, benzile 6, 7 și 8). Mutația −239A> G nu a afectat legarea de proteine care formează banda B (Figura 1, benzile 2-4).
GATA-4 se leagă de oligonucleotida MC3R de tip sălbatic (MC3R). Extractele nucleare (NE) din celulele MSC-1, NIH-3T3 și Jurkat au fost incubate cu 32 de sonde oligonucleotidice marcate cu P. Când s-a folosit extract MSC-1 (10 μg) și MC3R marcat, s-au format două benzi majore A și B (banda 1). Legarea proteinelor a fost concurentă cu MC3R nemarcat în exces molar de 15 și 100 de ori (benzile 2 și 3) sau oligonucleotide MC3R (MC3Rmut, banda 4) sau SF-1 (banda 5) în exces molar de 100 de ori. În experimentele de supershift, s-au folosit anticorpi împotriva GATA-4 (banda 6), GATA-3 (banda 7) și GATA-6 (banda 8). MC3Rmut marcat a fost folosit ca o sondă cu 10 µg (banda 9) sau 20 µg (banda 10) MSC-1 extract nuclear. Extractul NIH-3T3 (10 µg, banda 11), fără proteine GATA cunoscute, și extractul de celule Jurkat (10 µg, banda 12 și 13), conținând abundente proteine GATA-3, au fost incubate cu MC3R marcat. Experimentul Supershift cu anticorpi GATA-3 este prezentat pe banda 13.
Variante MC3R și parametri metabolici
Variantele genei 17C> A și 241G> A au fost moștenite în toate cazurile, în afară de 3, indicând un dezechilibru de legătură aproape complet. Persoanele cu genotipul combinat de 17CC/241GG au avut un raport insulină-glucoză mai scăzut și niveluri mai mici de leptină și au avut tendința de a cântări mai puțin la 20 de ani decât cele cu genotipuri variante combinate (Tabelul 1B). O stare de purtător pentru varianta −239A> G a fost asociată cu o tendință spre valori IMC maxime mai mici în comparație cu homozigotii de tip sălbatic (45,7 ± 0,7 vs. 47,7 ± 0,5 kg/m 2; P= 0,06).
Discuţie
Proteinele care leagă GATA sunt factori de transcripție a degetelor de zinc care reglementează expresia genelor, diferențierea și proliferarea celulară. 14 Demonstrăm că din diferitele proteine GATA 3, 4 și 6, GATA-4 a fost responsabil pentru legarea la site-ul GATA al promotorului MC3R. GATA-4 este exprimat în celulele hipofizare și hipotalamice, celulele gonadale și suprarenale 15,16 și MC3R din cortexul cerebral, talamus, hipocamp, hipofiză și hipotalamus. 17,18,19 Modelele de expresie pentru aceste două gene se suprapun astfel, sugerând că GATA-4 este un regulator al MC3R in vivo. Varianta −239A> G a fost asociată cu o tendință spre un IMC maxim mai mic (45,7 ± 0,7 vs. 47,7 ± 0,5 kg/m 2; P= 0,06) și a fost, de asemenea, un predictor independent al IMC maxim la obezi; analiză de regresie progresivă; R-increment pătrat = 0,019; P= 0,03), indicând faptul că poate exercita un efect modulator asupra dezvoltării greutății maxime.
Trei variante de gene MC3R detectate au fost frecvente la obezi, precum și la subiecții martor și, prin urmare, nu explică obezitatea morbidă. Mutația Thr6 → Lys este localizată în capătul N-terminal extracelular și Val81 → Ile în prima parte transmembranară a MC3R. În cazul obezilor morbid, variantele rare de aminoacizi au fost asociate cu niveluri mai ridicate de leptină și raporturi insulină - glucoză comparativ cu subiecții homozigoti pentru variantele comune. De asemenea, au raportat o tendință către IMC mai mare la 20 de ani. Hani și colab au constatat raporturi crescute insulină - glucoză la subiecții sănătoși cu varianta alelelor MC3R comparativ cu subiecții sănătoși cu alele de tip sălbatic. 20 În mod colectiv, aceste date indică faptul că variantele genei MC3R pot induce modificări subtile ale parametrilor legați de obezitate și că aceste modificări nu sunt limitate la subiecții obezi morbid.
Referințe
Wardlaw SL. Obezitatea ca boală neuroendocrină: lecții de învățat de la mutațiile receptorilor proopiomelanocortină și melanocortină la șoareci și bărbați. J Clin Endocrinol Metab 2001; 86: 1442–1446.
Considine RV, Sinha MK, Heiman ML, Kriauciunas A, Stephens TW, Nyce MR, Ohannesian JP, Marco CC, McKee LJ, Bauer TL & Caro JF. Concentrațiile serice de leptină imunoreactivă la omul cu greutate normală și obez. New Engl J Med 1996; 334: 292–295.
Huszar D, Lynch CA, Fairchild-Huntress V, Dunmore JH, Fang Q, Berkemeier LR, Gu W, Kesterson RA, Boston BA, Cone RD, Smith FJ, Campfield LA, Burn P & Lee F. Întreruperea țintită a receptorului melanocortinei-4 de la șoarece are ca rezultat obezitatea la șoareci. Celulă 1997; 88: 131–141.
Lee JH, Reed DR, Li W-D, Xu W, Joo E-J, Kilker RL, Nanthakumar E, North M, Sakul H, Callum B & Price RA. Scanarea genomului pentru obezitatea umană și legătura cu markerii în 20q13. Sunt J Hum Genet 1999; 64: 196–209.
Chen AS, Marsh DJ, Trumbauer ME, Frazier EG, Guan XM, Yu H, Rosenblum CI, Wongs A, Feng Y, Linhai C, Metzger JM, Strack AM, Camacho RE, Mellin TN, Nunes CN, Min W, Fisher J, Gopal-Truter S, MacIntyre DE, Chen HY și Van der Ploeg LHT. Inactivarea receptorului melanocortinei-3 de la șoarece are ca rezultat creșterea masei grase și reducerea masei corporale slabe. Nature Genet 2000; 26: 97–102.
- Marijuana medicală - o problemă sau o oportunitate de obezitate International Journal of Obesity
- Obezitatea pe termen lung și funcționarea fizică la vechii americani International Journal of Obesity
- Relația inversă între gambă și dimensiunea sânilor la femeile obeze International Journal of Obesity
- Este rezistența la leptină cauza sau consecința obezității induse de dietă International Journal of
- Obezitate morbidă după leziuni ale măduvei spinării o afecțiune care nu trebuie tratată European Journal of Clinical