Capitol: 5 nutrienți ca regulatori ai expresiei genetice
5
Nutrienții ca regulatori ai expresiei genetice
Universitatea de Stat din Michigan
Macronutrienții (carbohidrați, lipide și proteine) joacă un rol fundamental în creșterea și dezvoltarea mamiferelor, servind ca sursă de energie, precum și ca componente pentru sinteza componentelor structurale și reglatoare ale celulelor. Anumiți macronutrienți afectează, de asemenea, funcția celulară prin schimbarea hormonilor circulanți (de exemplu, reglarea glucozei de eliberare a insulinei din celulele β pancreatice). Știm de mulți ani că anumiți micronutrienți, precum vitaminele A și D, au efecte dramatice asupra expresiei genelor prin reglarea receptorilor intracelulari care leagă promotorii genelor specifice.
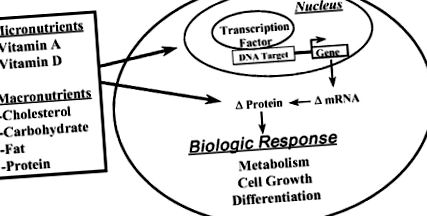
Noțiunea că macronutrienții sau metaboliții lor ar putea afecta și expresia genelor este un concept nou care a apărut în ultimul deceniu. Acum este clar că anumiți macronutrienți (sau metaboliții lor) afectează expresia genelor și duc la modificări ale abundenței proteinelor cheie care funcționează în etape critice în căile metabolice sau controlează diviziunea sau diferențierea celulară (Figura 5-1). Aici, descriu pe scurt modul în care trei macronutrienți (adică colesterolul, glucoza și grăsimile din dietă) afectează expresia genelor pentru a schimba metabolismul celular.
FIGURILE 5-1. Prezentare generală a nutrienților ca regulatori ai expresiei genelor.
REGULAREA COLESTEROLULUI
SREBP-urile sunt sintetizate ca
Proteine precursoare de 125 kd (pSREBP) legate de reticulul endoplasmatic și membranele golgi. Proteazele specifice digeră precursorul pentru a genera o formă de 65 kd de SREBP (nSREBP) care se deplasează către nucleul unde leagă SRE. Colesterolul reglează conținutul nuclear de
FIGURILE 5-2. Reglarea colesterolului asupra metabolismului colesterolului.
SREBP prin controlul etapei de proteoliză. Colesterolul controlează trecerea SREBP-urilor de la reticulul endoplasmatic la golgi. Când nivelurile de colesterol sunt scăzute, apare proteoliza pSREBP și generează nSREBP și se activează gene specifice reglate de SREBP. Pe măsură ce nivelul colesterolului intracelular crește, proteoliza SREBP scade ducând la o scădere a nSREBP și suprimarea transcripției genice. Astfel, colesterolul este un regulator de feedback pentru propria sinteză prin controlul conținutului nuclear al SREBP-urilor.
REGULAREA GLUCOZEI
Efectele glucozei asupra expresiei genice au fost atribuite în mod tradițional reglării eliberării insulinei din celula β pancreatică. Cu toate acestea, studiile cu hepatocite primare și celule β pancreatice au arătat că glucoza acționează independent de insulină pentru a controla expresia genelor. Când concentrațiile de glucoză cresc în celulele hepatice, enzimele cum ar fi piruvat kinaza și acetil-CoA carboxilaza cresc. Acest lucru duce la creșterea fluxului de metaboliți ai glucozei în sinteza acizilor grași. În celula β pancreatică, transcripția piruvat kinazei și a genei insulinei este indusă de glucoză. În ambele cazuri, glucoza stimulează transcrierea genelor specifice care măresc conținutul celular al ARNm și proteine corespunzătoare. Aceste gene reglate de glucoză conțin în promotorii lor elemente specifice de reglare cis, numite glucide (sau glucoză)
elemente de răspuns. Din păcate, identitatea factorilor de transcripție care leagă aceste elemente și mecanismul de reglare a glucozei acestor factori este necunoscută. Cu toate acestea, efectul general al acestui mecanism de reglare este de a promova absorbția glucozei din circulație, metabolismul său intracelular și asimilarea în lipide.
REGULAMENTUL ACIDULUI GRAS
Grăsimea alimentară și acizii grași rezultați au apărut ca regulatori majori ai expresiei genelor prin cel puțin trei mecanisme distincte: 1) ca precursori ai eicosanoizilor, 2) ca liganzi pentru receptorii nucleari și 3) ca un controlor al conținutului nuclear al SREBP1c.
Eicosanoidele sunt produse oxidative ale acidului arahidonic, un acid gras polinesaturat (PUFA). Aceste produse includ prostaglandine, leucotreine și tromboxani și implică două căi enzimatice, ciclooxigenaza (COX) și căile lipoxigenazei. Acidul arahidonic este eliberat din fosfolipidele membranei celulare prin acțiunea fosfolipazei A2 și este transformat în eicosanoizi prin COX sau lipoxigenaze. Aceste lipide bioactive, cum ar fi prostaglandina E2 (PGE2), sunt secretate din celule unde acționează local asupra receptorilor legați de proteina G asociați cu membrana plasmatică (GPR) asupra celulelor țintă (Figura 5-3). Acești receptori controlează nivelurile intracelulare de mesagerie secundară, cum ar fi AMPc și calciu liber, care, la rândul lor, controlează numeroase procese celulare prin schimbări în fosforilarea proteinelor. În consecință, legarea eicosanoidă de GPR stimulează rapid fosforilarea proteinelor, ducând la schimbări în metabolism, producerea de citokine și producerea de molecule de aderență. Unele dintre aceste efecte implică modificări în expresia genelor prin controlul activității factorilor specifici de transcripție, cum ar fi cFos, cJun, NFκB și cMyc.
Deficitul esențial de acizi grași este asociat cu o scădere a conținutului de fosolipide de acid arahidonic și producerea de eicosanoizi. Producția eicosanoidă este asociată cu răspunsuri inflamatorii și apărare a gazdei. Interesant este faptul că anumite grăsimi dietetice, în special acidul gras n-3 foarte nesaturat, sunt substraturi slabe pentru COX. Acest lucru duce la o scădere a producției de eicosanoizi, precum și la un răspuns inflamator diminuat.
O a doua cale pentru ca acizii grași să afecteze expresia genelor este prin reglarea unei familii de receptori nucleari numiți receptori activați cu proliferatorul peroxizomului (PPAR). Au fost identificate patru subtipuri PPAR (adică, α, β, γ1 și γ2). Aceștia sunt membri ai superfamiliei de steroizi a receptorilor nucleari care leagă motivele ADN, numit element de reglare a proliferatorului peroxizomului (PPRE). PPAR-urile leagă PPRE în asociere cu un al doilea receptor numit receptor retinoid X (RXR). PPAR-urile au fost identificate mai întâi ca ținte moleculare pentru proliferatorii de peroxizomi. Peroxisomii sunt organite subcelulare implicate în β-oxidarea acizilor grași și metabolismul colesterolului. Proliferatorii Peroxisomului sunt
FIGURA 5-3. Reglarea eicosanoidă a expresiei genelor.
o clasă structurală diversă de compuși hidrofobi care duc la proliferarea peroxizomală în ficatul rozătorilor. Cu toate acestea, anumite medicamente au ca ținte moleculare PPAR specifice. De exemplu, medicamentele hipolipemice pot viza PPARα, în timp ce PPARγ este ținta moleculară pentru medicamentele sensibilizante la insulină.
PPAR-urile au fost asociate cu reglarea expresiei genelor implicate în aproape toate fețele metabolismului acizilor grași (adică absorbția acizilor grași, legarea acidului gras, oxidarea acizilor grași și diferențierea adipocitelor). În plus, s-a raportat că acești receptori participă la inflamație, precum și la creșterea și diferențierea celulelor. Interesant este că acizii grași, metaboliții lor și anumite medicamente se leagă și activează PPARα, la fel ca un steroid care se leagă de un receptor de steroizi. De exemplu, în ficatul rozătorilor, medicamentele hipolipemice și acizii grași n-3 foarte nesaturați activează PPARα, ducând la o oxidare îmbunătățită a peroxizomului și a acidului gras microsomal. În preadipocite, tiazolidindionele și eventual eicosanoidele se leagă și activează PPARγ2. Acest lucru accelerează rata diferențierii adipocitelor și crește sensibilitatea la insulină a depozitului adipos.
În timp ce PPAR-urile au atras o atenție considerabilă ca ținte moleculare pentru reglarea expresiei genice a acizilor grași, se pare că acești factori nu sunt singurele ținte pentru efectele acizilor grași asupra genomului. Studii recente indică faptul că unul dintre SREBP, și anume SREBP1c, este deosebit de sensibil la reglarea acizilor grași. Mai multe rapoarte apărute în ultimii 2 ani au sugerat că SREBP1c joacă un rol major atât în lipogeneza hepatică, cât și în cea adipocitară, adică în sinteza acizilor grași și a trigliceridelor. Hrana pentru animale dietele suplimentate cu acizi grași polinesaturați suprima și ARNm care codifică SREBP1c
atât ca precursor, cât și ca forme nucleare ale SREBP1c. Deoarece SREBP1c este un factor cheie în transcrierea mai multor gene lipogene, declinul său duce la o reducere a expresiei genei lipogene și la lipogeneza de novo.
În mod evident, efectele acizilor grași asupra funcției celulare depășesc cu mult funcția de surse de energie și componente structurale ale membranelor. Acizii grași intră în celule, suferă metabolism și pot servi ca liganzi atât pentru receptorii de membrană, cât și pentru cei nucleari. Alternativ, acizii grași sau metaboliții lor pot regla abundența nucleară a SREBP1c, un factor cheie de transcripție în sinteza acizilor grași și triacilglicerolilor.
REZUMAT
Am evidențiat unele dintre progresele recente în reglarea macronutrienților în expresia genelor și am oferit detaliile necesare pentru a înțelege rolurile și efectele acestor nutrienți. În plus față de rolul lor ca sursă de energie, ca elemente de structură sau precursori ai moleculelor de semnalizare, macronutrienții au în mod clar efecte profunde asupra expresiei genelor. Această interacțiune nutrienți-genom se interacționează cu alte rețele de semnalizare pentru a permite integrarea controlului celular între aportul alimentar și mecanismele de reglare interne. Acesta reflectă un răspuns adaptiv, permițând celulelor să se adapteze la modificările tipului, cantității și duratei nutrienților ingerați pentru o creștere eficientă.
- An Artsy Education - RD combină nutriția și expresia creativă pentru a învăța cel mai bine studenții
- Forumul privind sănătatea și nutriția animalelor - „Funcționalitatea gastrointestinală Nutriție, biochimie,
- Îmbătrânirea și teoriile nutriționale, consecințele și impactul nutrienților SpringerLink
- Tracțiunea animalelor Anexa B Nutriția animalelor Calculul unei rații
- Nutriția animalelor și rațiile de hrănire Infonet Biovision Home