Abstract
fundal
Enzimele monoaminooxidazei (MAO) joacă un rol esențial în controlul catabolismului neurotransmițătorilor monoaminei și al aminei biogene și al comportamentului la om. Cu toate acestea, mecanismele care reglementează MAO sunt neclare. Sunt propuse mai multe proteine ale factorului de transcripție pentru a modula transcripția MAO genă, dar dovezile care susțin aceste ipoteze sunt controversate. Ne-am propus să investigăm mecanismul proteinelor regulatoare ale transcripției genelor asupra comportamentului indus de amfetamină. Am aplicat aptameri care conțin o secvență de legare a ADN-ului, precum și o secvență aleatorie (fără țintă) pentru a studia modularea nivelurilor de MAO induse de amfetamină și a hiperactivității la șoareci vii.
Metode
Am pretratat la șoareci C57black6 masculi adulți (Taconic Farm, Germantown, NY) (n ≥ 3 litere la un moment dat), cu vârsta de 2 până la 3 luni (23 ± 2 gm greutate corporală) cu aptameri ADN dublu catenar (ds) cu secvență specific activator protein-1 (5ECdsAP1), nuclear factor-kappa beta (5ECdsNF-kB), protein-1 special (5ECdsSP-1) sau cyclicAMP responsive element binding (5ECdsCreB) proteine, 5ECdsRan [o secvență aleatorie fără țintă], control AP-1 monocatenar (5ECssAP-1) (8 nmol ADN per kg) sau soluție salină (5 μl, injecție intracerebroventriculară [icv]) înainte de administrarea amfetaminei (4 mg/kg, ip). Apoi am măsurat și analizat activitățile locomotorii și nivelul activității MAO-A și MAO-B.
Rezultate
În starea patologică a expunerii la amfetamine, am arătat aici că pretratarea cu 5ECdsAP1 și 5ECdsNF-kB a inversat scăderea activității MAO-A (p
fundal
MAO catalizează dezaminarea oxidativă a monoaminelor endogene din corpul uman [8]. Există două izoforme ale MAO (MAO-A și MAO-B), localizate în membrana mitocondrială externă; acestea sunt distribuite în tot sistemul nervos, precum și în alte regiuni ale corpului, inclusiv în sistemul digestiv și circulator. Deficitul MAO-A rezultat din mutația în MAO-A gena poate provoca un set caracteristic de simptome (adică, întârziere mintală ușoară, comportament impulsiv antisocial și tulburări de dispoziție și de panică) denumite în mod colectiv sindrom Brunner [9]. Mutații la șoarece MAO gena conferă același fenotip [10]; prin urmare, șoarecele este un model animal ideal pentru experimentele preclinice care implică manipularea MAO-A.
Interesant este faptul că proteinele crescute ale factorului de transcripție AP-1 și NF-kB și activarea microglială sunt, de asemenea, asociații cunoscute în leziunile ischemice-reperfuzive, modelul tulburării Parkinson și infecția virală a imunodeficienței umane. Variație în MAO-A expresia a fost asociată cu polimorfisme în regiunea promotorului [11, 12], care s-a arătat, de asemenea, că conține cel puțin o secvență consens pentru legarea AP-1 și SP-1 [13-16]. Pentru a înțelege mai bine modul în care aceste două proteine TF pot influența activitatea MAO-A, am adoptat o abordare alternativă folosind un aptamer ADN dublu catenar (ds) cu secvențe consens pentru aceste proteine TF. Am demonstrat legarea specifică și sensibilă a aptamerilor dsAP1 și dsNF-kB la proteinele AP-1 și respectiv NF-kB [5], inclusiv o legare nulă la aptamerul AP-1 la șoareci cu proteine AP-1 mutante [ 17]. MAO-A se găsește în citoplasma neuronilor dopaminergici din SN, pars compacta, hipotalamus și VTA a creierului mediu. Deoarece neuronii mezolimbici ai căii de recompensă au proiecții axonale originare din VTA, am examinat antigenul MAO-A din regiunea VTA. Aici, corelăm efectul aptamerilor dsAP-1/NF-kB asupra activităților motorii cu expresia MAO-A în VTA a șoarecilor vii expuși la amfetamină.
Metode
Animale și locuințe
Toate procedurile utilizate în acest studiu au fost aprobate de Subcomitetul Spitalului General din Massachusetts pentru Cercetarea Îngrijirii Animalelor, comitetul instituțional pentru bunăstarea animalelor, în conformitate cu Ghidul serviciului de sănătate publică pentru îngrijirea și utilizarea animalelor de laborator. Șoareci masculi C57 negri adulți 6 (Taconic Farm, Germantown, NY) (n ≥ 3 litere la un moment dat), cu vârsta de 2 până la 3 luni (23 ± 2 gm BW), au fost ținuți în cuști pe așternutul de rumeguș, într-o cameră cu lumină controlată cicluri (12 h lumină/12 h întuneric), unde au avut acces gratuit la apă și au fost hrăniți cu chow de laborator standard. Șoarecii au fost instruiți, operați și testați în mod aleatoriu, cu un observator orbit care a efectuat testarea comportamentală.
ADNc scurt pentru proteina de legare AP1
ADN dublu catenar care conține secvența consens (notată cu litere mari) pentru proteina AP1 (5'-fluoreceină izotiocianat [FITC] -tccggcTGACTCAtcaagcg-3 'și 3'-aggccgACTGAGTagttcgc-biotin-5') au fost modificate prin fosforotioare pe care sulful o înlocuiește fără -unirea oxigenului pe legăturile fosfatice de trei, patru sau cinci nucleotide (litere mici) de la ambele capete (capace finale, EC). ADN-urile 5ECds suplimentare pentru factorii de transcripție includ SP1 (5ECdsSP-1, 5’-ctcgcCCCGCCccgatcgaa-biotină și 3’-gagcgAAAAggctagctt); factor nuclear kappa beta (5ECdsNF-κβ, 5’-agttgaAAAAGACTTTCCcaggc-biotină și 3 ’tcaactCCCCTGAAAGGgtccg) și proteina de legare a elementului de răspuns AMP ciclic (5ECdsCREB, 5’-ctctcTGACGTCAggcaat-biotină și 3’-gagagACTGCTGTccgtta). Când ADN monocatenar a fost utilizat ca martor, oligoADN a fost complet modificat prin fosforotioare.
Ambele fire ale secvențelor de legare a factorului de transcripție au fost amestecate la temperatura camerei, încălzite la 65 ° C timp de cinci minute și răcite lent pe un termociclator (1 grad picătură pe minut) la 20 ° C, la această temperatură au fost menținute timp de 30 de minute . ADN-uri scurte au fost depozitate în alicote de 0,05 ml (100 μM) la -20 ° C. Cu o oră înainte de utilizare, o alicotă a fost decongelată la temperatura camerei.
Livrare de aptameri 5ECdsDNA
Pentru studii de absorbție am anesteziat șoarecii cu O2 pur plus 2% halotan la un debit de 800 ml/min și am livrat aptameri dsDNA (8 nmol ADN pe kg, n = 4 fiecare) prin injecție cu icv [18, 19], o cale acceptată de livrare pentru administrarea substanțelor de contrast la rozătoare și primate neumane [20-22]. Am livrat 8 nmol ADN pe kg (icv) pentru studii de eliminare a proteinelor TF [23]. La trei ore după livrarea ADN, am administrat soluție salină (0,1 ml, i.p.) sau amfetamină (4 mg per kg, i.p.). Asimilarea diferitelor aptamer 5EDdsDNA a fost efectuată și validată așa cum s-a descris anterior; toate fotografiile au fost obținute cu același timp de expunere, folosind o cameră CCD Himatsu pe un microscop Olympus (Optical Analysis Corp, NH) [5].
Testarea comportamentului după amfetamină
Toți șoarecii au fost precondiționați timp de cel puțin 48 de ore în cușca de testare, care a fost echipată cu un detector de locomoție [21]. Am livrat dsDNA sau un control (icv) cu trei ore înainte de a administra amfetamină [23]. După livrarea amfetaminei șoarecii au fost așezați imediat în cuștile lor de acasă, unde le-am măsurat locomoția timp de 60 de minute.
Manipularea animalelor
Pentru a minimiza efectul stresului pe care animalele îl pot experimenta fiind în medii diferite înainte și în timpul stimulării amfetaminei, fiecare șoarece a fost găzduit în aceeași cușcă pe parcursul experimentelor, care a inclus o săptămână de obișnuință într-un mediu nou. Cu trei zile înainte de tratamentul prealabil al amfetaminei, am obișnuit toate animalele administrând o injecție zilnică de soluție salină (0,25 ml) și evaluând comportamentul ca linie de bază în fiecare zi. Fiecare cușcă de acasă a fost plasată direct în sistemul automat de înregistrare înainte ca animalele să primească injecția de amfetamină. Am împărțit animalele în două grupuri pentru a primi fie amfetamină, fie salină (vehicul), pretratare pentru zilele următoare. Șoarecii nu au fost plasați niciodată într-o nouă cușcă pentru evaluarea comportamentală așa cum este descris [21].
Expresia proteinei MAO
Imunohistochimie
Am administrat soluție salină, dsAP1 sau dsRan la șoareci prin injecție cu icv (2 μl) și amfetamină descrisă mai sus; probele de țesut au fost obținute de la șoareci la 90 de minute după amfetamină. Am măsurat expresia MAO-A folosind anticorpi policlonali de iepure împotriva MAO-A (1: 500, Novus Biologicals, Littleton, CO, NBP1-19796) folosind o procedură publicată anterior [19].
Western blot al expresiei proteinei MAO
analize statistice
Odată ce am obținut primul set de date, am calculat numărul de animale necesare în fiecare grup pentru a obține 95% putere pentru un p valoarea de 0,01 [21, 24]. Am calculat media și eroarea standard a mediei (SEM) din valorile medii din fiecare grup de animale și am comparat semnificația statistică a acestor valori folosind un t test (o coadă, tip II sau variantă egală, GraphPad Prism IV, GraphPad Software, Inc., San Diego, CA). A p valoarea mai mică de 0,05 a fost semnificativă statistic.
Rezultate
Amfetamina reduce nivelurile de antigen MAO-A
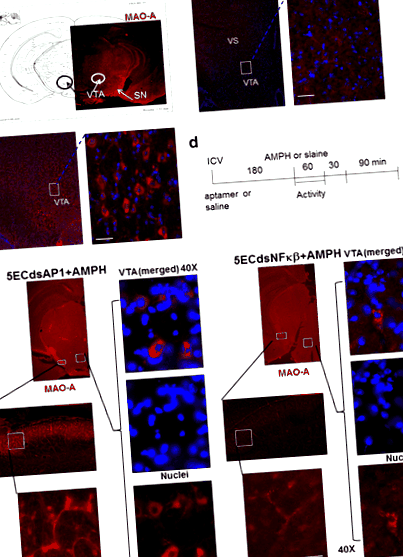
Am constatat prezența MAO-A în citoplasma neuronilor dopaminergici, care la șoarecii naivi sunt prezenți în principal în SN, pars compacta, hipotalamus și VTA a creierului mediu (cercuri, Fig. 1a). În creierele normale de șoarece fără amfetamină MAO-A este distribuit în soma și axonii neuronilor din VTA (casete, Fig. 1b). Tratamentul cu amfetamine a redus antigenul MAO-A în neuronii mezolimbici ai SN, striatului ventral și VTA (cutii, Fig. 1c).
Expresia antigenului MAO-A în SNC (fără injecție, panou A) la șoareci după soluție salină (100 μl, i.p., panou b) sau amfetamină (4 mg/kg, s.c., panou c) așa cum se arată în protocol d). Pretratarea AP-1 sau NF-kB Aptamer inversează deficitul MAO-A indus de AMPH (panou e). Șoarecii pretratați cu 5ECdsAP-1 sau 5ECdsNF-kB aptamer înainte de amfetamină (AMPH) prezintă o inversare a expresiei proteinei MAO-A. Proteina MAO-A este prezentă în citoplasma soma în VTA (zona tegmentală ventrală și axonii în SN (substantia nigra) și VS (striatul ventral) ale căii mezolimbice. Rezultatele imunohistochimiei au sugerat că 5ECdsAP-1 ar putea avea o diferență efectul temporal de la 5ECdsNF-kB a avut asupra inversării nivelului de antigen MAO-A
Pentru a investiga mecanismul prin care amfetamina reduce MAO-A, am aplicat aptameri cu secvențe consens pentru proteinele TF, precum și un aptamer cu secvență aleatorie (Ran), care nu are țintă intracelulară. Am aplicat 5ECdsAP1 sau 5ECdsNF-kB (n ≥ 2 fiecare grup) la șoareci conform protocolului prezentat în Fig. 1d. Șoarecii cu 5ECdsAP1 sau 5ECdsNF-kB pretratament aptamer au arătat o inversare a reducerii MAO-A indusă de amfetamină în soma neuronilor VTA, precum și în axonii neuronilor din SN (Fig. 1e).
Modularea factorului de transcripție proteină AP-1 pe activitatea MAO-A
Nivelurile MAO-A și MAO-B după amfetamină. Am pretratat șoareci cu 5ECdsAP1 aptamer înainte de aplicarea amfetaminei conform Fig. 1d; am colectat probe de țesut (n = 4 per grup) din VTA la 90 (60 + 30 min Fig. 1d) și 180 (60 + 30 + 90 Fig. 1d) minute după amfetamină. Am obținut proteine pentru cuantificarea Western blot a MAO-A (panel A) sau MAO-B (panou b) nivel (fragmente moleculare superioare) folosind Actina (fragmente moleculare inferioare) ca referință prezentată în benzile 2-4 (probe de 90 min) sau banda 5-6 (180 min). Proteina totală (10 μg) a fost utilizată pentru toate benzile, cu excepția benzilor 7 și 9. Blotul a fost dezbrăcat și utilizat pentru MAO-B după MOA-A. Banda 1: marker de dimensiune moleculară a scării de 10 KD; banda 2: 5ECdsAP1 (4 nmol/kg, icv, jumătate doză); benzile 3 și 5: soluție salină (2 μl, icv); benzile 4 și 6: 5ECdsAP1 (8 nmol/kg, icv, doză completă); benzile 7, 8, 9 sunt controale ale șoarecilor naivi (fără aptamer sau amfetamină (cu o cantitate crescândă de proteine: 5, 10 și, respectiv, 20 μg. Deoarece nu am observat nicio modificare a nivelului MAO-B (Panel b), am stabilit că 90 de minute după amfetamină este momentul optim pentru colectarea probelor VTA (panou A, banda 4) pentru compararea cantitativă a inversării nivelului MAO-A în țesutul VTA de la șoareci tratați cu aptameri 5EC de dsAP1, ssAP1, dsNF-kB, soluție salină (Sal), nimic (naiv), dsSP1, dsCREB și dsRan ( panou c). Aptamer 5ECdsAP1 a crescut MAO-A cu 60-100% (t test, afișat ca grafice în bare în panou c). N = numărul șoarecilor utilizați la test
5ECdsAP1 ameliorează activitatea motorie indusă de amfetamină
Am înregistrat și măsurat activitățile locomotorii folosind un sistem automat de înregistrare într-un mediu controlat [21]. Am comparat apoi efectul asupra activității motorii măsurând distanța parcursă de șoareci când li s-a administrat o doză minimă de 8 nmol/kg de 5ECdsAP1, 5ECdsNF-kB, 5ECdsRan sau soluție salină. Am observat că pretratamentul cu 5ECdsAP1 sau 5ECdsNF-kB aptamer a suprimat semnificativ o creștere indusă de amfetamină a activității locomotorii (p FIG. 3
Activitatea hiperlocomotorie indusă de amfetamină în grupul de control [pretratare cu 5ECdsRan (panouri A & b) sau salină (panouri c & d) înainte de amfetamină] este inversat la niveluri aproape normale atunci când șoarecii au fost pretratați cu 5ECdsAP1 (panouri A - d) sau 5ECdsNF-kB (panouri c & d). Un alt grup de control care nu este prezentat în acest grafic este pretratarea cu ssAP-1 (complet modificat cu fosforotioat). Mișcarea fină a motorului (mișcarea labei din față fără schimbarea poziției corpului) este afișată ca frecvență pe minut b). Distanța parcursă este dată la viteză (m pe oră (panou A) sau în centimetri la fiecare interval de 5 min c & d, care a fost calculată prin frecvența de ambulație (locomoția între fasciculele de lumină adiacente de 5 cm într-un minut) x 5 cm pe minut x 5 min pe interval de recodare. De obicei, șoarecii normali fără tratament au prezentat nu mai mult de 30 de frecvențe de ambulație pe minut în 15 minute după manipulare (linia de bază). Nu s-a găsit nicio semnificație între martor (soluție salină) și dsAP-1 al EC complet (panou c)
Discuţie
Studiul nostru demonstrează specificitatea aptamerului pentru MAO-A, deoarece 5ECdsAP1 nu a avut niciun efect asupra MAO-B. Această specificitate susține reglarea diferitelor căi de către acești doi izomeri [29, 30]. Deoarece aptamerul nostru concurează efectiv cu proteinele TF in vivo, care sunt forme hetero- și/sau homo-dimerice a cel puțin două familii de gene, aptamerul nostru oferă o abordare directă a degradării genelor a proteinelor și acționează ca un antagonist care modulează indirect nivelul de Proteina MAO-A.
Observația noastră că reducerea specifică a proteinei MAO-A a avut loc fără modificări semnificative ale ARNm MAO-A în VTA după expunerea la amfetamină, sugerează că activitatea de transcriere MAO nu este afectată direct de reglarea mediată de TF asupra genelor MAO, în special implicând SP-1 factor de transcripție [31]. Propunem că reducerea proteinei MAO-A poate fi rezultatul acțiunii catabolice la detoxifierea exogenă a amfetaminei, cel mai probabil ca o reacție inflamatorie legată de proteinele TF AP-1/NF-kB. Mai mult, absența creșterii semnificative a ARNm a MAO-A după amfetamină sugerează că reducerea MAO-A nu produce un semnal de feedback suficient de rapid pentru a crește transcripția MAO-A sau semnalul este blocat de un supresor. Ipoteza supresorului susține rezultatul dezacetilării histonei asupra promotorului genei c-fos [32]. Mecanismul propus aici poate explica, de asemenea, efectul nul pe care îl provoacă cocaina asupra hiperactivității observate în alte studii într-o tulpină de șoarece dublu transgenică care nu produce proteine active AP-1 TF [17].
Se știe că proteinele AP-1 și NF-NB TF cresc după expunerea la amfetamină. Un fenomen similar a fost descris în modelele animale de ischemie reperfuzie leziuni cerebrale, tulburări majore de dispoziție și/sau tulburare bipolară, boala Parkinson [33, 34] și la populațiile umane infectate cu infecții cu transmitere sexuală [4, 35, 36]. Stresul acut, caracterizat de anxietate (insomnie, iritabilitate, concentrație slabă, neliniște motorie), printre alte condiții umane, poate fi indus experimental la animale [37, 38]. Având în vedere că nivelurile reduse de proteine MAO-A sunt asociate cu stresul acut la om [39], ne gândim că aptamerul nostru 5ECdsAP1/5ECdsNF-kB poate fi aplicat, teoretic, pentru a corecta expresia anormală a MAO-A observată în timpul stresului acut.
OligoDNA antisens la familiile de gene Fos a redus proteina TF prin eliminarea mARN-ului respectiv [40, 41]. Am arătat că aptamerul 5ECdsAP-1 sau 5ECdsNF-kB vizează proteina TF AP-1 sau NF-kB pe o analiză de schimbare a gelului, respectiv [5]. Direcționarea specifică în creierele vii mediază RMN-ul proteinei TF intracelulare la doze mici și reduce degradarea enzimei MAO-A mediată de amfetamină și activitățile de stres la doze mari. Ultimul eveniment păstrează un nivel normal de MAO-A în neuronii dopaminergici mezolimbici susține că nivelul MAO-A este invers proporțional cu hiperactivitatea. Datele susțin asocierea activității MAO-A și a comportamentului normal [10]. Prin urmare, studiul nostru confirmă faptul că țintirea MR-CA utilizând aptameri poate avea un potențial de aplicare teranostică [21].
Nu am observat o inversare completă a hiperactivității indusă de amfetamină ca răspuns la dsAP1 cu fosforotioare totală (Fig. 2). Atribuim acest efect legării nespecifice a aptamerului de alte proteine, ceea ce diluează legarea efectivă de proteina țintă AP-1. O serie de studii efectuate de alți anchetatori au folosit aptameri pentru a viza diferite proteine TF [42-45]. În plus față de aptamerul 5ECdsCreb, 5ECdsSP-1 nu a reușit să moduleze nivelul MAO-A deoarece site-ul de legare SP-1 este absent din promotorul uman al MAO-A genă, dar poate fi găsită la promotorul omului MAO-B gene [31]. Am clarificat mecanismul prin care aptamerul atenuează hiperactivitatea asociată amfetaminei prin atenuarea MAO-A; prin urmare, metoda noastră oferă un mijloc suplimentar de evaluare a mecanismului și a traficului intern al acestor proteine TF in vivo.
Concluzie
Deoarece aptamerul poate fi etichetat cu nanoparticule de oxid de fier, aur sau coloranți fluorescenți, abordarea noastră poate fi aplicată pentru imagistica multimodală utilizând RMN (in vivo) și microscopie (ex vivo). Rezultatele sunt în concordanță cu raportul că 5ECdsAP1 sau 5ECdsNF-kB pot ghida în mod specific livrarea ADN-ului sau a agenților de contrast către celulele care conțin ținta proteinelor TF intracelulare unice. Mai mult, o injecție intracerebroventriculară, care ocolește direct bariera hematoencefalică, este acceptată clinic pentru administrarea agenților terapeutici, validând potențialul de translație al abordării noastre. Anticipăm că această tehnică va avea potențial pentru cercetări în timp real și longitudinale, atât în aplicații preclinice, cât și clinice.
- Un studiu privind cunoștințele nutriționale și comportamentul alimentar al copiilor din școlile elementare din Seul
- Dieta de detoxifiere de 10 zile folosind postul intermitent
- 5 gustări pentru a-ți crește nivelul de energie în funcție de piața prosperă
- Analiza gratuită a nivelului de favorabilitate a textului complet fără agronomie a climatului regiunii Sevastopol pentru
- Reconstrucția sânilor folosind propriile țesuturi (proceduri de clapă)