Beta lactoglobulina conține 22 leu, 10 Ile și 9Val (10 în varianta A) reziduuri în moleculă, făcându-l una dintre cele mai bogate surse alimentare cunoscute ale acestor aminoacizi și conferindu-i unele regiuni puternic hidrofobe.
Termeni asociați:
- Peptidă
- Cazeină
- Alfa-lactalbumină
- Enzime
- Proteine
- Proteine din zer
- Zer
- Proteine din lapte
- Kappa-Casein
- Albumină serică bovină
Descărcați în format PDF
Despre această pagină
Structura și stabilitatea proteinelor din zer
Patrick J.B. Edwards, Geoffrey B. Jameson, în Proteinele de lapte (ediția a doua), 2014
Β-lactoglobulină bovină 203
Structura moleculară a β-lactoglobulinei bovine 203
Structura β-lactoglobulinei bovine în soluția apoasă 205
Monomerul - echilibrul dimer al β-lactoglobulinei bovine în soluția apoasă 206
Studii ale β-lactoglobulinei bovine prin RMN la pH neutru 207
Dinamica β-lactoglobulinei bovine 208
Structurile β-lactoglobulinelor din alte specii 209
Legarea ligandului de β-lactoglobulină 210
Efectul temperaturii asupra β-lactoglobulinei bovine 213
Efectul presiunii asupra β-lactoglobulinei bovine 216
Efectul denaturanților chimici asupra β-lactoglobulinei bovine 218
Formarea fibrilară din β-lactoglobulina bovină 219
Lapte | Lapte echid
β-Lactoglobulina
β-Lg este proteina din zer majoră în laptele majorității mamiferelor, dar este absentă din laptele oamenilor, lagomorfilor, rozătoarelor și cămilelor. Au fost izolate două forme distincte de β-Lg ecvine, desemnate β-Lg I și II, care conțin 162 și respectiv 163 aminoacizi. Laptele cu asinină are, de asemenea, două forme de β-Lg, β-Lg I și II, deși un studiu recent asupra laptelui de măgar sicilian a constatat că> 23% dintre animale nu aveau β-Lg II. Au fost identificate două variante genetice ale asininei β-Lg I, A și B și trei variante genetice ale asininei β-Lg II, A, B și C. Β-Lg I ecvin are o masă moleculară de 18.500 Da și un pH izoelectric de 4.85, în timp ce β-Lg II ecvin are o masă moleculară de 18.262 Da, în ciuda faptului că are un aminoacid suplimentar și un pH izoelectric de 4.7. Spre deosebire de β-Lg bovin, β-Lg ecvin nu conține grupare sulfhidril liberă. În laptele rumegător, β-Lg există ca dimer la pH natural, în timp ce în laptele ecvin, β-Lg apare sub formă monomerică.
Metode analitice Biosenzori
Alergeni la lapte
β-Lactoglobulina (β-LG) este proteina principală din zer și este un alergen cunoscut. În mai multe țări, producătorii de alimente sunt obligați prin lege să furnizeze informații de etichetare cu privire la prezența sau absența β-LG. Un efect de absorbție îmbunătățită prin rezonanță (REA) al biosenzorului a fost utilizat într-un test sandwich imunologic, folosind anticorpi marcați cu clustere monodisperse de aur coloidal pentru β-LG. Acest sistem a fost capabil să detecteze β-LG la 100 ng ml -1. Un biosenzor SPR cu un test sandwich a permis detectarea nivelurilor de alergeni până la 1-12,5 μg g -1 .
Proteine din zer în formula pentru sugari
Mark A. Fenelon,. Eoin G. Murphy, în Whey Proteins, 2019
12.2.2.2 β-Lactoglobulină
Β-Lg nativ este rezistent la digestia gastrică in vivo, dar este digerat de enzimele intestinale. Cu toate acestea, unele β-Lg intacte pot fi detectate până la ileon (Sanchón și colab., 2018). Deoarece β-Lg nu este o componentă a laptelui uman, proteina intactă ar fi un alergen la o minoritate de sugari (Chatterton, Nguyen, Bering și Sangild, 2013) și îndepărtarea acestuia ar putea constitui baza unui IF hipoalergenic. Aportul de β-Lg intact stimulează producerea de celule Treg specifice pentru β-Lg în celulele plasture murine ale lui Peyer (Adel-Patient și colab., 2011). β-Lg este clivat în intestin și, comparativ cu β-Lg intact, β-Lg hidrolizat induce doar stimularea locală a Treg și nu stimulează un răspuns alergic la șoareci (Adel-Patient și colab., 2011).
Interesant este că β-Lg are o omologie de aminoacizi ridicată (83%) cu glicodelin A umană, o proteină implicată în menținerea sistemului imunitar feto-matern (Van Cong și colab., 1991). Glicodelina A suprimă toate celulele imune majore, inclusiv răspunsurile Th1 și Th2 (Ogge și colab., 2011; Scholz și colab., 2008). Mai mult, anticorpii monoclonali crescuți împotriva β-Lg reacționează încrucișat cu glicodelina A (Dutta, Mukhopadhyay, Roy, Das și Karande, 1998). Nu se știe dacă anticorpii naturali împotriva β-Lg reacționează încrucișat cu glicodelina A sau dacă β-Lg este asociat cu activități similare cu cele ale glicodelinei A (Chatterton și colab., 2013).
Volumul 2
Lei-Wen Xiang,. Ivanhoe K.H. Leung, în Enciclopedia chimiei alimentelor, 2019
Introducere
β-Lactoglobulina este o proteină globulară care este prezentă în laptele multor specii de mamifere, inclusiv rumegătoare, precum vacile și oile, și unele non-rumegătoare, cum ar fi porcii și caii (Kontopidis și colab., 2004; Sawyer și Kontopidis, 2000 ). β-Lactoglobulina este principala proteină din zer din lapte. De exemplu, reprezintă aproximativ 10% din totalul proteinelor din lapte din laptele de vacă. În mod surprinzător, β-lactoglobulina nu este prezentă în laptele oamenilor și al altor specii, inclusiv unele rozătoare, iepuri, cămile și lame.
Deși β-lactoglobulina a fost descoperită și izolată acum mai bine de 80 de ani, până în prezent, nu au fost atribuite în mod concludent proteine (Kontopidis și colab., 2002; Pérez și Calvo, 1995). S-a propus ca β-lactoglobulina să fie o proteină de transport pentru diferite molecule mici. Acestea includ, dar nu se limitează la, acizi grași, polifenoli și retinoli. Scopul acestei revizuiri este de a rezuma studiile recente privind legarea dintre β-lactoglobulină și liganzii săi propuși. Revizuirea se concentrează pe interacțiunile obligatorii cu β-lactoglobulina în structura sa nativă la temperaturi relevante fiziologic. Agregatele sau aductele induse de căldură între β-lactoglobulină și molecule mici sunt în afara scopului revizuirii.
Lapte | Lapte de primate
β-Lactoglobulina
β-Lg, principalul WP din laptele majorității speciilor, dar care este absent din laptele oamenilor, cobai, rozătoare și iepure, este o proteină foarte bine caracterizată (vezi PROTEINE DIN LAPT | β-Lactoglobulină). β-Lg a fost identificat în laptele babuinului, cinomolgului, Rhesus și maimuței vervet. Secvența celor 26 de resturi N-terminale ale β-Lg maimuței cynomolgus este omologă 54% cu β-Lg bovină. Babuin β-Lg apare ca trei variante genetice, A, B și C, cu pIs de 5,25, 5,45 și respectiv 5,75. Conține 168 reziduuri de aminoacizi, comparativ cu 162 pentru proteina bovină; diferența se datorează inserției a opt aminoacizi între reziduurile 61 și 62 (numerotarea bovinelor) și ștergerii reziduurilor 109 și 112. Are o masă aparentă (prin SDS-PAGE) de 20 750 Da (aproximativ același MW ca Rhesus β-Lg), comparativ cu 18 281 Da pentru bovin β-Lg. Babuin β-Lg este mai asemănător cu proteina glicodelin umană (un omolog glicozilat de β-Lg găsit în uterul omului și babuin și se crede că are un rol protector deoarece embrionul este încorporat) decât este cu β-LgA bovină.
β-Lg pentru unele specii are un grup liber -SH, în timp ce cele ale altora nu; unele există ca dimer la pH neutru, altele nu ((aceste caracteristici nu sunt înrudite) (vezi PROTEINELE LAPTULUI | β-Lactoglobulina). Aceste proprietăți nu au fost raportate pentru primatul β-Lg.
Omologia (%) babuinului β-Lg cu proteina corespunzătoare din alte specii este ovină, 51,3; ren, 51,8; porc, 48,7; cal, 55,6; pisică, 56,8; și delfin, 54,9 (vezi PROTEINE DIN LAPTE | β-Lactoglobulină).
Nu suntem conștienți de rapoarte despre prezența β-Lg în laptele Marilor Maimuți. Având în vedere absența acestei proteine din laptele uman, este de așteptat ca acesta să lipsească și din laptele maimuțelor neumane. Este de dorit extinderea gamei de primate pentru care este cunoscut statutul de β-Lg.
Nanofibrile de beta-lactoglobulină pentru încapsularea ingredientelor alimentare
Abstract
β-Lactoglobulina (β-LG) constituie aproximativ 10% din toate proteinele din lapte devenind proteina principală din zer. Nanofibrilele β-LG (β-LG-N) au fost preparate pe baza diverselor procese fizico-chimice sau enzimatice. Mai ales în ultimele două decenii, fabricarea lor de β-LG-N a fost investigată pe scară largă. Influența tratamentelor termice și a parametrilor experimentali precum enzimele, sărurile și pH-ul sunt acum bine caracterizate. Datorită interacțiunilor dintre reziduurile proteinelor și diferitele ingrediente alimentare, β-LG-N a servit ca instrumente utile în încapsularea și stabilizarea ingredientelor alimentare. Utilizarea β-LG-N în producția de alimente ar putea prezenta mai multe funcționalități, deoarece acestea sunt comestibile, dispersabile în apă, cu proprietăți emulsionante bune și pot furniza bioactivi. Diversi factori, cum ar fi lungimea fibrilei, concentrația, flexibilitatea și valoarea pH-ului afectează proprietățile lor emulsionante. Aici, va fi revizuită încapsularea compușilor activi în sistemele β-LG-N, testarea stabilității lor digestive și a stocării, precum și a caracteristicilor de eliberare.
Baza structurală pentru polimorfismul fibrilelor asemănătoare amiloidelor β-lactoglobulinei
Corianne C. van den Akker,. Gijsje H. Koenderink și Bio-nanoimaging, 2014
De ce β-lactoglobulina?
β-Lactoglobulina (β-lg) este principala proteină din zer și reprezintă 0,2-0,4% (g/v) din lapte degresat [1]. În starea nativă, β-lg are o structură predominant β-sheet (Fig. 31.1) [2]. La încălzire, este capabil de auto-asamblare într-o varietate de structuri supramoleculare. Fibrele din gelurile cu catenă fină care se formează la incubarea sub punctul izoelectric (pH 5,1) [3], au fost identificate ca fibrile amiloide [4]. β-lg are o mare importanță pentru industria laptelui, similar cu alte proteine din zer și este deosebit de util pentru controlul texturii unei varietăți de alimente [5-7]. În același timp, capacitatea sa de structurare reglabilă face din β-lg o țintă interesantă pentru știința materialelor [8]. În plus, β-lg a devenit un model proteic major pentru investigarea mecanismului de auto-asamblare a fibrilelor amiloide [2,3,9]. Deși cinetica de formare și morfologia fibrilelor amiloide β-lg au fost studiate pe larg, structura secundară a fibrilelor nu a fost încă complet elucidată. Aici vom analiza cunoștințele acumulate până acum cu privire la relația dintre morfologia fibrilelor și structura moleculară subiacentă a amiloizilor β-lg printr-o varietate de tehnici experimentale.
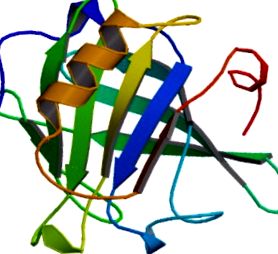
FIGURI 31.1. Structura β-lactoglobulinei bovine din spectroscopie RMN heteronucleară. Structura în stare nativă monomerică cuprinde un β-butoi continuu antiparalel cu opt catene și un helix α major.
Retipărit cu permisiunea lui Kuwata și colab. (Protein Science 1999) [10] .
Lapte: o prezentare generală
β-Lactoglobulina
β-Lactoglobulina (β-Lg) reprezintă ∼50% din proteinele din zer, ∼12% din totalul proteinelor, din laptele bovin. Este o proteină globulară tipică care a fost caracterizată foarte bine. Literatura extinsă a fost revizuită, printre altele, de Sawyer (2003; 2013) și Creamer și colab. (2011) .
β-Lg este principala proteină din zer din laptele bovinelor, bivolilor, ovinelor și caprinelor, deși există ușoare diferențe între specii. Inițial, s-a considerat că β-Lg apare doar în laptele rumegătoarelor, dar se știe acum că o proteină similară apare în laptele multor alte specii, inclusiv scroafă, iapă, cangur, delfin și lamantin. Cu toate acestea, β-Lg nu apare în laptele uman, șobolan, șoarece, cobai, cămilă, lamă sau alpaca, în care α-La este principala proteină din zer.
Β-Lg bovin constă din 162 resturi de aminoacizi per monomer, cu un MW de ∼18 kDa; secvența sa de aminoacizi și cea a altor câteva specii au fost stabilite. Punctul său izoelectric este ∼pH 5.2. Conține două legături disulfurice intramoleculare și un mol de cisteină per monomer. Cisteina este deosebit de importantă deoarece reacționează, după denaturare termică, cu disulfura intermoleculară a case-cazeinei și afectează semnificativ coagularea cheagului și stabilitatea la căldură a laptelui. De asemenea, este responsabil pentru aroma gătită a laptelui încălzit. Unelor β-Lgs (de exemplu, porcine) le lipsește o grupare sulfidril. Au fost identificate douăsprezece variante genetice ale β-Lg bovine, cele mai frecvente fiind A și B. Polimorfismul genetic apare și la β-Lg al altor specii.
β-Lg este o proteină foarte structurată: în intervalul de pH 2-6, 10-15% din moleculă există ca α-helici, 43% ca β-foi și 47% ca structuri neordonate, inclusiv β-viraje; foile β apar într-un calice de tip β-butoi. Molecula are o structură globulară foarte compactă. Fiecare monomer există aproape ca o sferă, măsoară aproximativ 3,6 nm în diametru și există ca dimer, MW ∼36 kDa, în domeniul pH-ului 5,5-7,5, ca monomer
pH 7,5 și ca tetramer (MW, ~ 144 kDa) în intervalul de pH 3,5-5,5. Porcinele și alte β-Lg-uri care nu au tiol liber nu formează dimeri, proprietate care probabil nu se datorează absenței unui grup tiol.
β-Lg este foarte rezistent la proteoliză în starea sa nativă; această caracteristică sugerează că funcția sa principală nu este nutrițională. Poate avea unul sau ambele roluri biologice:
Se leagă retinolul (vitamina A) într-un buzunar hidrofob, îl protejează de oxidare și îl transportă prin stomac la intestinul subțire unde retinolul este transferat către o proteină care leagă retinolul, care are o structură similară cu β-Lg. Nu este clar cum retinolul este transferat de la miezul globulelor de grăsime, unde apare în lapte, la β-Lg și de ce unele specii nu au această proteină. β-Lg poate lega multe molecule hidrofobe și, prin urmare, capacitatea sa de a lega retinolul poate fi incidentală. β-Lg este un membru al familiei lipocalinelor, toate având proprietăți de legare (Akerstrom și colab., 2000).
Prin capacitatea sa de a lega acizii grași, β-Lg stimulează activitatea lipazei, care poate fi cea mai importantă funcție fiziologică a acesteia.
β-Lg este cea mai alergenică proteină din laptele bovin pentru sugari umani și există interes în producerea produselor din proteine din zer fără β-Lg pentru utilizare în formulele pentru sugari. β-Lg are proprietăți foarte bune de termogelare și determină gelificarea concentratelor de proteine din zer (WPC).
- Agent Antiobezitate - o prezentare generală Subiecte ScienceDirect
- Aconitum - o prezentare generală a subiectelor ScienceDirect
- Boala tractului biliar - o prezentare generală Subiecte ScienceDirect
- Apiterapie - o prezentare generală a subiectelor ScienceDirect
- Mâncarea cu lucernă - o prezentare generală Subiecte ScienceDirect