Jieru E. Lin
1 Departamentul de farmacologie și terapie experimentală, Divizia de farmacologie clinică, Universitatea Thomas Jefferson, Philadelphia, PA
Francheska Colon-Gonzalez
1 Departamentul de farmacologie și terapie experimentală, Divizia de farmacologie clinică, Universitatea Thomas Jefferson, Philadelphia, PA
Erik Blomain
1 Departamentul de farmacologie și terapie experimentală, Divizia de farmacologie clinică, Universitatea Thomas Jefferson, Philadelphia, PA
Gilbert W. Kim
1 Departamentul de farmacologie și terapie experimentală, Divizia de farmacologie clinică, Universitatea Thomas Jefferson, Philadelphia, PA
Amanda Aing
1 Departamentul de farmacologie și terapie experimentală, Divizia de farmacologie clinică, Universitatea Thomas Jefferson, Philadelphia, PA
Brian Stoecker
1 Departamentul de farmacologie și terapie experimentală, Divizia de farmacologie clinică, Universitatea Thomas Jefferson, Philadelphia, PA
Justin Rock
1 Departamentul de farmacologie și terapie experimentală, Divizia de farmacologie clinică, Universitatea Thomas Jefferson, Philadelphia, PA
Adam E. Snook
1 Departamentul de farmacologie și terapie experimentală, Divizia de farmacologie clinică, Universitatea Thomas Jefferson, Philadelphia, PA
Tingting Zhan
2 Departamentul de farmacologie și terapie experimentală, Divizia de biostatistică, Universitatea Thomas Jefferson, Philadelphia, PA
Terry M. Hyslop
3 Departamentul de Biostatistică și Bioinformatică, Universitatea Duke, Durham, NC
Michal Tomczak
4 Divizia de Gastroenterologie, Hepatologie și Endoscopie și Institutul de Cercetări Biomedice, Spitalul Brigham și Femeile și Centrul de Boli Digestive Harvard, Harvard Medical School, Boston, MA
Richard S. Blumberg
4 Divizia de Gastroenterologie, Hepatologie și Endoscopie și Institutul de Cercetări Biomedice, Spitalul Brigham și Femeile și Centrul de Boli Digestive Harvard, Harvard Medical School, Boston, MA
Scott A. Waldman
1 Departamentul de farmacologie și terapie experimentală, Divizia de farmacologie clinică, Universitatea Thomas Jefferson, Philadelphia, PA
Date asociate
Abstract
Introducere
Materiale și metode
Modele animale
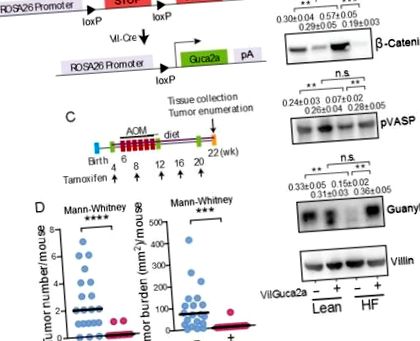
(A) Construcție pentru expresia transgenică a guanilinei în intestin. Expresia transgenică de guanilină (B) a salvat semnalizarea GUCY2C reducând disfuncția epitelială indusă de o dietă HF și (C-D) a eliminat aproape complet tumorigeneză indusă de o dietă HF și AOM în colonii VilGuca2a +, dar nu a controlat șoarecii VilGuca2a-. Rezultatele imunoblot reprezintă media ± SEM a 5 șoareci. VilGuca2a (-), șoareci C57BL/6 care exprimă vil-Cre-ER T2 (guanylin wild type); Șoareci VilGuca2a (+), C57BL/6 care exprimă vil-Cre-ER T2 și care transportă transgenul guanylin.
Genotipare
Genotipul Gucy2c a fost confirmat prin PCR cu primeri: înainte: 5'-AGGTCATGACGTCACTGCTGGGCC-3 '; invers: 5'-TGTCCAGTCCTTCCTCCACAG-3 '; neomicină: 5'-GGTGGGCTCTATGGCTTC-3 '(7). Genotipul ROSA-STOP flox -Guca2a a fost confirmat prin PCR cu primeri: înainte: 5'-CCGCCGTTGTTGTTATTGTAG-3 '; invers: 5'-GTTGTGGTG ATAGGTGGCAAG-3 '. Genotipul Villin-Cre-ER T2 a fost confirmat prin PCR cu primeri: înainte: 5'-GAAAATGCTTCTGTCCGTTTG-3 '; invers: 5'-ATTGCTGTCACTTGGTCGTG-3 '(9).
Modelul tumorigenezei colorectale
Pentru șoareci Gucy2c +/+ (Lean, HF) și Gucy2c -/- (Lean), azoximetan (AOM 8 mg/kg; Sigma, St. Louis, MO) a fost administrat șoarecilor (vechi de 6 săptămâni) prin injecții intraperitoneale săptămânal pentru 6 săptămâni. Tumorile au fost enumerate și dimensiunile lor au fost cuantificate la 8 săptămâni după ultima doză de AOM sub un stereomicroscop prin disecție prin analiză orbită. Sarcina tumorală pe animal a fost calculată ca suma suprafeței (diametrul 2) a tumorilor individuale (7). Pentru modelul ROSA-STOP flox -Guca2a-vil-Cre-ER T2 și controalele corespunzătoare (Fig. 4c), șoarecii erau la dieta HF începând cu vârsta de 4 săptămâni. Tamoxifen (20 mg/kg IP) a fost administrat la fiecare 4 săptămâni pentru a impune expresia guanilinei începând de la 4 săptămâni până la enumerarea tumorii. Au fost administrate șase doze de AOM (10 mg/kg) săptămânal începând cu vârsta de 5 săptămâni. Tumorile au fost enumerate și dimensiunile lor au fost cuantificate la vârsta de 22 săptămâni (6, 7). Pentru șoarecii Gucy2c +/+ (Lean, HC), AOM (12 mg/kg) a fost administrat șoarecilor (cu vârsta de 6 săptămâni) săptămânal timp de 6 săptămâni. Tumorile au fost enumerate și dimensiunile lor au fost cuantificate la 12 săptămâni după ultima doză de AOM. Dozele de AOM în diferite modele de dietă au fost stabilite în studii pilot pentru a asigura cel puțin
50% incidență tumorală în cohorte experimentale.
Țesuturile umane
Eșantioanele de mucoasă colonică distală umană au fost obținute de la pacienții supuși unei intervenții chirurgicale în conformitate cu un protocol aprobat de Consiliul de revizuire instituțională al Universității Thomas Jefferson (nr. Control 01.0823).
Cultura celulară și infecția cu lentivirus
Pregătirea țesuturilor
Straturile mucoasei din colonele distale de șoarece au fost înghețate imediat în azot lichid și depozitate la -80 ° C până la analiza proteinei sau ARN-ului. Pentru imunocolorare, probele au fost fixate peste noapte în 4% formaldehidă la 4 ° C, deshidratate printr-o serie de spălări gradate de acetonă și etanol și încorporate în parafină (6, 7). S-au montat secțiuni de parafină (5 μm) (5 secțiuni/lamă/șoarece) pentru imunohistochimie sau colorare imunofluorescentă (7).
Analiza ARN
ARN-ul total a fost izolat de RNeasy Mini Kit (Qiagen, Nr. Catalog 74104) conform instrucțiunilor producătorului. RT-PCR în doi pași a fost efectuat folosind reactivi de transcripție inversă TaqMan ® (Life Technologies, catalog nr. N8080234) și mix master universal TaqMan ® (Life Technologies, catalog nr. 4440038) pentru a efectua RT-PCR cantitativ folosind primer/sonda GUCA2A pentru Testele de expresie genică TaqMan ® (Mm00433863_m1, Hs 00157859_m1) într-un sistem de detectare a secvenței ABI 7000 (Biosystems aplicat) (7, 12). Expresia relativă a fost calculată utilizând metoda 2 −ΔΔCT utilizând villin1 (Life Technologies, Mm00494146_m1, Hs00200229_m1) ca control intern (9).
Imunomarcarea și imunofluorescența
Analize imunoblot
Proteina a fost extrasă și omogenizată în reactiv M-PER (Thermo Fisher Scientific, nr. Catalog 78501) suplimentat cu inhibitori de protează și fosfatază (Roche Applied Science, nr. 05892970001 și 04906837001), și apoi supus SDS-PAGE și imunoblotare folosind anticorpi după cum urmează: actină (Cell Signaling, 4967S), Bip (Cell Signaling, 3177S), β-catenin (Cell Signaling, 8480S), CHOP (Cell Signaling, 2895S), cyclin D1 (Cell Signaling, 2978S), eIF2α (Cell Signaling, 9722S), GUCA2A (LSBio, LS-C3244, LS-C166741), hexokinază II (Cell Signaling, 2106S), Phospho-AKT (Cell Signaling, 9271S), Phospho-eIF2α (Cell Signaling, 3597S), γ-H2AX Signaling, 2577S), Phospho-VASP (Cell Signaling, 3114S), villlin-1 (Cell Signaling, 2369S). Anticorpii secundari provin de la Santa Cruz Biotechnology. Intensitatea colorării benzilor specifice cuantificate prin densitometrie (Kodak) a fost normalizată la cea pentru villin-1. Imunocomplexele au fost detectate de substratul SuperSignal West Dura (Thermo Fisher Scientific, nr. 37071). Intensitatea relativă medie reflectă media de 5
15 animale individuale pe cohortă sau ≥3 experimente independente cu celule.
Curbele de creștere și aportul de alimente
Cinci șoareci au fost adăpostiți împreună, fiecare șoarece a fost cântărit săptămânal și au fost urmăriți cel puțin 20 de șoareci din fiecare cohortă. În experimentul de dietă restricționată ob/ob, 3 șoareci au fost adăpostiți împreună și 6 șoareci din fiecare cohortă au fost cântăriți. Pentru consumul de alimente, șoarecii au fost separați în cuști individuale cu podele din plasă de sârmă și li s-a dat o cantitate pre-cântărită de chow în fiecare zi. Toți șoarecii au primit acces ad libitum la apă pe durata experimentului. Consumul de alimente a fost măsurat zilnic timp de 7 zile pentru a stabili aportul mediu de alimente.
Analize statistice
(A) ARNm Guanylin în colonul uman se corelează invers cu IMC. (B) ARNm Guanylin în colonii de la șoareci cu diete bogate în grăsimi (HF) sau slabe. (C) Pierderea guanilinei la șoareci la dieta HF reduce la tăcere GUCY2C, crescând disfuncția epitelială. (D) Guanylin (verde), β-catenină (roșu) și (E) Ki67 în colonii de la șoareci din dietele Lean și HF. (F) Disfuncția epitelială a fost comparată la șoareci de tip sălbatic GUCY2C (+/+) și șoareci deficienți (-/-) din diete Lean și HF. (G) Numărul tumorii și (H) sarcina la șoareci GUCY2C (+/+) și (-/-) pe dieta Lean sau HF care primesc AOM. Rezultatele imunoblot reprezintă media ± SEM a 5 șoareci.
Paradigma stabilită sugerează că tumorigenezele asociate cu obezitatea indusă de dietă reflectă reprogramarea mediului endocrin, adipokinic și inflamator (14-16). Cu toate acestea, o dietă bogată în carbohidrați (HC) care a crescut aportul caloric
(A) Dietele bogate în carbohidrați (HC) și HF au suprimat ARNm guanilină în colon. (B) Dieta HC a redus semnalizarea guanilinei și GUCY2C, crescând disfuncția epitelială. (C) Șoarecii hrăniți cu HC, în comparație cu dieta slabă, sunt mai sensibili la tumorigeneză de colon indusă de AOM. (D) Dieta HF a redus semnalizarea guanilinei și GUCY2C, crescând disfuncția epitelială, la șoareci rezistenți la obezitatea indusă de dietă (HF-R). (E) ob/ob pe o dietă cu restricție calorică (10 Kcal/zi per șoarece) a menținut expresia guanilinei și semnalizarea GUCY2C, fără disfuncție epitelială. (F) Efectele dietei asupra expresiei guanyaninei, semnalizării GUCY2C și disfuncției epiteliale au fost inversate prin trecerea șoarecilor pe o dietă HF timp de 20 săptămâni la o dietă Lean timp de 4 săptămâni (HF-Lean). Rezultatele imunoblot reprezintă media ± SEM a 5 șoareci.
(A) Dietele bogate în calorii au indus transcrierea (A) și traducerea (B) a markerilor de stres ER în colon la șoarecii C57BL/6. (C-D) stresul ER indus de 2,5 μg/ml tunicamicină (TM) sau 500 nM thapsigargin (TSG) a crescut markerii stresului ER și a suprimat guanilina în celulele Caco2. (E-F) Administrarea IP de 1 mg/kg TM la șoareci C57BL/6 a crescut markerii stresului ER și a suprimat expresia guanyaninei în colon. (G-H) Coloanele de la șoareci Xbp1 ΔIEC au prezentat o expresie redusă a guanilinei (verde) comparativ cu șoarecii de tip sălbatic (Xpb fl/fl) [β-catenină (roșu)]. (I-J) TUDCA (150 mg/kg prin gavaj oral timp de 12 zile) a ameliorat stresul ER și a salvat expresia guanilinei la șoareci C57BL/6 pe o dietă HF. (K) Inhibarea PERK de către GSK2606414 a ameliorat stresul ER și a restabilit expresia guanilinei în celulele Caco2 tratate cu TM. (L) PERK siARN a restabilit expresia guanilinei în celulele HEK 293 tratate cu 1,0 μg/ml TM. Rezultatele in vitro reprezintă media ± SEM a trei experimente independente efectuate în triplicat. Rezultatele in vivo reprezintă media ± SEM a 5 șoareci, cu excepția cazului în care se indică altfel.
Observațiile prezente sugerează că tumorogeneza colonului asociată cu obezitatea reflectă suprimarea expresiei guanilinei, care reduce la tăcere supresorul tumorii GUCY2C prin inducția reversibilă a caloriilor dependente de stresul ER și răspunsul proteic desfășurat în celulele epiteliale ale colonului. Această ipoteză a fost testată direct folosind un model genetic de șoarece în care expresia forțată a guanilinei este indusă selectiv în celulele epiteliale intestinale (Fig. 4A) (7). Inducerea expresiei transgenice de guanilină a depășit suprimarea endogenă a guanilinei și reducerea GUCY2C, reconstituind fosforilarea VASP și normalizând nivelurile de β-catenină la șoareci pe o dietă HF (Fig. 4B). Important, prevenirea pierderii expresiei guanilinei și menținerea semnalizării GUCY2C (Fig. 4C) a eliminat aproape complet tumorigenezele intestinale asociate cu obezitatea indusă de o dietă HF (Fig. 4D).
Discuţie
- Oamenii de știință descoperă modul în care dieta bogată în grăsimi determină creșterea cancerului colorectal
- Cromozomi pulverizați legați de cancer
- N-3 Dieta îmbogățită cu PUFA întârzie apariția cachexiei cancerului la șobolan cu carcinoză peritoneală
- Vindecarea sunetului vă poate ajuta muzica să vă vindecați de cancer Sănătatea mea Junky Blog Site
- Obezitate - Mai rău decât educația pentru păstrarea cancerului Parteneriat ACTIV pentru combaterea bolilor cronice