Corespondență cu: Nimer Assy, MD, Unitate hepatică, Centrul Medical Ziv, PO Box 1008, Safed, 13100, Israel. [email protected]
Telefon: + 972-4-6828441 Fax: + 972-4-6828442
Abstract
INTRODUCERE
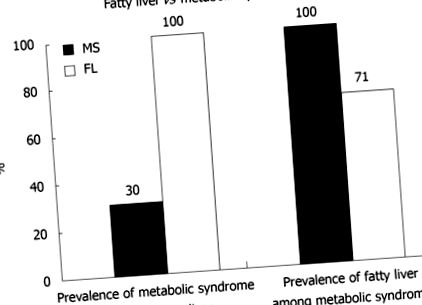
Boala ficatului gras nealcoolic (NAFLD) este o problemă semnificativă de sănătate care afectează 20% -30% din populația adultă [1]. NAFLD poate evolua către steatohepatita nealcoolică (NASH), un ficat gras cu hepatită. Această formă de leziuni hepatice prezintă un risc de 20% -50% pentru fibroză progresivă, 30% risc pentru ciroză și 5% risc pentru carcinom hepatocelular [2-4]. Deși mecanismele care stau la baza progresiei bolii rămân neclare, se consideră că rezistența la insulină și inflamația legată de obezitate joacă un rol cheie, alături de posibili factori genetici, dietetici și de stil de viață. Incidența crescândă a obezității în generația actuală este asociată cu multe complicații de sănătate, în plus față de NAFLD [5,6]. Acestea includ boli cardiovasculare, diabet, hiperlipidemie și hipertensiune. Această constelație este recunoscută ca sindrom metabolic. 70% dintre pacienții cu ficat gras au sindrom metabolic și 30% dintre pacienții cu sindrom metabolic au ficat gras [7] (Figura 1.1).
masa 2
Calorii și conținut de zahăr în diferite băuturi răcoritoare
| Băuturi răcoritoare: conținut de calorii (număr de calorii) | Băuturi răcoritoare: conținut de zahăr (număr de lingurițe de zahăr) | ||||||
| 12- oz. Poate sa | 20 oz. Sticla | 64 oz. Cupa mare | 12- oz. Poate sa | 20 oz. Sticla | 64 oz Cupa mare | ||
| Sunkist | 190 | 325 | 1040 | Felie de portocala | 11.9 | 19.8 | 63,5 |
| Roua muntelui | 165 | 275 | 880 | Soda portocalie menajeră menajeră | 11.2 | 18.7 | 59.7 |
| Dr. Piper | 160 | 250 | 800 | Roua muntelui | 11.0 | 18.3 | 58.7 |
| Pepsi | 150 | 250 | 800 | Berea de rădăcină a lui Barq | 10.7 | 17.8 | 57.1 |
| Coca-Cola clasic | 140 | 250 | 800 | Pepsi | 9.8 | 16.3 | 52.3 |
| Sprite | 140 | 250 | 800 | Uda | 9.5 | 15.8 | 50,7 |
| 7-Sus | 140 | 250 | 800 | Dr. Piper | 9.5 | 15.8 | 50,7 |
| 7-Sus | 9.3 | 15.5 | 49.6 | ||||
| Coca-Cola clasic | 9.3 | 15.5 | 49.6 | ||||
| Sprite | 9.0 | 15.0 | 48.0 | ||||
Îndulcitorii adăugați în SD obișnuită sunt o componentă importantă a dietei noastre, reprezentând 318 kcal din aportul alimentar sau 16% din totalul aportului de calorii [17]. HFCS obținut prin izomerizarea enzimatică a glucozei în fructoză a fost introdus ca HFCS-42 (42% fructoză) și HFCS-55 (55% fructoză) în 1967 și, respectiv, 1977 și a deschis o nouă frontieră pentru industria îndulcitorilor și a SD.
Aspartamul și caramelul (colorant) sunt de asemenea utilizate ca îndulcitori în industria băuturilor, în principal în dieta SD [18]. Aspartamul este un compus aminoacid care este de aproximativ 160 de ori mai dulce decât zahărul. Aspartamul este absorbit din intestin și metabolizat de ficat pentru a forma fenilalanină, acid aspartic și metanol. Aspartamul poate contribui la creșterea în greutate, obezitate, rezistență la insulină și diabetul zaharat de tip 2 [18]. Recent, Brown și colab. [19] au arătat că îndulcitorii artificiali pot declanșa secreția de peptidă asemănătoare glucagonului (GLP) -1 de către tractul digestiv și, astfel, pot reduce apetitul și aportul de calorii.
Caramelul se realizează prin tratamentul termic atent controlat al carbohidraților, în general în prezența acizilor și a alcalinilor, într-un proces numit caramelizare. Băuturile răcoritoare conțin colorant caramel, care este bogat în produse finale avansate de glicație care cresc rezistența la insulină și inflamația [9,10]. FDA a stabilit 200 mg de caramel pe kg de greutate corporală ca un aport zilnic acceptabil.
Dietele bogate în fructoză au indus ficatul gras la șobolani și rațe [20]. Astfel de diete au cauzat, de asemenea, creșteri ale peroxidării lipidelor hepatice și activarea căilor inflamatorii în ficatul șobolanilor [21]. Eroarea înnăscută a metabolismului cunoscută sub numele de intoleranță ereditară la fructoză, o boală rară care rezultă dintr-o deficiență a enzimei de metabolizare a fructozei, aldolaza B, a demonstrat că consumul de fructoză poate provoca boli hepatice progresive la om [22].
Absorbția fructozei din intestin în sângele portal este ajutată de transportorul de glucoză-5 la marginea pensulei și membranele bazolaterale ale jejunului. Această cale de absorbție are ca rezultat absorbția masivă de fructoză de către ficat. Fructoza este fosforilată de fructokinază, formând fructoză-1-fosfat, care poate fi apoi transformat în mai multe molecule de trei carbon, inclusiv gliceraldehide, dihidroxiacetonă fosfat și gliceraldehidă-3-fosfat (Figura (Figura 3). 3). Unele dintre aceste 3 molecule de carbon pot fi convertite în glucoză prin gluconeogeneză sau pot fi utilizate pentru a genera alte produse, cum ar fi trigliceridele (TG).
Metabolizarea fructozei în ficat. Metabolizarea fructozei hepatice începe cu fosforilarea fructokinazei. Carbonul fructoză intră pe calea glicolitică la nivelul triozei fosfat. Astfel, fructoza ocolește punctul principal de control prin care glucoza carbonului intră în glicoliză. Acest lucru permite fructozei să servească ca sursă nereglementată de glicerol-3-fosfat și acetil-CoA pentru lipogeneza hepatică.
Al doilea metabolism al fructozei, adică metabolismul extrahepatic care ocolește fructokinaza, permite carbonilor din fructoză să intre în glicoliză în aval de această enzimă. Cele 3 molecule de carbon pot fi utilizate în cele din urmă pentru sinteza glicerolului și a acizilor grași, care prin esterificare pot forma TG.
PATOFIZIOLOGIA NAFLD
Ipoteza „celor două lovituri” propusă de Day et al [26] rămâne teoria fiziopatologică dominantă. Potrivit autorilor, primul „hit” descrie o retenție netă a lipidelor în hepatocite, mai ales sub formă de TG, și este o condiție prealabilă pentru dezvoltarea NAFLD. O livrare continuă de acizi grași liberi în ficat din lipoliza splanchnică a grăsimilor viscerale (60%) sau din ingestia crescută de alimente grase (10%), combinată cu rezistența la insulină periferică și lipogeneza de novo (30%) are ca rezultat grăsimi excesive acumularea și o concentrație crescută a ficatului de esteri de TG și colesterol. Concentrația ridicată de TG din sânge sub formă de lipoproteine cu densitate foarte mică (VLDL) tinde să însoțească această afecțiune și induce activitatea proteinelor de transfer de colesterol ester, rezultând un transfer crescut de TG de la VLDL la lipoproteine cu densitate ridicată (HDL) și o creștere ulterioară a HDL clearance-ul și concentrația scăzută a HDL care duce în cele din urmă la steatoza hepatică [27].
Progresia steatozei către steatohepatită (NASH) este asociată cu alți factori („a doua lovitură”), cum ar fi lipotoxicitatea, inflamația, stresul oxidativ și rezistența la insulină [26]. Consumul de SD poate acționa ca un prim sau ca un al doilea succes în patogeneza NAFLD. Recent, s-a sugerat că metabolismul colesterolului poate avea un rol în acumularea de grăsimi hepatice și că inflamația poate fi prima lovitură urmată de acumularea TG ca a doua lovitură (www.easl.eu/bologna 2009).
REZISTENTA LA FRUCTOZA SI INSULINA
Consumul de fructoză crește concentrațiile de TG postprandiale în decurs de 24 de ore [28,29], ceea ce sugerează că hipertrigliceridemia postprandială este cea mai timpurie perturbare metabolică asociată cu consumul de fructoză. Cel mai probabil mecanism pentru hipertrigliceridemia postprandială este creșterea lipogenezei hepatice de novo (DNL), care la rândul său reglează în sus producția și secreția VLDL [30].
Consumul de fructoză poate favoriza lipogeneza hepatică în primul rând deoarece ficatul este principalul loc al metabolismului fructozei; în al doilea rând, intrarea fructozei în glicoliză prin fructoză-1-fosfat ocolește etapa principală de control al ratei glicolizei catalizată de fosfofructokinază, asigurând astfel cantități nereglementate de substraturi lipogene acetil-CoA și glicerol-3-fosfat [30]; în al treilea rând, fructoza poate activa proteina-1c care leagă elementul receptorului sterol (SREBP-1c) independent de insulină, care apoi activează genele de grăsime implicate în DNL [31,32].
Recent, Stanphone a demonstrat că consumul de băuturi îndulcite cu fructoză, nu băuturi îndulcite cu glucoză crește DNL, promovează dislipidemia, scade sensibilitatea la insulină și mărește adipozitatea viscerală la adulții supraponderali și obezi [33,34] (Figura 4).
Mecanisme ale efectelor dăunătoare ale fructozei.
Ouyang și colab. [67] au constatat că subiecții cu NAFLD au un aport semnificativ mai mare de băuturi îndulcite în istorie, reprezentând un aport de 2 ori mai mare decât aportul mediu atât în controale, cât și în studiile bazate pe populație. A doua constatare a fost că enzima inițiativă cheie în metabolismul fructozei, KHK (cetohexokinaza), a fost, de asemenea, crescută de 2 ori în biopsiile hepatice ale acestor pacienți, comparativ cu martorii [67]. Creșterea nivelurilor de KHK este în concordanță cu efectul cunoscut al fructozei de a regla KHK în ficatul șobolanilor [68,69].
Pacienții care urmează o dietă bogată în fructoză sau zaharoză prezintă un răspuns mai mare al acidului uric la un bolus de fructoză [70,71] în concordanță cu reglarea în sus a activității KHK. În cele din urmă, nivelurile de acid uric pot prezice dezvoltarea NAFLD [72]. Există, de asemenea, dovezi în creștere că creșterea acidului uric poate avea, de asemenea, un rol potențial în provocarea caracteristicilor sindromului metabolic [73], în parte prin capacitatea acidului uric de a diminua nivelurile de oxid nitric endotelial [74] și prin activarea adipocitelor [ 68]. Ce devine fructoza în ficatul nostru? Fructoza devine acizi grași liberi (elementele constitutive ale tuturor lipidelor), devine lipoproteine VLDL și TG (lipidele urâte cele mai asociate cu bolile cardiovasculare) și devine acid uric (stres oxidativ, inflamație vasculară, Figura 5).
FRUCTOZĂ ȘI SINDROM METABOLIC
Reaven a menționat că mai mulți factori de risc (de exemplu, dislipidemie, hipertensiune și hiperglicemie) sunt grupați în mod obișnuit [75]. Acest grup se numește Sindromul X și l-a recunoscut ca un factor de risc multiplex pentru bolile cardiovasculare (BCV). Alți cercetători folosesc termenul sindrom metabolic pentru această grupare de factori de risc metabolici. ATP III a folosit acest termen alternativ [76]. Dincolo de BCV și diabetul de tip 2, persoanele cu sindrom metabolic sunt susceptibile la alte afecțiuni, în special sindromul ovarului polichistic, ficatul gras, calculii biliari ai colesterolului, astmul, tulburările de somn, unele forme de cancer și sunt asociate cu o stare proinflamatorie/protrombotică care include creșterea niveluri de proteine C reactive, disfuncție endotelială, hiperfibrinogenemie, agregare plachetară crescută, niveluri crescute de activator al plasminogenului, niveluri ridicate de acid uric, microalbuminurie și o deplasare către particule mici și dense de lipoproteină cu densitate mică [77].
Caracteristicile majore ale sindromului metabolic includ rezistența la insulină, obezitatea abdominală, tensiunea arterială crescută și anomaliile lipidice (adică niveluri crescute de TG și niveluri scăzute de colesterol HDL).
Rolul fructozei în rezistența la insulină, hiperglicemia și obezitatea care constituie elemente importante ale sindromului metabolic au fost discutate mai sus [77].
Țesutul adipos visceral și dislipidemia induse de consumul de fructoză/zaharoză joacă un rol major în dezvoltarea și progresia sindromului metabolic. Rolul principal al țesutului adipos este de a prelua excesul de acizi grași furnizați de dietă și de a le stoca sub formă de TG-uri pentru a fi utilizate ca sursă de energie pentru organism în perioadele de foame, cu toate acestea, țesutul adipos are o capacitate limitată depozitează grăsime. Această capacitate maximă poate fi atinsă în stările de obezitate, rezultând o capacitate redusă a țesutului adipos de a dobândi acizi grași alimentari și, prin urmare, niveluri crescute de acizi grași se găsesc în circulație [77].
Anomaliile de semnalizare ale adipocitelor pot declanșa, de asemenea, lipoliza depozitelor de TG și efluxul de acizi grași în sânge, sporind problema. Prezența nivelurilor ridicate de NEFA în fluxul sanguin este propusă să funcționeze ca o legătură mecanică cheie între obezitate și rezistența la insulină, diabetul de tip 2 și dislipidemia metabolică. În cele din urmă, aceste NEFA pot fi preluate ectopic de țesuturi neadipose, cum ar fi ficatul și mușchiul scheletic, unde pot fi stocate ca TG sau diacilglicerol și pot interfera cu căile metabolice, cum ar fi răspunsul la insulină, contribuind la rezistența la insulină și sindrom [78].
Există diferențe în ceea ce privește proprietățile metabolice ale diferitelor situri ale țesutului adipos. Se crede că depozitele de grăsimi viscerale sau abdominale prezintă un risc mai mare pentru dezvoltarea rezistenței la insulină și a sindromului metabolic decât depozitele de grăsime subcutanată. Motivele pentru acest lucru includ reacția redusă a grăsimii viscerale la efectele anti-lipolitice ale insulinei (datorită expresiei și activității reduse a lipazei hormonale, fosforilarea tirozinei redusă a receptorului de insulină, scăderea expresiei IRS-1 și creșterea activității PTP-1B); reacție mai mare a grăsimii viscerale la efectele inducătoare de lipoliză ale catecolaminelor; și scăderea absorbției și acilării acizilor grași în comparație cu grăsimea subcutanată, toate acestea ducând la amplificarea nivelurilor de NEFA în sânge [79]. Grăsimea viscerală este, de asemenea, localizată în mod convenabil pentru ca acești NEFA să intre în circulația portalului pentru livrarea directă în ficat, unde prezintă un risc pentru capacitatea de reacție la insulina hepatică.
Consumul de fructoză poate induce perturbări în semnalizarea celulară și cascade inflamatorii în țesuturile sensibile la insulină [25]. A fost discutată mai sus contribuția fructozei/zaharozei în dislipidemie. Consumul unor cantități atât de mari de fructoză/zaharoză poate duce la dezvoltarea unui sindrom metabolic complet prin creșterea TG plasmatice și modificarea homeostaziei hepatice a glucozei, creșterea în greutate și scăderea sensibilității la insulină.
CONCLUZIE
Utilizarea îndulcitorilor a crescut considerabil în întreaga lume, iar băuturile răcoritoare par să fie un factor major pentru obezitate, diabet zaharat, hiperlipidemie, rezistență la insulină, hipertensiune arterială, sindrom metabolic și boli cardiovasculare. În această revizuire am căutat să concentrăm atenția asupra impactului băuturilor răcoritoare asupra acumulării de grăsimi în ficat. Acest lucru are implicații clinice semnificative, deoarece prezența NAFLD se corelează puternic cu diabetul, bolile cardiovasculare și ateroscleroza difuză.
Note de subsol
Evaluatori colegi: Dr. Vance Matthews, PhD, BS, Laborator de metabolizare celulară și moleculară, Universitatea Baker din Texas Filiala Medicală, IDI, PO Box 6492, St Kilda Road Central, VIC 8008, Melbourne, Australia; Dr. Sang Geon Kim, dr., MS, BS, profesor, președinte, Colegiul de Farmacie, Universitatea Națională din Seul, Sillim-dong, Kwanak-gu, Seul 151-742, Coreea de Sud; Dr. Juan Carlos Laguna Egea, Catedràtic de Farmacologia/Farmacology Professor, Unitat de Farmacologia/Pharmacology Laboratory, Facultat de Pharmaàcia/School of Pharmacy, Universitat de Barcelona/University of Barcelona, Avda Diagonal 643, Barcelona 08028, Spain; Fabrizio Montecucco, MD, Asistent, Divizia de Cardiologie, Departamentul de Medicină Internă, Universitatea din Geneva, Avenue de la Roseraie 64, 1211 Geneva, Elveția
S- Editor Wang YR L- Editor Webster JR E- Editor Ma WH
- Obezitate și boli hepatice grase nealcoolice Implicații biochimice, metabolice și clinice -
- Boala hepatică grasă nealcoolică și insuficiența cardiacă există o legătură
- Istoria naturală a implicațiilor boli hepatice grase nealcoolice pentru practica clinică și o
- Boală hepatică grasă nealcoolică Omul din California diagnosticat cu insuficiență respiratorie și plasat într-un
- Analele bolii hepatice grase nealcoolice ale medicinii interne