Separarea componentelor solubile și insolubile ale unui amestec
ThoughtCo/Vin Ganapathy
- Ph.D., Științe biomedicale, Universitatea din Tennessee la Knoxville
- B.A., Fizică și matematică, Colegiul Hastings
O aplicație practică a chimiei este că poate fi folosită pentru a ajuta la separarea unei substanțe de alta. Motivele pentru care materialele pot fi separate unele de altele se datorează faptului că există unele diferențe între ele, cum ar fi dimensiunea (separarea rocilor de nisip), starea materiei (separarea apei de gheață), solubilitatea, sarcina electrică sau punctul de topire.
Separarea de nisip și sare
- Elevii sunt deseori rugați să separe sarea și nisipul pentru a afla despre amestecuri și pentru a explora diferențele dintre formele de materie care pot fi utilizate pentru a separa componentele amestecului.
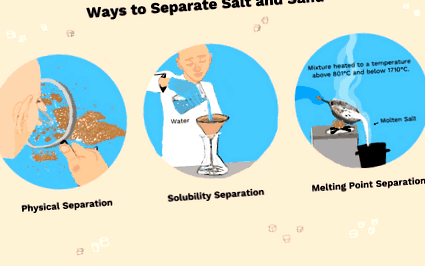
- Trei metode utilizate pentru a separa sarea și nisipul sunt separarea fizică (alegerea bucăților sau utilizarea densității pentru a scutura nisipul până la vârf), dizolvarea sării în apă sau topirea sării.
- Probabil cea mai ușoară metodă de separare a celor două substanțe este dizolvarea sării în apă, turnarea lichidului departe de nisip și apoi evaporarea apei pentru recuperarea sării.
Separarea fizică a sării și a nisipului
Deoarece atât sarea, cât și nisipul sunt solide, puteți obține o lupă și o pensetă și, în cele din urmă, alegeți particule de sare și nisip.
O altă metodă de separare fizică se bazează pe diferitele densități de sare și nisip. Densitatea sării este de 2,16 g/cm³, în timp ce densitatea nisipului este de 2,65 g/cm³. Cu alte cuvinte, nisipul este puțin mai greu decât sarea. Dacă scuturați o tigaie de sare și nisip, nisipul se va ridica în cele din urmă până la vârf. O metodă similară este utilizată pentru a face aur, deoarece aurul are o densitate mai mare decât majoritatea celorlalte substanțe și se scufundă într-un amestec.
Separarea de sare și nisip folosind solubilitatea
O metodă de separare a sării și a nisipului se bazează pe solubilitate. Dacă o substanță este solubilă, înseamnă că se dizolvă într-un solvent. Sarea (clorură de sodiu sau NaCI) este un compus ionic care este solubil în apă. Nisipul (mai ales dioxid de siliciu) nu este.
- Se toarnă amestecul de sare și nisip într-o tigaie.
- Adaugă apă. Nu este nevoie să adăugați multă apă. Solubilitatea este o proprietate afectată de temperatură, deci se dizolvă mai multă sare în apă fierbinte decât apă rece. Este în regulă dacă sarea nu se dizolvă în acest moment.
- Încălziți apa până când sarea se dizolvă. Dacă ajungeți acolo unde fierbe apa și există încă sare solidă, puteți adăuga ceva mai multă apă.
- Scoateți tigaia de pe foc și lăsați-o să se răcească până când este manipulată în siguranță.
- Se toarnă apa sărată într-un recipient separat.
- Acum colectează nisipul.
- Se toarnă apa sărată înapoi în tigaia goală.
- Încălziți apa sărată până când fierbe apa. Continuați să fierbeți până când apa dispare și rămâneți cu sarea.
O altă modalitate prin care puteți separa apa sărată de nisip este să agitați nisipul/apa sărată și să o turnați printr-un filtru de cafea pentru a captura nisipul.
Separarea componentelor amestecului folosind punctul de topire
O altă metodă de separare a componentelor unui amestec se bazează pe punctul de topire. Punctul de topire al sării este de 804 ° C (1474 ° F), în timp ce cel de nisip este de 1710 ° C (3110 ° F). Sarea se topește la o temperatură mai mică decât nisipul. Pentru a separa componentele, un amestec de sare și nisip este încălzit la peste 801 ° C, încă sub 1710 ° C. Sarea topită poate fi turnată, lăsând nisipul. De obicei, aceasta nu este cea mai practică metodă de separare, deoarece ambele temperaturi sunt foarte ridicate. În timp ce sarea colectată ar fi pură, o sare lichidă ar contamina nisipul, cum ar fi încercarea de a separa nisipul de apă prin turnarea apei.
Note și întrebări
Rețineți, puteți lăsa pur și simplu apa să se evapore din tigaie până când ați rămas cu sarea. Dacă ați fi ales să evaporați apa, o modalitate prin care ați fi putut accelera procesul ar fi fost să turnați apa sărată într-un recipient mare, de mică adâncime. Suprafața crescută ar fi schimbat viteza cu care vaporii de apă ar fi putut pătrunde în aer.
Sarea nu a fiert cu apa. Acest lucru se datorează faptului că punctul de fierbere al sării este mult mai mare decât cel al apei. Diferența dintre punctele de fierbere poate fi utilizată pentru purificarea apei prin distilare. În distilare, apa este fiartă, dar este apoi răcită, astfel încât să se condenseze din vapori înapoi în apă și să poată fi colectată. Apa clocotită o separă de sare și de alți compuși, cum ar fi zahărul, dar trebuie controlată cu atenție pentru a o separa de substanțele chimice care au puncte de fierbere mai mici sau similare.
Deși această tehnică poate fi utilizată pentru a separa sarea și apa sau zahărul și apa, nu ar separa sarea și zahărul de un amestec de sare, zahăr și apă. Vă puteți gândi la o modalitate de a separa zahărul și sarea?
Gata pentru ceva mai provocator? Încercați să purificați sarea din sarea de rocă.
- House, Senatul aprobă facturile de fermă separate; Versiunile intră acum în procesul de conferință - NMPF
- Modul în care un meniu de restaurant cu livrare separată vă ajută să vă măriți baza de clienți Timpul restaurantului
- Sănătate într-un corp plin sau într-un aliment separat
- Cum și când să utilizați sarea pentru tratarea bolilor de pești tropicali
- Health Blog Esența și principiile nutriției separate