Deficitul de insulină induce răspunsuri similare cu cele generate de acidoză, inclusiv activarea sistemului ubiquitin-proteazom, dependența de glucocorticoizi și un model similar de modificări ale expresiei genice (389, 490, 577).
Termeni asociați:
- Rezistenta la insulina
- Hiperglicemie
- Glucoză
- Diabetul zaharat
- Proteină
- Insulină
- Eliberarea de insulină
- Diabet zaharat dependent de insulină
Descărcați în format PDF
Despre această pagină
Insulina, masa corporală și creșterea la pacienții tineri cu fibroză chistică
Shihab Hameed, Charles F. Verge, în Dietă și exerciții fizice în fibroză chistică, 2015
24.6.1 Modificări ale metabolismului proteinelor datorate deficitului de insulină duc la catabolism
Deficitul de insulină duce la accelerarea catabolismului proteinelor, precum și la diminuarea sintezei proteinelor. Acest lucru se manifestă ca o slabă creștere în greutate și irosire (vezi Figura 24.3). Depleția proteinelor poate fi asociată, de asemenea, cu capacitatea redusă de a depăși infecțiile, așa cum se observă la pacienții cu malnutriție energetică proteică [88]. Pancreatectomia parțială la animale (rezultând deficit de insulină) este asociată cu o sinteză semnificativ redusă a proteinelor musculare în urma exercițiului [89]. Acest lucru crește posibilitatea ca deficitul de insulină să ducă la o creștere musculară afectată la subiecții cu FC după exerciții. Forța musculară respiratorie este, desigur, un factor important în funcția respiratorie dependentă de efort.
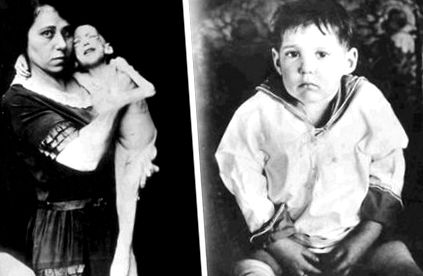
FIGURI 24.3. Evidențierea efectelor anabolice ale insulinei, unul dintre primii pacienți care a supraviețuit apariției diabetului de tip 1 a arătat o îmbunătățire dramatică a greutății după tratamentul cu insulină.
Reprodus cu permisiunea din arhivele Eli Lilly and Company.
Inflamația sistemică are ca rezultat niveluri ridicate de TNF-alfa circulante. După cum sa menționat în secțiunea 24.3.1, TNF-alfa poate afecta acțiunea insulinei. Se consideră că acest efect este mediat prin scăderea activității tirozin kinazei a receptorului de insulină [49]. În acest fel, boala sistemică poate contribui la catabolism din cauza deficitului de insulină.
În plus, la aceste efecte catabolice se adaugă pierderea glucozei prin glicozurie. Pentru fiecare gram de glucoză excretat în urină, 4,1 kcal se pierd din organism [90], iar glicozuria apare atunci când pragul renal pentru reabsorbția glucozei (aproximativ 7 mmol/L, 126 mg/dL) este depășit.
Luate împreună, aceste descoperiri ridică îngrijorări considerabile pentru pacienții cu CF, la care s-au observat rate crescute cronic de catabolism proteic [91,92]. În mod încurajator, sa demonstrat că tratamentul cu insulină inversează cu succes catabolismul proteinelor în CFRD [93] .
Cetoacidoza diabetică
Jeanne M. Rozwadowski MD, Philip S. Mehler MD, în Critical Care Secrets (Ediția a patra), 2007
2 Descrieți baza fiziopatologică a DKA.
Deficitul de insulină este punctul focal al tulburării și provoacă atât hiperglicemie, cât și cetonemie. Într-o stare normală, insulina asigură stocarea glucozei ca glicogen în ficat. Cu un deficit de insulină, există atât o producție crescută de glucoză hepatică prin glicogenoliză crescută și gluconeogeneză, cât și o utilizare scăzută a glucozei. Rezultatul este hiperglicemia.
Cetonemia se datorează în mod similar unei stări de deficit de insulină. În condiții normale, insulina permite depozitarea acizilor grași liberi, ca trigliceride, în țesutul adipos. Ca urmare a nivelurilor reduse de insulină și a nivelurilor concomitent crescute de hormoni contrareglatori ai glucozei, există o producție excesivă de acizi grași liberi din degradarea trigliceridelor. Acizii grași liberi sunt transformați în corpuri cetonice în ficat. În plus, scăderea utilizării cetonelor contribuie la cetonemie.
Cateels K, Mathieu C: Cetoacidoza diabetică. Rev Endocrinol Metab Disord 4: 159–166, 2003.
Mierea: Profil și caracteristici: Aplicații pentru diabet
4.1 Rolul mierii în deficiența de insulină și rezistența la insulină
Endocrinologie
Disfuncție
Deficitul de insulină duce la hiperglicemie. Efectele hiperglicemiei sunt depleția de sare și apă din cauza diurezei osmotice, pierderea în greutate, oboseală, vărsături, hipotensiune arterială, infecții, hiperventilație (datorită cetoacidozei) și afectarea nivelului conștient și comă. Hiperglicemia cronică are ca rezultat microangiopatia (care afectează rinichii, nervii și retina) și macroangiopatia care cauzează boli vasculare periferice, coronare și cerebrale.
Hipoglicemie (definită ca zahăr din sânge de
Progrese în cercetarea medicamentelor
2.2 Lipide
În deficitul de insulină, nivelurile de FFA plasmatice bazale și oxidarea lipidelor sunt crescute și nu scad în mod normal (DeFronzo, 1988). Ratele de producție a acidului gras sunt crescute de trei ori. Aceasta reflectă deficiența insulinei în prezența activității normale a sistemului nervos simpatic și a nivelului normal de catecolamine circulante.
Odată cu pierderea acțiunii insulinei și cu un exces de hormoni catabolici, hidroliza trigliceridelor este semnificativ crescută, crește aportul de glicerină și crește fluctuația trigliceridelor în plasmă cu o creștere concomitentă a cetoacidului derivat din oxidarea hepatică a FFA. Acizii grași sunt parțial oxidați în compuși cetonici. Sinteza cetonică crește de peste trei ori în starea deficitului de insulină, ca urmare a unui raport scăzut insulină/glucagon și a unui aport ridicat de FFA în ficat. La niveluri scăzute de insulină, absorbția cetonică și utilizarea țesutului periferic sunt, de asemenea, reduse semnificativ.
În cetoacidoza diabetică, concentrațiile plasmatice de cetonă sunt adesea crescute până la 200-300 de ori valorile normale ale postului, din cauza eliminării renale suplimentare afectate. O mobilizare excesivă a FFA se datorează unei descompuneri crescute a trigliceridelor și unei rate reduse de utilizare a FFA pentru esterificarea în țesutul adipos. Creșterea oxidării acizilor grași favorizează gluconeogeneza hepatică.
Există o capacitate redusă a țesutului periferic de a prelua trigliceridele în diabetul zaharat cu deficit de insulină sau într-o stare rezistentă la insulină. FFA și cetonele diminuează absorbția glucozei și oxidarea mușchilor, contribuind la hiperglicemie și, așa cum s-a remarcat pentru prima dată de Randle și colab. (1963), FFA inhibă oxidarea piruvatului, glicoliza și eventual transportul glucozei. Există o relație reciprocă între metabolismul glucozei și cel al FFA, cunoscut sub numele de ciclul glucoză-acid gras.
Cetoacidoza diabetică și starea hiperglicemică hiperosmolară
Joel J. Schnure MD, Jack L. Leahy MD, în Secretele de îngrijire critică (ediția a cincea), 2013
4 Cum provoacă DKA o anhidră acidoză metabolică?
Deficitul de insulină și creșterea glucagonului și a catecolaminelor determină eliberarea excesivă de acizi grași din țesutul adipos și activarea căilor metabolice în ficat pentru conversia în cetoacizi: acetoacetat, acetonă și β-hidroxibutirat. Acumularea lor are ca rezultat acidoza metabolică a decalajului anionic caracteristic DKA. Anionul gap este calculat prin scăderea concentrației serice a anionilor majori (clorură și bicarbonat) din cationul principal (sodiu). O diferență mai mare de 12 mEq/L împreună cu un nivel redus de bicarbonat (
Modele de insuficiență endocrină
Thomas C. Vary, în Chirurgical Research, 2001
C. Diazoxid
O deficiență acută de insulină poate fi produsă la șobolanii hrăniți cu diazoxid, un inhibitor specific al secreției de insulină. În acest protocol, diazoxid (20 mg în 3 ml hidroxid de sodiu 0,05 N/100 kg greutate corporală) a fost injectat intraperitoneal. Concentrațiile plasmatice ale insulinei au scăzut în decurs de 1 oră și rămân astfel până la 3 ore postinjecție. În mod normal, deficitul de insulină este asociat cu modificări ale altor hormoni. Cu toate acestea, concentrațiile de IGF-I, glucagon și corticosteron nu au fost diferite față de controalele date numai vehiculului (8). Șobolanii tratați cu diazoxid prezintă, de asemenea, o creștere a acizilor grași neesterificați în plasmă și a β-hidroxibutiratului, caracteristic unui deficit de insulină. Astfel, această procedură este destul de specifică pentru reducerea concentrațiilor plasmatice de insulină.
Există cel puțin două limitări ale acestei tehnici pentru a induce un deficit relativ de insulină. În primul rând, insulele β rămân sensibile la secretagogii insulinei. Diazoxidul blochează secreția de insulină fără a-i inhiba biosinteza. Prin urmare, insulina se acumulează cel mai probabil în celulele β și ar putea fi eliberată după o injecție în bolus a secretagogului. De exemplu, perfuzia cu doze mari de fenilalanină are ca rezultat o creștere rapidă a concentrațiilor plasmatice de insulină (8). Se poate administra o a doua doză (15 mg în 2 ml de hidroxid de sodiu 0,05 N/100 g greutate corporală) și/sau a treia doză de diazoxid pentru a preveni secreția de insulină. Astfel, trebuie să se acorde atenție atunci când se efectuează studii metabolice cu compuși despre care se știe că modulează secreția de insulină. În al doilea rând, efectele diazoxidului sunt temporare și sunt inversate în decurs de 5 ore. Cu toate acestea, această ultimă limitare poate fi considerată, de asemenea, unică printre modelele de deficit de insulină. Astfel, anumite măsurători ar putea fi efectuate teoretic la același animal înainte, în timpul și după inducerea unui deficit de insulină tranzitorie. Un alt avantaj al acestei metode este că concentrațiile plasmatice ale altor hormoni (de exemplu, IGF-I, corticosteron, hormon de creștere) nu sunt modificate apreciabil după administrarea de diazoxid (8).
În plus față de diazoxid, LN5330, o benzotiadiazină cu asemănări structurale cu diazoxidul, produce și o scădere rapidă a concentrațiilor plasmatice de insulină (9). Spre deosebire de diazoxid, LN5330 a provocat, de asemenea, o creștere semnificativă a concentrațiilor plasmatice de glucagon. Prin urmare, acest compus poate induce în mod eficient mediul hormonal observat în timpul diabetului prin faptul că se observă atât deficitul de insulină, cât și hiperglucagonemia.
Diabetul și sistemul nervos
Rațional pentru examinarea insulinei
Că deficitul de insulină sau rezistența ar putea fi legate de neuropatie poate părea o concluzie evidentă, totuși a obținut recent sprijin. Hiperglicemia secundară insuficienței celulelor β pancreatice și consecințele metabolice ale acesteia au eclipsat ideile despre rolul direct al insulinei în neuropatia periferică. Investigațiile clinice majore, cum ar fi complicațiile și controlul diabetului (DCCT), au remarcat faptul că un control mai strict al hiperglicemiei a redus incidența și prevalența DPN în diabetul de tip 1 (cu studii ulterioare care identifică beneficii similare în diabetul de tip 2). Cu toate acestea, în DCCT, controlul strict al hiperglicemiei necesită administrarea unor doze mai mari și mai frecvente de insulină. La unii subiecți diabetici, este posibil ca insulina să nu fi fost administrată, să fi fost inadecvată în doză sau să nu fi reușit să imite acțiunea fiziologică din cauza acțiunii intermitente a dozelor exogene. În plus, nivelurile serice de insulină nu reflectă neapărat pe cele ale lichidului spinal acolo unde acesta accesează neuronii (Folli și colab., 1994). Astfel, abordările actuale ale utilizării insulinei la om nu sunt neapărat optime pentru a susține neuronii periferici.
Sindroame dureroase neuropatice
Robert W. Hurley,. Christopher L. Wu, în Managementul practic al durerii (ediția a cincea), 2014
Controlul glicemic
Hiperglicemia și deficitul de insulină sunt asociate cu patogeneza DPN. Se pare că controlul glicemic este unul dintre cele mai eficiente tratamente pentru a încetini progresia bolii și a întârzia apariția acesteia. 1 Într-un studiu realizat de grupul de cercetare privind controlul și complicațiile diabetului, un total de 1441 de pacienți cu diabet zaharat insulino-dependent (dintre care 726 nu au avut retinopatie și 715 au avut retinopatie ușoară) au fost monitorizați timp de 6,5 ani după atribuirea aleatorie la terapie cu pompă de insulină sau trei sau mai multe injecții zilnice de insulină. Studiul a concluzionat că în grupul fără retinopatie, terapia intensivă a redus riscul dezvoltării DPN cu 76% în comparație cu terapia convențională. În grupul cu retinopatie, terapia intensivă a scăzut progresia cu 54%. Studiul a arătat, de asemenea, că progresia microalbuminuriei în ambele grupuri a fost redusă cu 39%, albuminuria cu 54% și neuropatia clinică cu 60% cu terapie intensivă cu insulină. 121 Astfel, un control glicemic strâns contribuie la un debut întârziat și la încetinirea progresiei DPN.
DIABETES MELLITUS | Etiologie
Diagnostic
Deși atât deficitul de insulină, cât și rezistența la insulină au ca rezultat anomalii ale metabolismului grăsimilor, proteinelor și glucidelor, tocmai diagnosticul și monitorizarea se bazează în primul rând pe modificările nivelului glicemiei.
Până de curând, diagnosticul de diabet se baza pe criteriile stabilite de Organizația Mondială a Sănătății (OMS), utilizând un test standard de toleranță la glucoză pe cale orală (OGTT). În marea majoritate a pacienților, un GTT nu este necesar, iar diagnosticul se face pe baza istoricului clinic și a nivelului aleatoriu și/sau al glicemiei în repaus alimentar, care sunt de obicei neechivoci. (Excepția este sarcina, în timpul căreia screeningul pentru diabetul gestațional utilizând un GTT este o practică obișnuită.) Cu toate acestea, criteriile stricte și o procedură de diagnostic standard sunt importante, în special în scopuri epidemiologice. Interpretarea unui GTT se bazează pe nivelul de glucoză în starea de repaus alimentar și la 2 ore după o sarcină de glucoză de 75 g (sau echivalent); nici nivelul de glucoză de 1 h, nici măsurătorile glucozei din urină sau ale insulinei plasmatice nu sunt de uz diagnostic. Sarcina de glucoză trebuie dizolvată în 250-300 ml de apă și băută în 5 minute după un post peste noapte; carbohidrații dietetici nu ar fi trebuit să fie restricționați în cele 3 zile anterioare testului.
Criteriile OMS au fost recent revizuite, iar noile criterii sunt prezentate în Tabelul 3. Motivul principal al modificărilor este faptul că nivelul de glucoză plasmatică post-încărcare de 1 oră de 11,1 mmol l -1 (cel mai important criteriu pentru diagnosticul diabetului zaharat) se corelează mai bine cu un nivel de post de 7 mmol l -1. A fost propusă, de asemenea, o nouă categorie de „glucoză la jeun afectată” (glucoză plasmatică la jeun 6,1-7,0 mmol l -1), deoarece s-a demonstrat că prevalența complicațiilor diabetice (retinopatie) începe să crească semnificativ la persoanele cu o glucoză plasmatică la jeun mai mare 6 mmol l −1. (A se vedea GLUCOZA | Menținerea nivelului de glucoză din sânge; GLUCOZĂ | Toleranță la glucoză și indicele glicemic (glicemic).)
Tabelul 3. Valori diagnostice pentru testul oral de toleranță la glucoză (OMS, 1999)
- Hipuricemia - o prezentare generală Subiecte ScienceDirect
- Circulația hiperdinamică - o prezentare generală Subiecte ScienceDirect
- Ciuperci medicinale - o prezentare generală Subiecte ScienceDirect
- Leukoencefalopatia - o privire de ansamblu asupra subiectelor ScienceDirect
- Ileita - o prezentare generală a subiectelor ScienceDirect