Abstract
fundal
Boala hepatică grasă nealcoolică (NAFLD), caracterizată ca acumulare excesivă de lipide în hepatocite, crește în prevalență. Exploatarea medicamentelor eficiente pentru NAFLD sa dovedit a fi o provocare. Aici, ne-am propus să stabilim un model dietetic de steatoză hepatică folosind larve transparente de pește zebră în care să poată fi efectuate ecrane chimice cu randament ridicat.
Metode
Larvele de pește zebră hrănite cu dietă bogată în grăsimi (HF) și dietă bogată în grăsimi plus colesterol ridicat (HFC) au fost comparate cu martorul. Am analizat acumularea de lipide intrahepatice, indicii biologici și diverse căi, inclusiv metabolismul lipidic, stresul ER și inflamația. În plus, au fost evaluate efectele ezetimibului și simvastatinei asupra steatozei induse de dieta HFC.
Rezultate
Concluzie
Rezultatele noastre demonstrează că modelul de steatoză a larvelor de pește zebră stabilit și validat în acest studiu ar putea fi utilizat in vivo studii de steatoză și screening pentru medicamente.
Introducere
Boala ficatului gras nealcoolic (NAFLD) este cea mai frecventă cauză a disfuncției ficatului uman și prezintă un risc enorm pentru sănătatea umană [1]. Se estimează că aproximativ 20% -30% din populația generală suferă de steatoză simplă, iar prevalența steatohepatitei nealcoolice (NASH) este de 3% -10% [2]. Blocarea steatozei hepatice este crucială pentru prevenirea dezvoltării NAFLD. Deși s-au înregistrat îmbunătățiri în progresia steatozei hepatice către inflamația hepatică mai avansată din cauza modificărilor stilului de viață și a utilizării suplimentelor [3, 4], patogeneza NAFLD rămâne neclară, iar medicamentele terapeutice sunt încă restricționate.
Metode
Îngrijirea și hrănirea peștilor zebră
Embrionii cu pete AB de tip sălbatic au fost menținuți conform protocolului standard [32]. Larvele de pește zebră au fost hrănite cu dietă de control (Zeigler Bros, Inc., SUA. Proteine: 50%, grăsimi: 12%, fibre: 2,5%), dietă HF (Marine Biological Science Co., LTD din CNSIC, Tianjin, China. Proteine: 50%, Grăsimi: 24%, Fibre: 2,5%) și dieta HFC (2,5% și 5,0% greutate/greutate colesterol adăugat la dieta HF așa cum este descris [33]). Acest studiu a fost aprobat de Comitetul de îngrijire și utilizare a animalelor de la Universitatea de Medicină din Sud, Guangzhou și s-au depus toate eforturile pentru a reduce la minimum suferința.
Tratamente
Pentru a optimiza un protocol pentru expunerea larvelor la dietele HF și HFC, am evaluat mai întâi consumul de dietă martor de către larvele de pește zebră. Am hrănit 100 de larve într-un rezervor de pește de 2 L cu 30 mg-180 mg pe zi pentru a-și îndeplini necesarul de energie de bază. Am constatat că incidența steatozei la larvele de pește zebră a crescut treptat odată cu creșterea cantității de hrănire. Pe baza acestor rezultate, toate tipurile de diete administrate larvelor au fost strict restricționate ca 30 mg/rezervor pe zi. Ezetimibe (Santa Cruz Biotechnology, Texas, SUA) utilizat în acest studiu a fost adăugat direct la apa din rezervorul de pește la concentrații de 1 μM și simvastatină (Cayman Chemicals, Michigan, SUA) a fost adăugată la 50 μg/g alimente. Aceste concentrații de medicamente și metode de administrare au fost alese pe baza raportului anterior așa cum este descris [34].
Roșu de ulei montat integral pe roșu
Larvele de pește zebră au fost postite 24 de ore după hrănire. Larvele întregi au fost apoi fixate în paraformaldehidă (PFA) 4% peste noapte la 4 ° C și spălate de două ori cu soluție salină tamponată cu fosfat (PBS), infiltrate cu 80% și 100% 1,2 propilen glicol la temperatura camerei respectiv 20 minute și colorate cu 0,5% roșu ulei O (nr. De cat. O0625, Sigma-Aldrich, St. Louis, SUA) în 100% 1,2 propilen glicol în întuneric peste noapte la temperatura camerei. Larvele colorate au fost spălate cu PBS și au estompat culoarea de fundal prin spălare cu 100% și 80% 1,2 propilen glicol timp de 30 de minute fiecare și depozitate în 80% 1,2 propilen glicol la 4 ° C. Picăturile de lipide din țesutul hepatic au fost observate și fotografiate pe un microscop cu disecție pe câmp luminos (Olympus szx10, Tokoyo, Japonia). Larvele au fost definite pozitive pentru steatoză dacă limita dintre ficat și țesutul înconjurător este clară și 3 sau mai multe picături de lipide au fost vizibile în ficat prin colorarea în roșu a uleiului în întregime.
Roșu ulei O colorare a criosecțiilor
Larvele au fost fixate în 4% PFA peste noapte la 4 ° C și infiltrate cu 30% zaharoză peste noapte la 4 ° C. Larvele au fost încorporate în Tissue-Tek OCT Compound (Sakura Japan Co., Ltd., Tokyo, Japonia) și secțiuni de 10 μm au fost montate pe diapozitive și depozitate la - 80 ° C. Înainte de colorare cu roșu ulei O, lamelele au fost încălzite la temperatura camerei și imersate în 85% și 100% 1,2 propilen glicol timp de 5 minute fiecare, și apoi colorate cu roșu ulei O în întuneric peste noapte la temperatura camerei. Diapozitivele au fost rapid colorate în 100% și 85% propilen glicol în ziua următoare și apoi spălate cu PBS pentru a curăța fundalul. Diapozitivele au fost vizualizate pe un microscop Olympus BX51.
Analiza biologică
Ficatul de 50-70 de larve de pește zebră a fost omogenizat în tampon de liză, centrifugat și obținut lichid supernatant. FC, TC și TG în omogenatele hepatice au fost măsurate folosind kiturile (APPLYGEN Bioengineering, Beijing, China și Nanjing Jiancheng Bioengineering, orașul Nanjing, China) urmând instrucțiunile producătorului și au fost normalizate la concentrația totală de proteine, determinată de Bradford Assay ( Bio-Rad, Hercules, CA).
Analiza histologică
Larvele au fost fixate cu 4% PFA peste noapte, încorporate în parafină conform procedurilor standard. Patru secțiuni de μm au fost colorate cu hematoxilină și eozină (H&E) și observate la microscopul BX51 (Olympus, Tokyo, Japonia).
RT-PCR cantitativ
ARN-ul total a fost extras din bazinele a 20-30 de ficati disecati si purificat folosind mini kitul RNeasy plus (Qiagen, germana) si transcris invers cu cScript ADNc folosind kitul PrimeScript ™ RT-PCR (Takara Biotechnology Co., Ltd., Dalian, China ). PCR cu transcriere inversă cantitativă (qRT-PCR) a fost efectuată pe Light Cycler 480 (Roche, Basel, Elveția) folosind primerii specifici genei (Fișier suplimentar 1: Tabelul S1). eef1a1 a fost folosit ca referință, iar expresia a fost calculată folosind metoda pragului de ciclu (Ct) (2 -Ct) (țintă)/2 -Cteef1a1))).
Western blot
Ficatele au fost disecate din bazine de 20-30 de larve și lizate în tampon RIPA suplimentat cu inhibitori de protează (Roche). Întregul extract a fost rezolvat prin SDS-PAGE, transferat la o membrană PVDF (Bio-Rad) și incubat peste noapte cu anticorpi după cum s-a indicat. Mouse monoclonal anti-GRP78/BiP (Nr. Cat. MB0050, 1: 1000, Bioworld Technology, St. Louis Park, SUA), anti-β-actină monoclonală de iepure (Cat.No.ab151526, 1: 1000, Abcam, San Franciso, SUA), anti-iepure-capră-HRP (Cat.Nr.ab6721, 1: 10000, Abcam), anti-mouse-HRP (Cat.Nr.ab6729, 1: 10000, Abcam) au fost utilizate. Cuantificarea intensităților benzii a fost efectuată utilizând software-ul Image J.
Analize statistice
Analiza statistică a fost efectuată utilizând software-ul statistic SPSS 16.0. Rezultatele sunt exprimate ca medie ± SD. Testul t student și testul ANOVA într-un singur sens sunt efectuate pentru analiză. Software-ul Graphpad Prism 5 (Graphpad, La Jolla, CA, SUA) a fost folosit pentru a desena figuri. Diferențele au fost considerate semnificativ la P
Rezultate
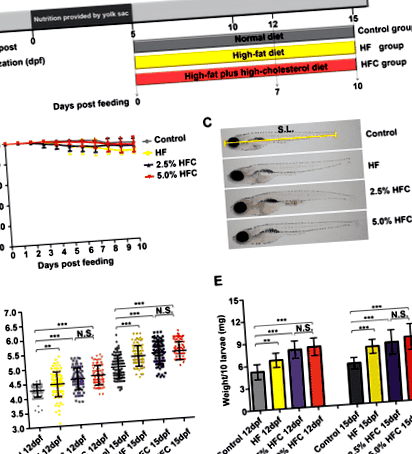
Modificări ale greutății și lungimii corpului în Larvele de pește zebră hrănite cu diete HF și HFC
Pentru a stabili un model de steatoză hepatică, 5 larve de pește zebră dpf au fost tratate cu control, dietă HF și două tipuri de diete HFC (2,5% dietă HFC și 5,0% dietă HFC) timp de 7 sau 10 zile (Fig. 1a). În timpul perioadei de hrănire, dieta HF și dieta HFC nu au indus o mortalitate semnificativă (Fig. 1b). Lungimea corpului a fost semnificativ mai mare în grupul HF și în grupurile HFC comparativ cu martorul după 7 zile de hrănire (P FIG. 1
HF și HFC steatoza hepatică indusă de diete în larvele de pește zebră
Modificări ale genelor în ficatul HF și HFC larve de pește zebră hrănite cu diete
Tratamentul cu ezetimib și simvastatină ameliorează steatoza hepatică la 2,5% larve de pește zebră alimentate cu HFC
Pentru a valida fiabilitatea modelului HFC și valoarea utilității pentru screening-ul potențialelor medicamente anti-steaotă, larvele alimentate cu HFC au fost tratate cu ezetimib și simvastatină. Am constatat că picăturile de lipide au scăzut în ficatul grupurilor de 2,5% HFC + ezetimib și 2,5% HFC + simavastatină, comparativ cu grupul 2,5% HFC (Fig. 4a). În concordanță cu rezultatele de mai sus, nivelurile de FC, TC și TG au fost crescute în ficatul grupului HFC 2,5% comparativ cu grupul martor și au scăzut semnificativ în ficatul grupurilor 2,5% HFC + ezetimib și 2,5% HFC + simavastatină ( Fig. 4b, c și d). Aceste date arată că ezetimibul și simvastatina prezintă activități anti-steatoză, ceea ce implică potențialul modelului HFC de a testa noi candidați la medicamente care reglementează lipidele.
Efectul ezetimibului și simvastatinei asupra profilelor de expresie a genelor și proteinelor
Tratamentul cu dietă HFC 2,5% a redus semnificativ expresia srebf2, hmgcs1 și hmgcra. Cu toate acestea, tratamentul cu ezetimib al 2,5% larvelor alimentate cu HFC a crescut expresia ARNm a srebf2, hmgcs1 și hmgcra, dar acest lucru nu a fost găsit în grupul de 2,5% HFC + simvastatină (Fig. 5a). Deși expresia ARNm a acox3 au fost scăzute la nivelul ficatului din grupul 2,5% HFC + simvastatină comparativ cu grupul 2,5% HFC, nu au existat diferențe remarcabile în expresia pparab, cpt1a în ficatul grupului 2,5% HFC + ezetimib și a grupului 2,5% HFC + simvastatină comparativ cu grupul HFC 2,5% (Fig. 5b). În plus, tratamentul cu ezetimib și simvastatină ar putea inhiba stresul de urgență indus de dieta de 2,5% HFC și ar reduce expresia atf6, hspa5 și hsp90b1 la nivelul ARNm. În concordanță cu modificările nivelului ARNm, expresia proteinei GRP78/BiP a scăzut în grupul 2,5% HFC + ezetimib și 2,5% HFC + simvastatină (Fig. 5c). Aceste rezultate sugerează că ezetimibul și simvastatina ameliorează semnificativ steatoza indusă de HFC ar putea prin reglarea metabolismului lipidic sau a căii de stres ER.
Discuţie
Aici am demonstrat că tratamentul dietelor HF și HFC pentru larvele de pește zebră a indus un fenotip semnificativ similar steatozei umane, caracterizat prin depunere excesivă de picături lipidice în ficat și modificări ale expresiei genelor implicate în metabolismul lipidic și stresul ER. Mai mult, incidența și gradul de steatoză au fost mai severe în larvele alimentate cu dietă HFC comparativ cu larvele alimentate cu dietă HF, sugerând că colesterolul promovează acumularea de lipide hepatice. Am confirmat apoi că steatoza ar putea fi ameliorată prin tratamentul cu ezetimib și simvastatină, susținând utilizarea modelului HFC pentru testarea medicamentelor anti-steatoză. Acest model va fi un sistem eficient și cu costuri reduse pentru studierea mecanismelor proceselor patologice în steatoza precoce, precum și pentru testarea agenților noi de reglare a lipidelor.
Abilitatea de a efectua screening-ul de mare capacitate al medicamentelor este un avantaj remarcabil al modelului larvelor pentru studiile NAFLD. Spre deosebire de peștii adulți, lipidele pot fi vizualizate direct în larvele transparente și în tineri folosind metoda de colorare a roșului cu ulei în întregime [13, 38-41]. Această metodă simplă oferă un mijloc de producție ridicat pentru a detecta incidența steatozei în larve, permițându-ne să examinăm steatoza pe un număr mare de pești. Aici, am ales două medicamente, ezetimibul și simvastatina, pentru a demonstra validitatea modelului nostru pentru depistarea medicamentelor anti-steatoză. Dovezile acumulate indică faptul că ezetimibul și simvastatina pot îmbunătăți steatoza și NASH la modelele de pești și la mamifere [42-44]. În modelul nostru HFC, am constatat, de asemenea, că aceste două medicamente au indus o scădere semnificativă a acumulării de lipide în ficat, ceea ce implică potențialul acestui model de a testa noi medicamente care reglementează lipidele.
Aici am stabilit un model de steatoză pește zebră larvară într-o perioadă relativ scurtă menținută pe diete. Modelul nostru de steatoză HFC alimentat cu diete are mai multe avantaje. În primul rând, steatoza indusă de dietă seamănă cel mai mult cu patologia umană a NAFLD. Dieta HFC nu este o dietă specială și imită cu ușurință obiceiurile alimentare umane. În al doilea rând, modelele de pește zebră ale NAFLD din studiile anterioare s-au concentrat în cea mai mare parte pe stadiul de larve timpurii și peștele zebră adult, există o lipsă de larve târzii și modele timpurii de puiet de NAFLD. Având în vedere acest lucru, modelul HFC a fost util pentru a furniza mai multe informații despre steatoza indusă de dietă în perioada larvelor târzii și a primilor tineri. În al treilea rând, acest model are un mare potențial pentru explorarea patogeniei steatozei timpurii și efectuarea screening-ului medicamentelor cu randament ridicat. Cu toate acestea, acest model are unele dezavantaje. De exemplu, peștii de sex feminin care rareori s-au împerecheat cu bărbații sunt capabili să aibă descendenți de calitate slabă, ceea ce poate provoca mortalitate ridicată. Mai mult, parametrii biochimici serici multipli sunt greu de detectat, deoarece peștele zebră larvar este prea mic pentru a extrage sânge. În plus, este o lucrare care necesită mult timp pentru a diseca ficatul de peștii mici.
În concluzie, am stabilit un nou model de pește zebră larvară al steatozei hepatice utilizând tratamentul dietetic HFC. Acest model are un mare potențial de explorare a relațiilor dintre dieta și factorii gazdă care contribuie la patogeneza steatozei hepatice și capacitatea de a efectua screening-ul medicamentelor cu randament ridicat este crucială pentru dezvoltarea de noi intervenții sau terapii. Modelul nostru va oferi un nou instrument puternic în căutarea de noi medicamente pentru prevenirea și tratarea NAFLD.
Concluzie
Acest studiu a dezvoltat și validat un model de steatoză hepatică de pește zebră larvară pentru care ar putea fi utilizat in vivo screening și evaluarea eficacității medicamentelor anti-steatoză. Acest model de steatoză hepatică pește zebră larvară este ușor disponibil, la preț redus, cu un timp scurt de testare și ar putea accelera cercetarea și dezvoltarea medicamentelor anti-steatoză.
- Lipoatrofia - rezistența la insulină asociată și steatoza hepatică sunt atenuate de consumul de dietă
- Studiul privind dieta cu colesterol ridicat constată că carbohidrații, nu grăsimile saturate, sunt esențiale - SlashGear
- Colesterol ridicat Adăugați suc de rodie în dieta dvs. pentru a reduce colesterolul
- Titruri ridicate de IgG Antigliadin la iepurii de laborator au hrănit o dietă care conține grâu Un model pentru celiace
- Hipercolesterolemie Dieta cu conținut scăzut de carbohidrați benefică pentru persoanele cu colesterol ridicat - mai mult stil de viață -