Martin W. Elmlinger
1 Nycomed International Management GmbH, Thurgauerstrasse 130, 8152 Glattpark-Opfikon, Zurich, Elveția
Martin Kriebel
2 Institutul de Științe Naturale și Medicale, 72770 Reutlingen, Germania
Dan Ziegler
3 Institutul pentru Diabetologie Clinică, Centrul German pentru Diabet, Centrul Leibniz pentru Cercetarea Diabetului la Universitatea Heinrich Heine, Düsseldorf, Germania
4 Departamentul de Boli Metabolice, Spitalul Universitar, Düsseldorf, Germania
Abstract
Introducere
Polineuropatia simetrică distală diabetică (DPN) afectează aproximativ o treime din pacienții diabetici și este asociată cu morbiditate substanțială, inclusiv durere neuropatică dureroasă și ulcere ale piciorului care duc la amputare (Ziegler și colab. 2008; Boulton și colab. 2005). Analgezicele sunt eficiente în tratamentul durerii neuropatice (Dworkin și colab. 2007), dar nu încetinesc progresul neuropatiei subiacente (Boulton și colab. 2005). Au fost dezvoltate diverse abordări terapeutice pentru tratarea DPN (Cameron și colab. 2001), care abordează patologia tulburării, mai degrabă decât doar ameliorează durerea (Ziegler și colab. 1995; Boulton și colab. 2005; Chalk și colab. 2007). Cu toate acestea, în ciuda progreselor recente aparente, o terapie durabilă puternică a DPN rămâne în continuare o nevoie medicală nerezolvată.
Actovegin, un hemodializat deproteinizat produs din sânge de vițel, care conține compuși cu greutate moleculară mică de până la 5.000 Da, sa dovedit a avea beneficii terapeutice substanțiale în DPN. Recent, un studiu randomizat, dublu-orb, controlat cu placebo, cu tratament secvențial intravenos și actovegin oral pe 567 de pacienți cu DPN a fost efectuat pe o perioadă de 160 de zile (Ziegler și colab. 2009). Tratamentul cu Actovegin a îmbunătățit semnificativ simptomele neuropatice, cum ar fi pragul de percepție a vibrațiilor, funcția senzorială și calitatea vieții pacienților cu DPN. Hemodializatul este aprobat ca medicament (Actovegin ®) în mai multe țări și se aplică pentru tratarea polineuropatiei diabetice și a altor boli (pentru revizuire a se vedea: Buchmayer și colab. 2011).
Scopul prezentei investigații a fost de a elucida efectele celulare, prin care actovegina își poate exercita efectele terapeutice benefice în DPN. Acțiunile farmacologice cunoscute ale actoveginei sunt stimularea absorbției oxigenului, utilizarea oxigenului și metabolismul energiei celulare (Obermaier-Kusser și colab. 1989; Buchmayer și colab. 2011). Mai mult, exercită activitate asemănătoare insulinei, cum ar fi stimularea transportului glucozei, piruvat dehidrogenazei și oxidării glucozei (Jacob și colab. 1996). Datorită acestor proprietăți, actovegina a fost utilizată anterior pentru tratarea tulburărilor vasculare și degenerative cerebrale (Kanowski și colab. 1995; Herrmann și colab. 1992). În plus, hemodializatele administrate sub formă de perfuzii au arătat efecte benefice asupra semnelor clinice ale demenței (Schlaffer și colab. 1991; Beiswenger și colab. 2008), care pot indica efecte regenerative asupra țesutului neuronal.
Materiale și metode
Pregătirea culturilor neuronale
Culturile disociate de neuroni hipocampici de șobolan au fost preparate conform unui protocol standard (Maar și colab. 1997). Țesutul hipocampic din fetuții de șobolani embrionari din ziua 18 a fost colectat în soluție sterilă de sare echilibrată Hanks [tampon HBSS [Invitrogen, Karlsruhe, Germania] conținând HEPES 7 mM, pH 7,3) și tripsinizat utilizând 1 × tripsină - EDTA (PAA, Pasching, Austria) conținând 10 mM HEPES, pH 7,3. Mediul fără ser și condițiile de cultură au fost adaptate pentru creșterea celulelor neuronale pentru a minimiza creșterea contaminării altor tipuri de celule gliale. Combinația de colorare nucleară și microscopie cu contrast de fază a asigurat că numărul de celule numărate reflectă modificări ale numărului de celule neuronale. Ulterior, țesutul a fost triturat în tampon HBSS - HEPES până când nu s-au văzut aglomerări de țesut. Numărul de celule a fost determinat și 2 × 104 celule/godeu au fost însămânțate în 100 μl mediu NMEM-B27 (Burkarth și colab. 2007; Goetze și colab. 2003) în plăci cu 96 de godeuri acoperite cu poli-l-lizină (Greiner Bio- Unul, Frickenhausen, Germania) și cultivat la 37 ° C și 5% CO2.
Actovegin Tratamentul neuronilor hipocampici de șobolan
Neuronii hipocampici de șobolan au fost tratați cu doze crescânde (0,3, 1, 3, 10, 30, 100, 300, 1.000 μg/ml) de actovegină (Actovegin®, Nycomed, Linz, Austria) prin adăugarea a 50 μl de soluție stoc prediluată la culturi, la 5 ore după placare. A fost testată o gamă largă de doze, deoarece nu a fost posibilă definirea unei doze care se referă la doza aplicată în terapia pacienților cu diabet zaharat. Celulele au fost cultivate la 37 ° C și 5% CO2 într-o atmosferă umidificată. Efectele tratamentului cu Actovegin au fost explorate în ceea ce privește menținerea culturii și conectivitatea sinaptică, creșterea neuritei și neuroprotecția (adică protecția împotriva apoptozei induse de Aβ25-35). Mai mult, protecția prin actovegină de stresul oxidativ (nivelurile ROS) a fost testată la neuronii de șobolan.
Imunocitochimie
Pentru etichetarea imunocitochimică a dendritelor cu anticorpi împotriva proteinei 2 asociate microtubulilor (MAP2; în zilele 3 și 6 ale culturii in vitro) pentru a fi utilizate în analiza ulterioară a creșterii neuritei și a sinapselor excitatorii (Vesicular Glutamate Transporter 1 (VGlut1); ziua 10 ) în scopul evaluării conectivității sinaptice, neuronii hipocampici cultivați au fost fixați cu 4% paraformaldehidă în soluție salină tamponată cu fosfat (PBS) timp de 15 minute la temperatura camerei.
Celulele au fost spălate o dată cu PBS și apoi blocate și îmbibate cu reactiv de blocare (Roche Diagnostics GmbH, Mannheim, Germania) conținând 0,2% Triton X-100 (Sigma-Aldrich, Steinheim, Germania) timp de 1 oră la temperatura camerei. Anticorpii primari împotriva proteinei 2 asociate microtubulilor (MAP2; Sigma-Aldrich) și a transportorului glutamat vezicular 1 (VGlut1; Synaptic Systems, Göttingen, Germania) au fost diluați [1: 1.000] în reactiv de blocare conținând 0,2% Triton X-100 și incubat cu celulele la 4 ° C peste noapte. Celulele au fost spălate cu PBS și anticorpii primari au fost detectați cu IgG de capră anti-șoarece conjugat cu Cy3 (diluat 1: 600; Dianova, Hamburg, Germania) în timpul unei incubări de 2 ore la temperatura camerei. Nucleele au fost colorate cu Hoechst 33258 (1 mg/ml; Invitrogen GmbH, Darmstadt, Germania). Concentrația de lucru de 1 μg/ml a fost atinsă printr-o diluție de 1: 1.000 în PBS. Celulele au fost spălate și depozitate la 4 ° C până la examinarea prin microscopie cu fluorescență. Achiziția de imagini a fost efectuată pe un Zeiss Axiovert 200.
Numărul de celule, creșterea neuritei și conectivitatea sinaptică a neuronilor hipocampici de șobolan
Lungimile medii ale neuritei culturilor neuronale marcate cu MAP2 au fost determinate folosind MediaJ-Plugin Neurite Average (Institutul de Științe Naturale și Medicale, Reutlingen, Germania), care folosește principiile stereologiei (Ronn et al. 2000). Determinarea numărului de conexiuni sinaptice ale culturilor neuronale marcate cu VGlut1 și numărarea numerelor de celule a fost efectuată folosind funcția ImageJ’s Analyze Particles: http://rsb.info.nih.gov/ij/.
Pe scurt, Neurite Average proiectează o rețea virtuală pe micrografii ale culturilor neuronale etichetate MAP2 și determină numărul de intersecții ale acestei rețele cu structuri dendritice pozitive MAP2. Numărul acestor intersecții corespunde gradului de arborizare dendritică la un moment dat dat. Micrografiile culturilor neuronale colorate cu Hoechst 33258 sau VGlut1 au fost praguri și binearizate și semnalele rezultate au fost numărate.
Aβ25–35 Tratamentul și inducerea apoptozei neuronilor hipocampici de șobolan
Măsurarea stresului oxidativ
Nivelurile de stres oxidativ, și anume, nivelul ROS, în neuronii hipocampului de șobolan, au fost determinate în ziua 8 după tratamentul cu hidroperoxid de terț-butil (TBHP) pentru a induce producerea ROS în mod experimental sau, respectiv, în ziua 10 după tratamentul cu actovegin. În cazul tratamentului cu TBHP, mediul de cultură celulară a fost înlocuit în ziua 8 cu 100 μl de NMEM-B27 proaspăt și s-au adăugat diferite concentrații de TBHP la mediul de cultură celulară prin adăugarea a 50 μl de soluție stoc TBHP prediluată în NMEM-B27 la atinge concentrații finale de 0,1, 0,2, 0,3, 0,5, 0,8, 1, 2 și respectiv 3 mM. Celulele au fost incubate la 37 ° C și 5% CO2 timp de o oră înainte de a fi supuse măsurătorilor ROS.
Pentru determinarea nivelurilor de ROS celulare, culturile neuronale, tratate cu TBHP sau actovegin, au fost spălate de două ori cu tampon HBSS preîncălzit și s-au adăugat 50 μl dintr-o soluție stoc 15-μM c-H2DCFDA după ultima etapă de spălare (concentrația c-H2DCFDA, 5 μM per godeu). Celulele au fost incubate timp de 25 minute la 37 ° C și 5% CO2 și excesul de c-H2DCFDA a fost spălat cu HBSS preîncălzit. Intensitatea fluorescenței (proporțională cu conținutul total al ROS) a fost măsurată cu un cititor de microplăci Pherastar utilizând un set de filtri de 485/520 nm. Pentru a calcula conținutul ROS pe bază de celulă, numerele de celule au fost cuantificate pe aceeași placă, direct în urma înregistrării semnalului fluorescent utilizând testul de viabilitate a celulei luminescente CellTiter-Glo ® descris mai sus.
Analize statistice
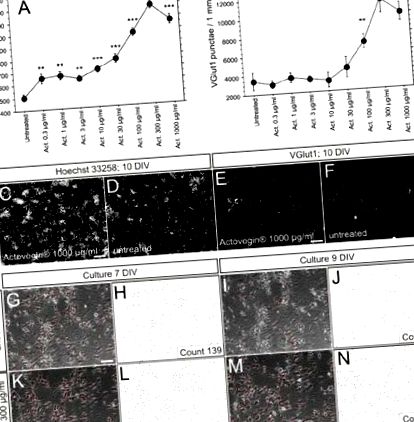
Seturile de date experimentale au fost analizate cu ajutorul software-ului Statview 5.0 (SAS-Institute Inc.) utilizând analiza unidirecțională a varianței și testele post hoc ale lui Fisher’s PLSD (diferență mai mică semnificativă protejată). Au fost efectuate cel puțin trei replici pentru toate experimentele. Toate rezultatele sunt prezentate ca valori medii ± SEM. Datele au fost considerate a fi semnificativ diferite la valorile P 1 a). Creșterea numărului de celule observate a fost dependentă de doză. Micrografiile reprezentării nucleare și colorarea sinaptică a culturilor tratate cu actovegin și netratate în ziua 10 sunt prezentate în Fig. 1 c - f. Culturile care au fost inspectate în zilele 7 și 9 in vitro utilizând microscopie cu contrast de fază au arătat o menținere îmbunătățită a numărului de celule neuronale și o creștere a densității rețelei dendritice în actovegină, comparativ cu culturile netratate; acest rezultat a fost verificat prin numărarea manuală a celulelor neuronale (Fig. 1 g - n).
Evaluare a A numărul celulei prin colorarea nucleelor și b numărul de sinapsă excitativă totală prin transportorul vezicular glutamat 1 (VGlut1) colorat în ziua 10 in vitro după incubarea neuronilor primari de șobolan cu concentrații crescânde de Actovegin ® (Act.; 0,3-1,000 μg/ml) comparativ cu celulele netratate. Fiecare punct reprezentat reprezintă valoarea medie obținută din șase puțuri replicate; barele de eroare reprezintă SEM. *** P ® sau lăsat netratat (bară de scală: 200 μm [C], 50 μm [E]). g-n: Micrografii reprezentative de contrast de fază și determinarea manuală a neuronilor în netratate (g-j) și Actovegin ® 300 μg/ml tratat (k-n) culturi neuronale primare în ziua 7 și ziua 9 in vitro, respectiv (bară de scală în Fig. 1c: 200 μm; bare de scală în Fig. 1e, g, k: 50 μm; DIV = zile in vitro)
Conectivitate sinaptică a neuronilor primari de șobolan
Discuţie
În studiul de față, am folosit neuroni hipocampici cultivați din creierul șobolanului embrionar ca model in vitro pentru a studia efectele medicamentelor asupra țesuturilor neuronale. Neuronii au fost tratați cu concentrații crescute de actovegină pentru a identifica posibilele efecte celulare, care pot explica efectele terapeutice benefice la pacienții cu polineuropatie diabetică simptomatică (DPN).
Deoarece culturile neuronale au fost derivate din țesutul hipocampic de șobolan, este posibil ca tipuri de celule non-neuronale, cum ar fi astrocitele, să fi fost prezente și să fi contribuit la creșterea numărului de celule observate aici. Cu toate acestea, celulele neuronale ar putea fi ușor identificate prin microscopie cu contrast de fază datorită morfologiei lor, iar o expansiune a celulelor gliale nu a fost observată nici în culturile tratate cu actovegină, nici în culturile netratate. Mai mult decât atât, este puțin probabil ca numărul de celule mult mai mare observat după tratamentul cu actovegin să se fi datorat creșterii numărului de celule non-neuronale, deoarece nu au existat dovezi pentru o modificare (adică reducere) a contactelor sinaptice pe bază de celule așa cum ar fi putut fi cauzat de o creștere a numărului de celule non-neuronale.
Pentru a face lumină asupra naturii proprietăților active ale Actovegin ®, au fost efectuate mai multe experimente pentru a evalua efectele tratamentului neuronilor primari de șobolan cu cantități crescânde de ser fetal de vițel (FCS), care este, de asemenea, derivat din sângele vițel ca actovegin. Aici, s-a observat o tendință ușoară, dar statistic nesemnificativă, către creșterea numărului de celule și a conexiunilor sinaptice la doze submaximale de FCS. Acest lucru poate argumenta pentru un efect benefic mai puternic al Actovegin ® datorită îmbogățirii substanței (substanțelor) fiziologice active în timpul producerii Actovegin ® .
Deși s-a constatat că numărul de celule a fost menținut în prezența Actovegin ®, experimentele care au explorat inducerea apoptozei au sugerat că nu a existat niciun efect al Actovegin ® în sine asupra reducerii apoptozei atunci când a fost evaluat în ziua 10 a culturii în absența apoptozei care induce agenți precum peptidele amiloide. Această aparentă discrepanță sugerează că pierderea celulelor neuronale poate apărea prin alte mecanisme decât apoptoza.
Cu toate acestea, trebuie reținut faptul că, în ciuda clarității sale, relevanța studiului in vitro actual pentru efectele benefice in vivo ale Actovegin ® observate la pacienții cu polineuropatie diabetică este limitată și trebuie clarificată în continuare prin experimente in vivo. abordări, inclusiv studii pe animale și pe oameni. Trebuie remarcat faptul că cele mai mari concentrații de Actovegin utilizate experimental, care sunt în domeniul supra-fiziologic, au arătat o tendință de a fi mai puțin eficiente în ceea ce privește expresia VGlut-1 și numărul de celule.
În concluzie, efectele neuroprotectoare observate in vitro sunt în concordanță cu rezultatele studiilor clinice anterioare (Ziegler și colab. 2009; Saletu și colab. 1990; Semlitsch și colab. 1990) și indică faptul că Actovegin ® ar putea oferi o opțiune potențială de tratament pentru tulburări neurodegenerative.
Mulțumiri
Acest studiu a fost sponsorizat de Nycomed GmbH, Konstanz, Germania. Autorii îi mulțumesc lui Andreas Dieckmann, Tatiana Bobrova și Katrine Husum de la Nycomed pentru contribuția lor științifică la studiu și manuscris.
Conflict de interese Acest studiu a fost sponsorizat de Nycomed GmbH, Konstanz, Germania. Martin Elmlinger este angajat al Nycomed. Dan Ziegler a primit o taxă pentru activități de vorbire și consultanță de la Nycomed GmbH. Martin Kriebel, adică NMI Reutlingen, Germania, nu are conflicte de interese de declarat.
Acces deschis Acest articol este distribuit în condițiile licenței necomerciale de recunoaștere Creative Commons, care permite orice utilizare necomercială, distribuire și reproducere pe orice suport, cu condiția ca autorul (autorii) original (e) și sursa să fie creditate.
- Efectele neuroprotectoare pleiotropice ale taxifolinei în angiopatia amiloidă cerebrală PNAS
- Efectele neuroprotectoare ale Momordica charantia O revizuire din studii preclinice internaționale
- Myricitrin prezintă efecte anti-aterosclerotice și anti-hiperlipidemice în dieta indusă
- Sortarea efectelor alcoolului asupra sănătății - Harvard Health Blog - Harvard Health Publishing
- Quercetin Beneficii pentru sănătate, dozare și efecte secundare