Dr. Khan este acum accesibil la: Divizia de analiză și cercetare a informațiilor despre sănătate, Filiala Primelor Națiuni și Inuit Health, Jeanne Mance Bldg (Rm. 1964C), Health Canada, Tunney’s Pasture, Ottawa, ON K1A 0K9
rezumat
fundal
Există numeroase dovezi anecdotice și științifice care arată că stresul declanșează comportamentul alimentar, dar mecanismele fiziologice subiacente rămân incerte. Axa hipotalamo-hipofizo-suprarenală (HPA) este un mediator cheie al răspunsurilor la stres fiziologic și poate juca un rol în legătura dintre stres și aportul alimentar. Răspunsurile la cortizol la factorii de stres de laborator prezic consumul, dar nu este clar dacă astfel de răspunsuri marchează o vulnerabilitate la alimentația legată de stres sau dacă cortizolul stimulează direct consumul la om.
Metode
Am perfuzat adulții sănătoși cu hormon de eliberare a corticotropinei (CRH) la o doză care este subiectiv nedetectabilă, dar care generează un răspuns robust de cortizol endogen și am măsurat consumul ulterior de gustări, permițând analiza efectelor reactivității HPA asupra consumului de alimente fără efectele psihologice complexe ale o paradigmă a stresului.
Rezultate
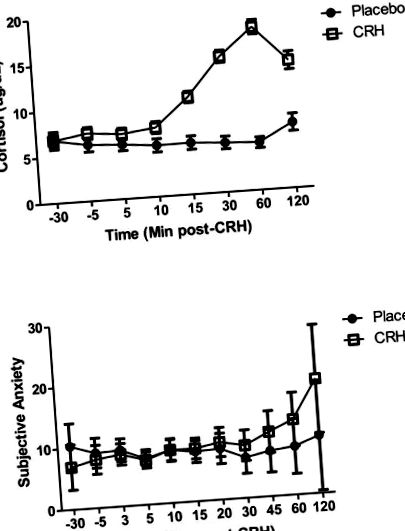
CRH a crescut nivelurile de cortizol comparativ cu placebo, dar nu a avut un impact anxietate subiectivă. Subiecții au consumat mai mult după CRH decât după placebo și răspunsul maxim la cortizol la CRH a fost puternic legat atât de aportul caloric, cât și de consumul total.
Concluzii
Aceste date arată că reactivitatea axei HPA la stimularea farmacologică prezice consumul ulterior de alimente și sugerează că cortizolul în sine poate stimula în mod direct consumul de alimente la om. Înțelegerea mecanismelor fiziologice care stau la baza alimentației legate de stres se poate dovedi utilă în eforturile de a ataca crizele de sănătate publică create de obezitate.
Introducere
Relația dintre stres și apetit este complexă. Stresul poate crește și reduce consumul de alimente (Levine și Morley 1981; Morley și colab., 1983) și poate contribui atât la obezitate, cât și la anorexie. Răspunsurile apetitive la stres sunt modelate de o serie de procese atât fiziologice, cât și psihologice. Există dovezi în creștere pentru contribuțiile factorilor psihosociali specifici în alimentația indusă de stres (Grunberg și Straub 1992; O'Connor și colab., 2008; Oliver și colab., 2000; Stone și Brownell 1994; Wardle și colab., 2000; Weinstein și colab., 1997), dar este mai puțin cunoscut despre mecanismele fiziologice subiacente. Axa hipotalamo-hipofizo-suprarenală (HPA) este un mediator principal al răspunsurilor la stres fiziologic și poate juca un rol în legătura dintre stres și aportul alimentar. Ca răspuns la amenințarea sau provocarea percepută, hormonul care eliberează corticotropina (CRH) este eliberat din hipotalamus, declanșând eliberarea hormonului adrenocorticotrop (ACTH) din hipofiză, urmată de eliberarea glucocorticoidului (GC) din cortexul suprarenal (Tsigos și Chrousos 2002). Glucocorticoizii (cortizol la om, corticosteron la animale) sporesc disponibilitatea glucozei prin descompunerea proteinelor, gluconeogeneză și lipoliză, facilitând adaptarea prin mobilizarea energiei.
Glucocorticoizii influențează, de asemenea, comportamentul și pot influența în continuare disponibilitatea energiei prin modificarea aportului de alimente. La om, administrarea cronică a GC crește aportul alimentar ad libitum (Tataranni și colab., 1996). La modelele animale, GC-urile par să aibă un impact asupra aportului caloric prin efecte neuropharmacologice directe (Dallman și colab., 2007) și s-a demonstrat că corticosteronul crește în funcție de doză aportul de alimente gustoase precum zaharoza, zaharina (Bhatnagar și colab., 2000) . și untură (la Fleur și colab., 2004). Aceste descoperiri pot fi relevante pentru epidemia modernă de obezitate - eliberarea repetată de GC legată de stres ar putea provoca un aport excesiv de alimente bogate în calorii și ar putea contribui la creșterea în greutate. Într-adevăr, animalele predispuse la obezitate s-au dovedit a avea nevoie de glucocorticoizi circulanți pentru a se produce (Bray 1985), iar antagonismul receptorilor GC previne sau inversează creșterea în greutate la aceste animale (Okada și colab., 1992). Interesant este că la om există și o legătură între răspunsul crescut al axei HPA la stres și obezitatea abdominală (Epel și colab., 1999; Epel și colab., 2000; Pasquali și colab., 1993; Pasquali și colab., 1999).
Astfel, eliberarea GC, un produs final cheie al activării stresului, produce efecte fiziologice care pot afecta disponibilitatea energiei, comportamentele apetitive și menținerea obezității. GC crescute ca răspuns la stres pot fi, de asemenea, o trăsătură asociată cu obezitatea abdominală. Cu toate acestea, în ciuda acestor dovezi, o relație directă între stimularea axei HPA și aportul crescut de alimente nu a fost demonstrată la om. Există dovezi pentru o legătură între reactivitatea la stres și consumul de alimente, deoarece răspunsul cortizolului la un factor de stres de laborator a prezis un aport crescut, în special de alimente bogate în calorii, într-un grup de femei adulte sănătoase (Epel și colab., 2001) și, de asemenea, a prezis o legătură între bătăile zilnice măsurate ecologic și gustarea crescută (Newman și colab., 2007). În mod interesant, în primul studiu, aportul a fost semnificativ legat de răspunsul la cortizol imediat după stres, dar nu de cortizolul total secretat, sugerând importanța reactivității la stres.
Cu toate acestea, este dificil să se stabilească din aceste studii dacă reactivitatea la stres HPA marchează un factor de vulnerabilitate separat care contribuie la consumul legat de stres, fără a fi legat cauzal de creșterea consumului sau dacă glucocorticoizii stimulează direct comportamentul alimentar la oameni, așa cum se întâmplă la animale . În timp ce cauzalitatea ar putea fi cea mai direct evaluată prin administrarea acută de glucocorticoizi și măsurarea consumului de alimente, administrarea exogenă a medicamentelor prezintă numeroase diferențe față de eliberarea endogenă și nu ar fi paralelă cu eliberarea de glucocorticoizi indusă de stres, care apare de obicei prin stimularea hipofizei. În acest studiu, am investigat dacă eliberarea endogenă de cortizol provocată de stimularea directă a hipofizei, în absența stresului psihologic, ar contribui la creșterea consumului de alimente. Am făcut acest lucru prin perfuzarea adulților sănătoși, ne-obezi, cu CRH la o doză subiectiv nedetectabilă (care nu provoacă stres sau anxietate) și măsurarea consumului de alimente ulterior.
Metode
Subiecte
Paisprezece subiecți (8 femei, 6 bărbați) cu vârste cuprinse între 18 și 42 de ani (medie 23,3 ± 6,2) ani au fost recrutați prin publicitate și selectați utilizând Interviul Clinic Structurat pentru DSM-IV. Au fost sănătoși din punct de vedere medical, fără antecedente de boli psihiatrice, dependență de droguri sau alcool, abuzuri recente (6 luni) de droguri, alcool sau tutun și au raportat niveluri scăzute de tutun și consum de alcool. Subiecții au avut analize negative ale medicamentelor în urină și rezultate normale de laborator și au fost în + 30%/- 10% din greutatea corporală ideală (medie 69,4 ± 10,6 kg). Femelele au fost pre-menopauză, nu au utilizat pastile contraceptive, nu au fost însărcinate sau nu au alăptat și au fost studiate în decurs de 10 zile de la debutul menstruației. Subiecții au acordat consimțământ scris și informat și au primit câte 200 USD fiecare. Studiul a fost aprobat de Consiliul nostru de revizuire instituțională.
Proiectare și proceduri
Subiecții au raportat de două ori la un centru general de cercetare clinică (GCRC) și au primit injecții intravenoase de placebo (0,9% soluție salină) și CRH ovină (0,3 ug/kg; Acthrel, Ferring Pharmaceuticals, Tarrytown, NY) separate de 1 până la 7 zile. Opt subiecți au primit placebo mai întâi și șase au primit CRH mai întâi. Li s-a spus că ar putea primi ambele substanțe la ambele vizite. Subiecții și asistentele medicale GCRC erau orbi la condiție.
Subiecții raportați pentru studiu la 13:00. Anchetatorul a descris pe deplin procedurile și efectele secundare comune ale CRH. Subiecții au fost însoțiți la GCRC, unde un cateter intravenos (picurare salină) a fost introdus într-o venă antecubitală la
1330h. Subiecții s-au odihnit în pat timp de 1,5 ore, citind sau urmărind la televizor, pentru a se acomoda cu decorul. Probele de sânge inițiale au fost obținute la 1500h și 1525h. La ora 15:30, anchetatorul s-a întors (în spatele unei perdele, din conștientizarea subiectului) pentru a injecta ser fiziologic sau CRH peste 10 sec. CRH a fost preparat cu o oră înainte de injectare și refrigerat până la utilizare. Sângele a fost extras în tuburi de vid cu gheață la 5, 10, 15, 30, 60 și 120 de minute după administrarea medicamentului, a fost centrifugat într-o centrifugă refrigerată în 5 minute, separat și înghețat (-70 ° C).
Măsuri și analize
Simptomele emoționale au fost înregistrate la momentul fiecărei probe de sânge folosind scale analogice vizuale (VAS) care măsoară stările de simțire pe linii de 100 mm („deloc” până la „cele mai multe”). Variabila dependentă principală a fost suferința anxioasă subiectivă, calculată utilizând suma evaluărilor VAS de „anxios”, „nervos” și „înfricoșător”. Cortizolul a fost testat utilizând testul Coat-A-Count de la Diagnostic Products Corporation (Los Angeles, California). Sensibilitatea a fost de 0,2 μg/dL. Coeficienții de variație au fost mai mici de 10%.
Analiză
Au fost utilizate analize de varianță (RM-ANOVA) cu doi factori (Time X Drug) pentru a evalua impactul CRH (față de placebo) asupra cortizolului și a răspunsurilor subiective. Interesul nostru principal este totuși impactul cortizolului asupra consumului de alimente și care a fost examinat folosind RM-ANOVA subiecți pentru a compara aportul de alimente după CRH cu alimente consumate după placebo. Variabila noastră dependentă de principiu a fost aportul măsurat în calorii, dar am examinat și aportul total în grame în analize confirmative. Relația dintre aportul de alimente și nivelurile de cortizol a fost examinată în continuare prin regresarea aportului de alimente la răspunsul maxim al cortizolului (post-CRH maxim minus valoarea inițială de bază) și nivelurile de cortizol în momentul consumului (120 de minute după perfuzie) utilizând corelațiile Pearson.
Rezultate
A. Răspunsurile cortizolului la injecția cu CRH sau placebo (medie ± SE); B. Evaluări de anxietate subiectivă după CRH sau injecție placebo (medie ± SE).
A. Relația dintre răspunsul cortizolului la CRH și numărul de calorii consumate; B. Relația dintre răspunsul cortizolului la CRH și cantitatea de alimente ingerate.
Discuţie
Administrarea de doze mici de CRH a crescut semnificativ aportul de alimente comparativ cu o injecție placebo la adulți sănătoși, neobezi, măsurată atât din calorii, cât și din totalul de grame consumate. Amploarea răspunsului de vârf la cortizol la CRH a fost un predictor puternic al consumului ulterior de alimente. Aceste date extind dovezi crescânde ale unei legături între sistemele de răspuns la stres și comportamentul alimentar uman, sugerând că activitatea din cadrul axei HPA - sistemul nostru central de răspuns neuroendocrin la stres - este legată neurobiologic de consumul de alimente.
Munca anterioară a arătat că amploarea răspunsului HPA la un factor de stres psihosocial de laborator este asociată cu un consum mai mare de alimente (Epel și colab., 2001) și prezice, de asemenea, viața reală, consumul legat de stres în zilele următoare (Newman și colab., 2007). Niciunul dintre aceste studii nu a reușit însă să asocieze în mod direct activitatea axei HPA cu aportul crescut de alimente. În primul studiu, un factor de stres psihosocial intens a fost utilizat pentru a activa axa HPA, dar nu se știa dacă alte aspecte non-hormonale ale experienței de stres au declanșat atât mai mult eliberare de cortizol, cât și consum crescut. În cel de-al doilea studiu, amploarea reactivității HPA față de un factor de stres psihosocial similar a prezis creșterea consumului de mâncare în asociere cu complicații zilnice în următoarele zile, dar în acest caz reactivitatea HPA ar fi putut marca o vulnerabilitate la alimentația legată de stres. Nu s-au colectat date cu privire la nivelurile de cortizol la momentul consumului, iar literatura este contradictorie în ceea ce privește dacă tipurile de complicații documentate sunt susceptibile de a provoca eliberarea suficientă de cortizol pentru a determina comportamentul alimentar (Dickerson și Kemeny 2004; van Eck și colab., 1996 ). Prin urmare, în ambele cazuri, mecanismele care leagă reactivitatea la stres de comportamentul alimentar au rămas neclare.
Atât datele despre animale, cât și alte date umane susțin un rol direct pentru glucocorticoizi în reglarea apetitului. Administrarea GC poate crește consumul de alimente (Bell și colab., 2000; Bhatnagar și colab., 2000; la Fleur și colab., 2004; Tataranni și colab., 1996) crescând cel mai mult aportul de alimente gustoase. Creșterea nivelului de glucocorticoizi este asociată cu creșterea secreției de insulină (Strack și colab., 1995). Efectele combinate ale glucocorticoizilor asupra consumului de alimente cu densitate mare de energie și probabilitatea crescută ca energia consumată să fie stocată ca grăsime în prezența insulinei înseamnă că hiperactivitatea HPA poate fi un mecanism prin care obezitatea se produce și se menține ulterior. Un studiu recent a demonstrat că persoanele care mănâncă ca răspuns la stres prezintă atât insulină nocturnă crescută și cortizol (Epel și colab., 2004), cât și niveluri ridicate de creștere în greutate. Prin urmare, „consumatorii de stres” ar putea prezenta un risc deosebit de mare pentru dezvoltarea și menținerea obezității și a problemelor de sănătate asociate.
Mecanismul precis de legare a aportului alimentar la reactivitatea cortizolului, atât în paradigmele psihosociale (Epel și colab., 2001), cât și în paradigmele provocării CRH, rămâne de elucidat, dar datele actuale susțin ipoteza că cortizolul în sine poate juca un rol cauzal în creșterea consumului de alimente. Este clar necesar un studiu suplimentar pentru a înțelege pe deplin mecanismele care stau la baza, dar o astfel de muncă se poate dovedi utilă în eforturile de a ataca crizele severe de sănătate publică create de obezitate.
Note de subsol
Declinarea responsabilității editorului: Acesta este un fișier PDF al unui manuscris neditat care a fost acceptat spre publicare. Ca serviciu pentru clienții noștri, oferim această versiune timpurie a manuscrisului. Manuscrisul va fi supus copierii, compunerii și revizuirii dovezilor rezultate înainte de a fi publicat în forma sa finală citabilă. Vă rugăm să rețineți că, în timpul procesului de producție, pot fi descoperite erori care ar putea afecta conținutul și că toate responsabilitățile legale care se aplică jurnalului se referă.
- Mâncarea rapidă, deoarece mesele de familie limitează consumul de alimente sănătoase, crește riscul de obezitate - ScienceDaily
- Efectele formei alimentare și momentul ingerării asupra apetitului și aportului de energie la adulții tineri slabi și
- Gustările din fructe sunt rețeaua alimentară sănătoasă Rețete, idei și mâncăruri sănătoase Rețea alimentară
- Profiterole de ciocolată - Ghid alimentar sănătos
- Alegeți alimente dietetice pentru slăbit, sucuri sănătoase, miere organică - ZOE