Abstract
fundal
Deși sângele din cordonul ombilical (CB) oferă promisiuni pentru tratamentul pacienților cu afecțiuni maligne hematologice cu risc crescut și tulburări imune, numărul limitat de celule stem hematopoietice (HSC)/celule progenitoare într-o unitate CB și circumstanțele strânse în extinderea ex vivo îl fac destul de provocator pentru a dezvolta terapii celulare de succes.
Metode
În acest studiu, a fost dezvoltată o nouă strategie pentru a sprijini expansiunea ex vivo a celulelor stem și progenitoare hematopoietice (HSPC) prin cocultură cu celule endoteliale arteriale ombilicale umane (HuAECs-E4orf1-GFP), care exprimă E4ORF1 stabil prin utilizarea unui sistem retroviral.
Rezultate
Cocultura celulelor CD34 + hCB cu HuAECs-E4orf1-GFP a dus la generarea de celule nucleate considerabil mai numeroase, CD34 + CD38 - și CD34 + CD38 - CD90 + HSPC în comparație cu cea a citokinelor singure sau cu cea a coculturii cu venă ombilicală umană celulele endoteliale (HuVECs) după 14 zile de amplificare. Potențialul de diferențiere multilineage in vitro și capacitatea de repopulare in vivo a celulelor hematopoietice expandate coculturate cu HuAECs-E4orf1-GFP au fost, de asemenea, semnificativ îmbunătățite comparativ cu celelalte două grupuri de control. DLL4, un factor determinant major al identității celulelor endoteliale arteriale (EC), a fost asociat cu celule CD34 + hCB amplificate pe HuAECs-E4orf1-GFP.
Concluzii
Colectiv, am demonstrat că HuAEC au acționat ca o nișă permisivă în facilitarea extinderii HSPC-urilor. Studiul nostru a implicat în continuare că factorii cruciale și căile conexe prezentate în HuAEC pot oferi un indiciu pentru a menține auto-reînnoirea HSC-urilor de bună-credință.
Introducere
Celulele stem hematopoietice (HSC), care locuiau în vârful unei ierarhii celulare sanguine complicate, se pot completa prin autoînnoire și pot da naștere tuturor celorlalte celule sanguine [1]. În prezent, generarea de HSC-uri din celule stem pluripotente (PSC), inclusiv celule stem pluripotente induse (iPSC) și celule stem embrionare (ESC), este probabil la îndemână [2,3,4]. Și măduva osoasă (BM), sângele din cordonul ombilical (UCB) sau sângele periferic mobilizat (MPB) este singura sursă de HSC disponibile în prezent [5,6,7]. În consecință, stabilirea unui sistem pentru extinderea ex vivo a HSC ar deschide o oportunitate unică de a studia auto-reînnoirea HSC umană și ar oferi o sursă nouă de celule terapeutice pentru tulburările sanguine. Atingerea acestui obiectiv necesită o înțelegere detaliată a elementelor cruciale care contribuie la amplificarea HSC și la menținerea funcției în nișa hematopoietică in vivo.
AEC-urile primare au capacitate limitată de expansiune și suferă nediferențierea în cultură [17, 18], ceea ce face dificilă aplicarea fiziologică ca nișă de hematopoieză. Din acest motiv, aici am dezvoltat linii stabile HuAEC care dețin caracteristicile convenționale ale AEC prin transducție de E4ORF1 si proteină fluorescentă verde (GFP) folosind vectori retrovirus (HuAECs-E4orf1-GFP). Acestea se bazează pe teoria E4orf1 ca semnal „pro-viață” pentru a promova supraviețuirea celulelor endoteliale primare (PEC) [19, 20]. Apoi am dezvăluit că HuAECs-E4orf1-GFP au potențialul de a crea o nișă permisivă pentru extinderea celulelor CD34 + hCB, așa cum este determinat de un set de markeri definiți în mod convențional pentru celulele stem și progenitoare hematopoietice umane (HSPC), testele coloniei și capacitate de repopulare in vivo la șoareci NOD.Cg-Prkdc scid Il2rg tm1Wjl/SzJ (NSG). Mai mult, am constatat că moleculele de semnalizare Notch contribuie la efectul de susținere al HuAECs-E4orf1-GFP. Datele noastre arată, pentru prima dată, o legătură funcțională între HuAEC și amplificarea HSC și indică rolul potențial al nișei vasculare arteriale pentru a decoda informațiile in vivo pentru auto-reînnoire și extinderea HSC umane.
Materiale și metode
Izolarea și cultura celulelor endoteliale arteriale/venoase ale cordonului ombilical
Pregătirea și transfecția virusului
HuAECs-E4orf1-GFP și celule endoteliale ale venei ombilicale umane proiectate [20] (HuVECs-E4orf1-GFP) au fost generate prin introducerea unui vector retroviral în HuAEC și HuVEC primare. Retrovirusul a fost generat prin transfectarea MSCV-N E4ORF1 (Addgene, Shanghai, China; specie, adenovirus uman 5; dimensiune, 384 bp plus 8162 bp; tip vector, expresie de mamifer, retroviral; markeri selectabili, puromicină) și pMX-GFP (furnizat de Dr. Hiroyuki Hirai, SUA) în celulele Plat A utilizând Lipofectamina 2000 (Invitrogen, Carlsbad, California, SUA). Constructele retrovirale au fost colectate la 44 și 68 de ore după transfecție. E4ORF1-EC transfectate au fost selectate cu 0,5 μg/ml puromicină (InvivoGen, Shanghai, China). DLL4 shRNA și shRNA de control (ambele poartă eticheta GFP) au fost proiectate de Genechem (Shanghai, China) și transfectate individual în HuAEC primare. Celulele GFP + transfectate au fost îmbogățite prin citometru cu flux de versuri (FACS) activat prin fluorescență (BD Biosciences, Franklin, NJ, SUA). Experimentele de transfecție cu virus au fost efectuate pe PEC de la trei donatori diferiți.
Citometrie de flux (FCM)
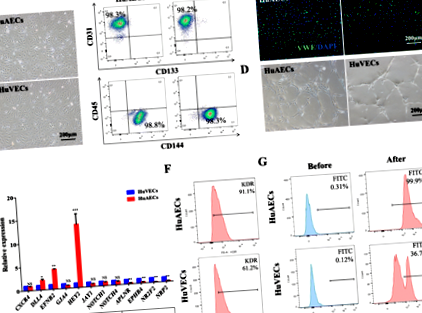
Analiza citometrică de flux a fost efectuată folosind următorii anticorpi: CD144-PE, CD45-APC, CD133-PE, CD31-APC și CD309-PE pentru HuAEC primare și HuVEC-uri; FVS510, CD34-PE, CD38-APC și CD90-PE-cy7 pentru teste cultivate ex vivo; și CD45-APC anti-uman, CD19-APC, CD11b-PerCP-CY5.5 și CD45.1-FITC anti-șoarece pentru experimente de transplant in vivo. Celulele au fost colorate la 4 ° C timp de 40 min, protejate împotriva luminii. Probele filtrate (70 μm) au fost analizate pe citometrul cu flux invers FACS. Toți anticorpii provin de la BD Biosciences (Franklin, NJ, SUA) sau eBioscience (San Diego, CA, SUA).
Imunofluorescența
HuAEC-urile primare și HuVEC-urile au fost colorate pentru confirmarea identității celulei. Culturile au fost fixate în paraformaldehidă 4% (Sigma-Aldrich, Shanghai, China), permeabilizate și blocate și apoi incubate peste noapte în soluție de blocare care conține anticorp primar împotriva factorului von Willebrand (vWF; 1: 500; Sino Biological, Beijing, China) . IgG anti-iepure de capră conjugat cu FITC (1: 200; Beijing Zhongshan Jinqiao Biological Technology, Beijing, China) a fost folosit ca anticorp secundar și DAPI (1 mg/ml; Roche, Basel, Elveția) ca un antipart de nuclee. Imagistica a fost efectuată utilizând microscopie confocală (PerkinElmer, Waltham, MA, SUA) și Volocity Software (PerkinElmer, Waltham, MA, SUA).
Analiza formării tubului
Pe baza descrierii anterioare [23], HuAEC-urile primare și HuVEC-urile suspendate în mediu EGM-2 suplimentat cu VEGF (100 ng/ml; R&D Systems, Aimolivel, California, CA, SUA) au fost însămânțate în plăci cu 6 godeuri acoperite cu Matrigel ( BD Biosciences, Franklin, NJ, SUA) anterior la o densitate de 10.000 celule/cm2. După 24 de ore de incubație, celulele au fost fotografiate folosind microscopie confocală și software Volocity.
Analiza cantitativă în timp real a reacției în lanț a polimerazei (qRT-PCR)
ARN-ul total a fost extras din celule folosind RNeasy Micro Kit (QIAGEN, New York, NY, SUA) și transcris invers utilizând ReverTra Ace qPCR RT Master Mix (TOYOBO, Shanghai, China) conform specificațiilor producătorului. Produsele PCR au fost detectate folosind THUNDERBIRD SYBR qPCR Mix (TOYOBO, Shanghai, China). Exemplele de secvențe utilizate în testele qRT-PCR sunt prezentate în Tabelul 1.
Test de producție a oxidului de azot
Pe baza descrierii anterioare [24], HuAEC-urile primare și HuVEC-urile au fost însămânțate în plăci cu 24 de godeuri pre-acoperite cu vitronectină (100.000 celule/godeu). După 2 zile, mediile cultivate au fost schimbate în EGM-2 proaspăt conținând DAF-FM (1 μM; Life Technologies, Carlsbad, CA, SUA). Celulele au fost cultivate timp de 30 de minute la 37 ° C și apoi recoltate pentru analiză citometrică în flux.
Cocultura ex vivo
Eșantionul de CB umană a fost colectat de Spitalul de Reabilitare Integrativă Medicină Chineză și Vestică Yuhe din Beijing (ZXYEC-KT-2017-04-P01). După centrifugarea cu gradient de densitate și selecția imunomagnetică (Miltenyi Biotec, Westphalia, Gladbach, Germania), un total de 50.000 de celule CD34 + au fost cultivate în StemSpan (STEMCELL Technologies, Shanghai, China) conținând 50 ng/ml de rhSCF, rhTPO și rhFlt- 3 L (PeproTech, Rocky Hill, NJ, SUA), cu HuAECs-E4orf1-GFP și HuVECs-E4orf1-GFP sau fără celule alimentatoare (numai citokine). În plus, am efectuat și un experiment de blocare a semnalizării Notch în celule hCB coculturate cu HuAECs-E4orf1-GFP prin adăugarea Compusului E (200 nM; CpE; MERCK, Darmstadt, Germania), care este un inhibitor de semnal Notch. CpE a fost adăugat la fiecare două zile și s-a adăugat o doză echivalentă de DMSO ca martor. Pentru a investiga efectul DLL4 în sistemul de cultură, celulele CD34 + hCB au fost coculturate cu HuAECs-E4orf1-shDLL4 și grupul său de control (HuAECs-E4orf1 poartă secvență nerecunoscută și GFP). După 14 zile, celulele hCB expandate au fost recoltate pentru analiză.
Testul unității de formare a coloniei (CFU)
Pentru testele de formare a coloniilor, 250 de celule hCB amplificate au fost însămânțate în plăci cu 24 de godeuri care conțin MethoCult H4434 (STEMCELL Technologies, Shanghai, China). Fiecare grup a fost efectuat în trei exemplare. Coloniile incluzând CFU-eritrocit (CFU-E), unitate formatoare de explozie-eritroid (BFU-E), CFU-granulocit (CFU-G), CFU-granulocit, macrofag (CFU-GM) și CFU-megacariocit (CFU ) -M) au apărut din ziua 7 și au fost punctate în ziua 12.
Colorarea Giemsa
Celulele care formează colonii (CFC) au fost evaluate prin intermediul setului de colorare Giemsa (Baso, Zhuhai, China), în conformitate cu protocoalele producătorului. Celulele echivolumetrice au fost colectate și distribuite pe diapozitive. Apoi, s-a adăugat soluția A și s-a lăsat să acționeze 1 min la temperatura camerei. După aceea, soluția B a fost adăugată și incubată încă 10 min. Probele spălate și uscate la aer înainte de înregistrare.
Transplant in vivo
Toate experimentele la șoareci au fost aprobate de Comitetul instituțional de îngrijire și utilizare a animalelor (IACUC) de la Institutul de servicii de sănătate și medicină transfuzională (numărul de referință: IACUC din AMMS-13-2016-016). Pe scurt, șoarecii NSG în vârstă de 6 săptămâni au fost iradiați în corpul total subletal (2,5 Gy) și au injectat 1.000.000 de celule hCB expandate din fiecare grup prin vena cozii intravenos. La 16 săptămâni, s-au colectat celulele/femurele/tibiile/splina din sângele periferic (PB) și s-a evaluat procentul de celule CD45 + umane.
analize statistice
Rezultatele sunt exprimate ca medie ± deviație standard. P valoare mai mică de 0,05 (student cu două cozi t test) a fost considerat semnificativ statistic. „N” înseamnă replici biologice și toate acele repetări au fost independente.
Rezultate
Caracterizarea moleculară și funcțională a HuAEC
Înființarea și identificarea alimentatoarelor HuAECs-E4orf1-GFP
Cocultura HuAECs-E4orf1-GFP a îmbunătățit expansiunea ex vivo a CB HSPC în timp ce a sporit potențialul de diferențiere multiliniar al HSPC in vitro
Pentru a testa efectul HuAECs-E4orf1-GFP asupra expansiunii ex vivo a HSPC-urilor, celulele CD34 + hCB au fost extinse cumulativ cu HuAECs-E4orf1-GFP, HuVECs-E4orf1-GFP, sau fără alimentatoare în condiții de citokină fără ser și minim care a încorporat rhSCF, rhTPO și rhFlt3 ca factori de creștere. Celulele de alimentare utilizate pentru sistemul de cocultură erau toate în 6-10 pasaje. Ca rezultat, celulele CD34 + hCB coculturate cu HuAECs-E4orf1-GFP au dus la creșterea semnificativă a celulelor nucleate totale (TNC) și a celulelor CD34 + decât cultura citokinelor singură sau HuVECs-E4orf1-GFP (Fig. 3a - c). Mai mult, numărul de celule CD34 + CD38 și celule CD34 + CD38 + CD90 + mai primitive din celulele expandate coculturate cu HuAECs-E4orf1-GFP a crescut 527,2 ± 96,3 și 2603,4 ± 283,2 ori în decurs de 2 săptămâni, care a fost de 6,6 ± 2,5 și 3,3 ± 0,8 ori din grupul singur de citokine, 1,9 ± 0,5 și 1,8 ± 0,3 ori din grupul HuVECs-E4orf1-GFP (Fig. 3d, e). Pentru a evalua capacitatea in vitro a diferențierii multiliniare în celulele CD34 + hCB extinse, s-a efectuat testul CFU. Comparativ cu celelalte două grupuri, cocultura HuAECs-E4orf1-GFP a crescut semnificativ numărul de CFU, demonstrând că potențialul de formare a coloniilor HSPC a fost crescut in vitro în această stare (Fig. 3f, g).
Celulele extinse au menținut activitatea de repopulare la șoareci NSG in vivo
Rolul căii de semnalizare Notch în expansiunea HSPC
Discuţie
În ciuda zeci de ani de eforturi pentru a explora strategia de expansiune HSC ex vivo, definirea unui set de citokine care pot extinde HSC umane pe termen lung s-a dovedit a fi dificilă până acum [33]. Nucleul acestei probleme poate sta în neînțelegerea noastră finală cu privire la manipularea HSC-urilor de nișă in vivo. Aici am emis ipoteza că HuAEC-urile ar putea acționa ca nișă vasculară pentru a extinde ex vivo HSPC-urile prin furnizarea de semnale prohematopoietice. Pentru a testa această ipoteză, am stabilit alimentatoare endoteliale ale cordonului ombilical uman prin introducerea adenoviralei E4ORF1 și GFP genă folosind un vector retrovirus. Am preluat conducerea sugerând că HuAECs-E4orf1-GFP a oferit un mediu celular adecvat pentru extinderea eficientă a celulelor CD34 + hCB cu multipotență in vitro și capacitate de gravare in vivo.
În studiul de față, HuAEC izolate susținute în culturile noastre au prezentat un profil expresional de suprafață AEC. În ciuda rolului binecunoscut pentru E4ORF1 în susținerea supraviețuirii pe termen lung a celulelor endoteliale primare în absența serului și a factorilor angiogenici [34], acesta este primul raport care E4ORF1 este direct implicat în susținerea identității arteriale in vitro. Aceste studii reprezintă un caz pentru reținerea genelor arteriale și a semnalizării, implicând liganzi DLL4 [35], receptori NOTCH1/4 [36] și factori de transcripție (TF) HEY1/2 [25, 37] ca determinant major al identității AEC.
O cerință pentru rețele complexe de semnalizare în expansiunea HSC ex vivo a motivat dezvoltarea platformelor bazate pe celule. Conform cunoștințelor noastre actuale, celulele mezenchimale stromale (MSC) [38], osteoblastele [39] și alte celule stromale, inclusiv celulele sinusoidale și celulele endoteliale [40, 41], sunt responsabile pentru susținerea hematopoiezei și controlul numerelor HSC. În consecință, celulele progenitoare mezenchimale [42, 43] și celulele endoteliale [44, 45] au fost utilizate pe scară largă ca surogate pentru nișa mezenchimală și nișa endotelială pentru expansiunea HSPC-urilor. Anterior, am caracterizat în mod cuprinzător celulele endoteliale sinusoidale hepatice din ficatul fetal uman (hFLSEC) și am constatat că acestea permit expansiunea eficientă a celulelor CD34 + hCB cu capacitate multipotență in vitro și greutate la șoareci NSG [46]. După cum știm cu toții, ficatul fetal servește ca un loc predominant pentru extinderea HSC funcționale în timpul embriogenezei [47], ceea ce are mult mai mult sens despre rolul important al hFLSEC-urilor asupra expansiunii celulelor CD34 + hCB. În acest studiu, am comparat capacitatea hFLSECs și HuAECs pentru a facilita extinderea celulelor CD34 + hCB. Încurajator, HuAEC are avantajele față de hFLSEC în activitatea de promovare a creșterii și în capacitatea de formare a CFU (Fig. Suplimentar 2).
Cocultura HSC cu celule stromale și factori de creștere a fost utilizată într-o încercare de recapitulare ex vivo a interacțiunilor din microambientul hematopoietic pentru a extinde HSPC. De exemplu, expansiunea mediată de celule stromale mezenchimale (MSC) este una dintre abordările actuale ale manipulării ex vivo a celulelor stem CB în studiile clinice. Aici am dezvoltat o nouă platformă de expansiune CB umană, iar studiul nostru a confirmat în continuare rolul potențial al metodologiilor de expansiune HSPC bazate pe celule. În raportul nostru, HuAEC-urile primare și HuVEC-urile de la același donator au fost asociate pentru experimente independente, în timp ce probele de cordon ombilical utilizate pentru a izola PEC-urile provin de la mai mulți donatori. Diferitele surse conținute aici indică faptul că acest sistem de cocultură are o aplicabilitate universală. În viitor, infuzia de HPSC-uri extinse derivate din CB, extinse mediat de HuAEC, ar putea fi dezvoltată o strategie nouă pentru a face față scurtării HSPC-urilor. Pe de altă parte, această platformă ar putea permite, de asemenea, identificarea unor noi factori de creștere sau a unor molecule definite vizate, contribuind la definirea unui set de citokine pentru aplicare în expansiunea HSC.
Concluzie
Pe scurt, am identificat că HuAEC-urile au acționat ca o platformă celulară potențială pentru a sprijini în mod eficient extinderea CB HSC-urilor umane. În ciuda rolului binecunoscut al endoteliului în generația inițială de HSC [55], HSC augment [56] și diferențierea specifică descendenței hematopoietice [52], aceasta este prima dată când celulele endoteliale arteriale sunt direct implicate în ex vivo extinderea HSC umane. În cele din urmă, o mai bună înțelegere a componentelor celulare și de semnalizare din această regiune va avansa extinderea HSC în scopuri terapeutice.
- Tratament de curățare a sângelui care extrage boala din corp folosind magneți pregătiți pentru încercări umane
- Sânge; curatenie; tratament care scoate boala din corp folosind magneți pregătiți pentru încercări umane
- Manșetele tensiunii arteriale față de liniile arteriale pentru pacienții hipotensivi - PulmCCM
- Sucul de rodie bogat în antioxidanți poate ajuta la gestionarea glicemiei pentru diabetici Date umane
- Fapte despre meningere cerebrale, sânge; Apa nervoasă, hemoragii