Lindsey G. Albenberg
Divizia de Gastroenterologie, Hepatologie și Nutriție, Spitalul de Copii din Philadelphia, Philadelphia, PA
James D. Lewis
Divizia de Gastroenterologie, Școala de Medicină Perelman, Universitatea din Pennsylvania, Philadelphia, PA
Gary D. Wu
Divizia de Gastroenterologie, Școala de Medicină Perelman, Universitatea din Pennsylvania
Abstract
Scopul revizuirii
Bolile inflamatorii intestinale (IBD) sunt boli inflamatorii cronice ale tractului gastro-intestinal aparent datorate unui răspuns imun anormal la factorii de mediu la gazdele susceptibile genetic. Compoziția microbiomului intestinal este considerată a fi un factor critic de mediu în IBD, iar dovezile recente sugerează o legătură între dieta și bacteriile intestinale. În această revizuire, descriem dovezile actuale privind impactul dietei asupra microbiomului intestinal și modul în care acest lucru poate fi relevant pentru patogeneza IBD.
Descoperiri recente
Tehnologia nouă de secvențiere a ADN-ului independentă de cultură a revoluționat abordarea caracterizării comunităților bacteriene intestinale. Studii recente au demonstrat o asociere între dieta și compoziția microbiomului uman. Deoarece dezvoltarea unui microbiom „disbiotic” este considerată a fi implicată în patogeneza IBD, dieta este investigată ca un factor etiologic important.
rezumat
Studiile recente care subliniază impactul dietei asupra microbiomului intestinal oferă o justificare puternică pentru o investigație ulterioară a legăturii dintre dietă, microbiomul intestinal și dezvoltarea IBD. Astfel de studii pot furniza informații noi despre patogeneza bolii, precum și pot identifica noi alternative terapeutice pentru pacienții care suferă de IBD.
Introducere
Intestinul uman conține un număr mare de microorganisme, caracterizat în mod colectiv ca „microbiomul intestinal”. Toate cele trei regate ale vieții, Archaea, Bacteria și Eukarya, sunt reprezentate în comunitatea microbiană intestinală. Se estimează că 10 14 bacterii individuale aparținând peste 1000 de specii locuiesc în intestinul mamiferelor, făcându-l cea mai dens populată comunitate microbiană de pe Pământ 1. Se preconizează că genomul colectiv al microbiomului intestinal uman este de 100 de ori mai mare decât cel al gazdei sale umane 2 .
Numeroși factori, precum genetica gazdei, utilizarea antibioticelor, filogenia gazdei, inflamația intestinală și dieta, influențează compoziția microbiotei intestinale. În această revizuire, descriem dovezile actuale privind impactul dietei asupra microbiomului intestinal și modul în care acest lucru poate fi relevant pentru patogeneza IBD.
Utilizarea tehnologiei de secvențiere a ADN-ului pentru a caracteriza microbiomul intestinal
Dieta ca determinant al compoziției microbiotei intestinale
Colonizarea intestinului începe la naștere și este foarte dependentă de modul de livrare 4. După inocularea primară, sugarii au expuneri multiple la microbi umani și există o creștere rapidă a diversității 10. O examinare recentă a compoziției microbiomului intestinal al unui sugar urmată peste 2,5 ani a demonstrat o schimbare considerabilă a taxonilor bacterieni prezenți cu introducerea alimentelor solide și o trecere către o microbiotă mai stabilă, de tip adult, cu înțărcare 10. Odată stabilită, compoziția microbiomului uman adult pare a fi relativ constantă la indivizi, cel puțin pe termen scurt 5. În schimb, există niveluri ridicate de variabilitate între indivizi 5. Forța motrice din spatele acestor diferențe interindividuale nu a fost elucidată; cu toate acestea, este probabil implicată expunerea timpurie la mediu. Palmer și colegii săi au examinat microbiomul intestinal al 14 sugari sănătoși pe termen lung și au găsit o variabilitate semnificativă între sugari în concordanță cu studiile anterioare 11. Excepția de la aceasta a fost remarcabila similitudine a microbiotei intestinale găsite într-o pereche de gemeni dizigotici care a evidențiat importanța potențială a mediului 11 .
Există un număr tot mai mare de dovezi care demonstrează o asociere între dietă și microbiomul intestinal. O analiză recentă a secvențelor de ARNr 16S fecale de la 60 de specii de mamifere a indicat gruparea în funcție de dietă (erbivor, carnivor și omnivor), în plus față de gruparea în funcție de filogenia gazdei 12. Secvențierea metagenomică a puștii a stabilit, de asemenea, că a existat o evoluție funcțională a microbiomului intestinal în raport cu dieta 13. De exemplu, genele microbiene care codifică enzimele implicate în metabolismul carbohidraților și aminoacizilor sunt diferite între erbivore și carnivore 13. La om, se pare că a existat, de asemenea, o evoluție pe termen lung a simbiozei microbiotei intestinului gazdă 14. Dezvoltarea agriculturii și domesticirea animalelor au condus la o lărgire a dietei umane care, probabil, a modificat compoziția microbiomului intestinal uman 14. .
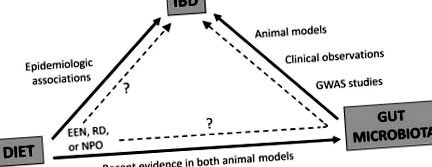
Noțiunea că dieta poate influența microbiota a fost consolidată printr-o examinare a microbiotei fecale a copiilor europeni, comparativ cu cea a copiilor din Africa rurală 15. Au existat similitudini în genurile de bacterii prezente în intestin la copiii mai mici din ambele grupuri, ceea ce poate fi explicat prin alăptare. Cu toate acestea, în afara acestei grupe de vârstă, au existat diferențe considerabile în microbiota intestinală între copiii africani, hrăniți cu o dietă tradițională bogată în fibre, iar copiii europeni, hrăniți cu o dietă modernă occidentală. Un studiu recent asupra impactului dietei asupra microbiomului la subiecți umani sănătoși a demonstrat că tiparele dietetice agrare pe termen lung sunt asociate cu un enterotip dominat de Prevotella 16, un gen observat frecvent și la persoanele din Africa rurală 15. O dietă pe termen lung, bogată în proteine și grăsimi animale și săracă în carbohidrați, similară cu o dietă „occidentalizată”, este asociată cu cantități mari de bacteroizi și cantități mici de Prevotella 16. Influența dietei asupra microbiomului se află într-un stadiu incipient de caracterizare și studii suplimentare sunt esențiale pentru a ne îmbunătăți înțelegerea acestei relații (Figura 1).
Relația dintre dietă, microbiota intestinală și IBD. Dovezile pentru aceste relații sunt prezentate alături de săgețile solide. Intervențiile dietetice pentru tratamentul bolii Crohn sunt afișate alături de săgețile punctate - Nutriție enterală exclusivă (EEN), Dieta de restricție (RD), Restul intestinului (NPO) - Este necesară o investigație suplimentară pentru a determina dacă există sau nu o eficacitate observată din aceste intervenții implică modificări induse de dietă în microbiota intestinală. GWAS, studii de asociere la nivel de genom.
Impactul geneticii este mai puțin bine caracterizat. Investigațiile privind ereditatea microbiotei constau în principal din studii efectuate pe modele animale, iar aceste studii au fost revizuite recent 17. Un număr limitat de studii la om, în special studii gemene, au dat rezultate inconsistente 18, 19. Este logic să credem că genetica și mediul înconjurător interacționează pentru a modela microbiomul intestinal uman. Cu toate acestea, dovezile actuale cu privire la rolul geneticii sunt relativ modeste.
Genetica gazdă și microbiota intestinală în patogeneza IBD
Dieta și microbiomul intestinal în IBD
Indiferent de mecanism, există date rezonabile care să susțină un rol pentru dieta în patogeneza IBD (Figura 1). Mai mulți anchetatori au examinat asocierea tiparelor dietetice și incidența IBD 29, 30. De exemplu, autorii unei analize sistematice au concluzionat că aportul alimentar ridicat de grăsimi totale, acizi grași polinesaturați (PUFA), acizi grași omega-6 și carne au fost asociați cu un risc crescut de CD și UC; aportul ridicat de fibre și fructe a fost asociat cu un risc redus de CD; iar aportul mare de legume a fost asociat cu un risc redus de UC 30. Aceste studii susțin un rol potențial pentru modelele dietetice în patogeneza IBD. Împreună cu datele recente care caracterizează impactul dietei asupra microbiomului intestinal și asocierea acestuia cu enterotipurile 16, este tentant să speculăm că modificarea structurii comunității microbiotei intestinale prin consumul de produse agricole vs. o dietă „occidentalizată” poate juca un rol fie în reducerea, fie în creșterea, respectiv a riscului pentru dezvoltarea IBD.
Poate că cele mai puternice dovezi ale rolului conținutului intestinal în cursul IBD provin din două studii efectuate pe pacienți care au suferit rezecție ileocolonică pentru CD. Aceste studii au demonstrat că reapariția inflamației după rezecția ileală depinde de expunerea ileonului neoterminal la conținutul fecal și apare în decurs de 8 zile de la expunerea 31, 32. Cu toate acestea, nu se știe ce componentă a fluxului fecal contribuie la inflamație. Au fost sugerate bacterii, alte microorganisme, particulele alimentare digerate și o combinație de factori.
Deoarece antigenii dietetici pot acționa ca stimuli importanți ai sistemului imunitar al mucoasei, repausul intestinal cu nutriție parenterală totală (TPN) a fost utilizat ca terapie la anumiți pacienți cu IBD 33. În anii 1980, TPN a apărut ca o modalitate importantă pentru tratamentul CD moderat până la sever. Într-un studiu prospectiv pe 30 de pacienți cu CD tratați cu repaus intestinal și TPN, 25 (83%) au obținut remisiunea inițială, dar recidiva a fost frecventă 34. Un studiu controlat randomizat ulterior care a evaluat diferite intervenții nutriționale în CD a arătat că repausul intestinal nu a fost un factor major în realizarea remisiunii 35. În ciuda dovezilor contradictorii, repausul intestinal cu TPN poate ameliora simptomele, cel puțin pe termen scurt, la pacienții care prezintă o exacerbare severă. Este posibil ca repausul intestinal să modifice microbiomul intestinal într-un mod terapeutic în IBD, deoarece postul s-a dovedit a avea un efect asupra microbiomului intestinal, cel puțin la șoareci 36 .
În CD, nutriția enterală exclusivă (EEN) cu diete formale elementare, semi-elementare și definite au fost studiate pe scară largă pentru inducerea remisiunii și sunt considerate terapie de primă linie în anumite părți ale lumii 37, 38. Aceste diete sunt, de asemenea, eficiente în menținerea remisiunii 39. Cel mai frecvent protocol implică administrarea unei formule definite la 100% din necesarul caloric timp de 4-12 săptămâni pentru a induce remisiunea 40. Formulele pot fi consumate oral sau pot fi administrate printr-un tub nazogastric (NG) sau gastrostomie. Un procent mai mic de calorii, furnizat de formula definită, poate fi necesar pentru a menține remisiunea, permițând o flexibilitate suplimentară în dietă 39. EEN este o alternativă la agenții farmacologici puternici și nu există efecte secundare grave asociate. Într-un studiu recent, prospectiv, deschis, copiii cu CD au fost randomizați pentru a primi corticosteroizi orali sau EEN cu o formulă polimerică timp de 10 săptămâni 41. Pe termen scurt, EEN a fost la fel de eficient ca corticosteroizii în realizarea remisiunii clinice 41. Interesant este faptul că terapia nutrițională a fost semnificativ mai eficientă decât corticosteroizii în vindecarea mucoasei, determinată atât de criteriile endoscopice, cât și de cele histologice 41 .
Spre deosebire de CD, există date extrem de limitate despre eficacitatea terapiei enterale în UC. Un mic studiu randomizat al pacienților cu UC severă a comparat corticosteroizii plus repausul intestinal cu TPN versus corticosteroizi plus dieta obișnuită și nu a demonstrat superioritatea repausului intestinului pentru alte rezultate decât volumul scaun 42. Un mic studiu randomizat al pacienților spitalizați cu UC severă nu a observat diferențe în ratele de răspuns la terapia cu corticosteroizi cu o dietă polimerică față de TPN. Cu toate acestea, pacienții hrăniți enteral au avut mai puține efecte adverse legate de nutriție și mai puține infecții postoperatorii 43. Pe baza acestor date limitate, este dificil să se facă concluzii ferme cu privire la rolul dietei ca terapie pentru UC activă.
Concluzie
În prezent, se crede că IBD este rezultatul unui defect al protecției imune înnăscute împotriva microbiotei intestinale combinat cu un răspuns imun adaptiv reglementat în mod necorespunzător. Progresele tehnologice care permit acum o caracterizare mai cuprinzătoare a comunităților microbiene complexe, împreună cu studii recente care arată impactul dietei asupra microbiomului intestinal, oferă o justificare puternică pentru o investigație ulterioară a legăturii dintre dietă, microbiomul intestinal și dezvoltarea IBD . Rezultatele acestor studii pot oferi nu numai informații importante despre incidența crescândă a IBD, gruparea geografică în țările industrializate și asocierea cu o dietă „occidentalizată”, ci pot oferi, de asemenea, informații mecaniciste asupra intervențiilor dietetice utilizate în prezent, aparent eficiente în gestionarea IBD.
Puncte cheie
Factorii de mediu, inclusiv dieta, pot fi implicați în patogeneza bolii inflamatorii intestinale din cauza efectelor asupra microbiomului intestinal.
Studii recente au identificat o posibilă legătură între doi factori de risc de mediu implicați în mod obișnuit pentru boala inflamatorie a intestinului - modelul alimentar și microbiomul intestinal.
Repausul intestinal și nutriția enterală exclusivă cu formule definite sunt terapii utilizate în mod obișnuit pentru gestionarea bolii inflamatorii intestinale și mecanismul de acțiune poate implica modificări ale compoziției bacteriene intestinale.
Sunt necesare studii suplimentare pentru a caracteriza mai bine relația dintre dietă, microbiomul intestinal și boala inflamatorie a intestinului și pot furniza informații noi despre patogeneza bolii.
Mulțumiri
Note de subsol
Autorii nu au conflicte de interese de declarat.
Declinarea responsabilității editorului: Acesta este un fișier PDF al unui manuscris neditat care a fost acceptat spre publicare. Ca serviciu pentru clienții noștri, oferim această versiune timpurie a manuscrisului. Manuscrisul va fi supus copierii, compunerii și revizuirii dovezilor rezultate înainte de a fi publicat în forma sa finală citabilă. Vă rugăm să rețineți că, în timpul procesului de producție, pot fi descoperite erori care ar putea afecta conținutul și că toate responsabilitățile legale care se aplică jurnalului se referă.
Informații despre colaboratori
Lindsey G. Albenberg, Divizia de Gastroenterologie, Hepatologie și Nutriție, Spitalul de Copii din Philadelphia, Philadelphia, PA.
James D. Lewis, Divizia de Gastroenterologie, Școala de Medicină Perelman, Universitatea din Pennsylvania, Philadelphia, PA.
Gary D. Wu, Divizia de Gastroenterologie, Școala de Medicină Perelman, Universitatea din Pennsylvania.
- Orezul brun germinat și rolul său în sănătatea umană Recenzii critice în știința alimentară și nutriție
- Alergiile alimentare și creșterea în greutate există o legătură
- Alimentația emoțională și dependența de alimente Ce; s Conexiunea
- Microbiota intestinală și dieta o introducere Food and Mood Center
- Conducerea G20 critică pentru asigurarea alimentelor sănătoase pentru umanitate - EAT