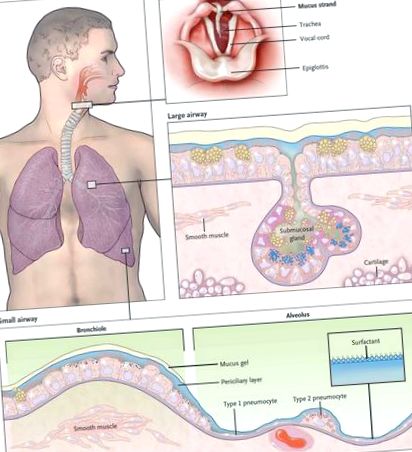
Plămânii sunt remarcabil de rezistenți la rănirea mediului, în ciuda expunerii continue la agenți patogeni, particule și substanțe chimice toxice în aerul inhalat. Rezistența lor depinde de o apărare extrem de eficientă oferită de mucusul căilor respiratorii, 1-7 un gel extracelular în care apa și mucinele (proteine puternic glicozilate) sunt cele mai importante componente. Mucusul căilor respiratorii captează toxinele inhalate și le transportă din plămâni prin bătăi ciliare și tuse (Fig. 1). Paradoxal, deși o barieră mucoasă deficitară lasă plămânii vulnerabili la leziuni, mucusul excesiv sau clearance-ul afectat contribuie la patogeneza tuturor bolilor comune ale căilor respiratorii. 1-4 Această revizuire examinează formarea și eliminarea normală a mucusului căilor respiratorii, formarea mucusului patologic, eșecul eliminării mucusului care duce la simptome și funcții pulmonare anormale și terapia disfuncției mucusului.
Mucusul este măturat continuu de la căile respiratorii distale la cele proximale. În cele mai distale bronșiole, celulele epiteliale sunt cuboidale și nu produc mucină (cutia de jos), iar permeabilitatea bronhiolară este stabilizată de surfactant din alveolele adiacente. 8 În căile respiratorii mici adiacente, un strat subțire de gel de mucus este produs de celule secretoare columnare (Clara) care nu se colorează pentru mucinele intracelulare, deoarece sunt produse în cantități mici și secretate constant. În căile respiratorii mari căptușite de un epiteliu pseudostratificat, un strat gros de gel de mucus (până la 50 µm) se acumulează din mucusul transportat de pe căile respiratorii distale, iar mucinele suplimentare sunt produse de celulele secretoare de suprafață și glandele. După ce mucusul urcă în trahee, este propulsat prin corzile vocale de epiteliul ciliar în comisura posterioară a laringelui. Apoi intră în faringe și este înghițit, cu aproximativ 30 ml de mucus al căilor respiratorii eliminat zilnic de tractul gastro-intestinal. Corzile vocale sunt acoperite de epiteliu scuamos, deci nu participă la clearance-ul ciliar, deși promovează clearance-ul tusei închizându-se în timp ce presiunea expiratorie crește și apoi se deschide brusc, astfel încât fluxul de aer este puternic.
STRUCTURA ȘI FUNCȚIA AEROVEI NORMALE
Suprafețele epiteliale în contact cu mediul exterior sunt protejate de bariere mecanice (de exemplu, pielea keratinizată) și bariere chimice (de exemplu, acid gastric). Suprafețele mucoasei sunt epitelii umede care au o barieră mucoasă ca parte a mecanismului lor de protecție. 1-7 Straturile de mucus variază foarte mult în compoziție și structură; de exemplu, acestea sunt groase și aderente la epiteliul din intestin, dar subțiri și mobile în căile respiratorii.
CELULE EPITELIALE DE SUPRAFATA
Suprafața epiteliului căilor respiratorii intrapulmonare este compusă din două tipuri de celule principale - ciliate și secretoare (Fig. 2). Aceste celule sunt prezente în număr similar și formează un mozaic. Celulele secretoare au fost împărțite în continuare în subtipuri pe baza aspectului lor microscopic (de exemplu, Clara, calicele și celulele seroase). Cu toate acestea, studiile indică o mare plasticitate structurală, moleculară și funcțională în celulele secretoare. 10-14 Prin urmare, este cel mai simplu să le numim generic „celule secretoare”. Pe lângă mucine, celulele secretoare eliberează o varietate de molecule antimicrobiene (de exemplu, defensine, lizozimă și IgA), molecule imunomodulatoare (de exemplu, secretoglobine și citokine) și molecule de protecție (de exemplu, proteine trefoil și heregulină) în mod constitutiv și inductibil; acestea pot deveni încorporate în mucus. 15.16
GLANDE SUBMUCOSALE
În căile respiratorii mari (diametrul luminal,> 2 mm), glandele submucoase contribuie la secreția mucinelor și a lichidului (Fig. 1). Fiecare glandă este conectată la lumenul căilor respiratorii printr-un canal superficial ciliat care propulsează secrețiile către exterior și un canal colector nonciliat mai profund. 17,18 Corpul glandei este situat între benzile spirale ale mușchiului neted și plăcile cartilajului. Celulele mucoase constituie aproximativ 60% din volumul glandelor și, pe baza studiilor efectuate pe primate, s-a estimat că jumătate din cantitatea de mucină intracelulară este stocată în glandele submucoase cât este stocată în celulele epiteliale de suprafață. 19 celule seroase, situate distal, alcătuiesc restul de aproximativ 40% din glandă și secretă proteoglicani și numeroase proteine antimicrobiene. În stările patologice, volumul glandelor submucoase poate crește de câteva ori volumul normal. 20.21
MUCUS GEL LAYER
Un gel este o rețea diluată care își păstrează forma; astfel, deși este compus în mare parte din lichid, are multe caracteristici fizice ale unui solid. Mucus este un gel cu proprietăți atât ale unui solid moale (deformabil), elastic, cât și al unui fluid vâscos. 1,4,5,22,23 Mucusul normal este 97% apă și 3% solide (mucine, proteine non-mucinice, săruri, lipide și resturi celulare). Mucinele, glicoproteine extrem de mari (până la 3 × 106 D per monomer) cu regiuni bogate în reziduuri de serină și treonină legate de grupările lor laterale hidroxil de lanțurile de zahăr (O-glicozilare), reprezintă mai puțin de 30% din solide. 3,4,6,15,24 Mucinele sunt 50 până la 90% carbohidrați și sunt foarte anionice, deoarece majoritatea zaharurilor lor terminale conțin grupe carboxil sau sulfat. Există 17 gene care codifică mucinele în genomul uman, dintre care produsele genice din șapte sunt secretate, iar restul este legat de membrană. 3,4,6 Cinci dintre mucinele secretate au domenii terminale cysteinerich care pot forma legături disulfidice rezultând polimeri care conferă proprietățile unui gel (Fig. 2). Doi dintre acești polimeri, MUC5AC și MUC5B, sunt puternic exprimați în căile respiratorii și sunt detectați în cantități similare în mucusul uman. 3.4
MUC5AC și MUC5B formează polimeri homotipici (adică monomerii MUC5AC se leagă numai cu MUC5AC și monomerii MUC5B se leagă numai cu MUC5B), structurați ca lanțuri lungi, mai degrabă decât ramuri (Fig. 2). Ele formează gelul de mucus atât prin încurcarea într-o plasă, cât și prin reticulare noncovalentă dependentă de calciu a polimerilor adiacenți. 1,3 Lanțurile laterale de glican leagă cantități mari de lichid (de sute de ori greutatea lor), ceea ce permite mucusului să acționeze ca un lubrifiant și stratul de gel să servească drept rezervor de lichid pentru stratul periciliar. 2 Hidratarea mucusului afectează dramatic proprietățile sale vâscoase și elastice, care la rândul lor determină cât de eficient este eliminat prin acțiune ciliară și tuse. 1–5.22 Mucusul sănătos conține 3% solide, cu consistența albusului de ou. Cu toate acestea, hipersecreția de mucină sau dereglarea volumului lichidului de suprafață poate crește concentrația de solide cu până la 15%, rezultând mucus vâscos și elastic care nu este ușor de eliminat. 1,5,22 În plus, mucusul deshidratat aderă mai ușor la peretele căilor respiratorii. 23.25
Deoarece infecția este adesea inițiată prin recunoașterea suprafețelor epiteliale ale gazdei de către proteinele microbiene care leagă zahărul, glicinele mucinice ajută la sechestrarea agenților patogeni, oferind un „peisaj glicoproteic” divers pentru interacțiunea cu aceste proteine microbiene, iar modelele de glicozilare se pot modifica în timpul inflamației. 3,5,26 În plus, stratul de gel de mucus acționează ca o barieră fizică solidă pentru majoritatea agenților patogeni. 1,3,5,7 Cu toate acestea, dimensiunea porilor rețelei de gel este suficient de mare (aproximativ 500 nm) încât să fie ușor pătrunsă de viruși mici cu capside hidrofile; acest lucru are implicații pentru infecția microbiană și terapia genică. 5
PRODUCȚIA MUCIN
La indivizii sănătoși, MUC5AC este produs predominant în căile respiratorii proximale de către celulele calice de suprafață, în timp ce MUC5B este produs în celulele secretoare de suprafață de-a lungul căilor respiratorii și de către glandele submucoase. 3,4,14,27-29 În căile respiratorii ale șoarecilor normali, care seamănă cu căile respiratorii distale umane, aproape nu se produce Muc5ac, 10-12,30-32 și șoarecii cu deleție Muc5ac sunt sănătoși, în timp ce Muc5b este produs constitutiv în căile respiratorii celulele secretoare de suprafață, 11-13,29 și șoarecii cu deleție Muc5b mor din cauza inflamației pulmonare (Evans CM: comunicare personală). Această constatare sugerează că Muc5b mediază bariera de bază și funcțiile de clearance la șoareci, iar MUC5B face probabil același lucru în căile respiratorii distale umane. 28.33 Deoarece MUC5AC este produs în mod constitutiv în căile respiratorii proximale umane, acesta poate mări funcțiile de barieră și de distanță proximală.
Deoarece producția de MUC5AC și Muc5ac este foarte reglementată la nivel transcripțional, controlul său este de mare interes clinic. Semnalizarea receptorilor ErbB pare să joace un rol omniprezent, deoarece inhibitorii blochează reglarea în sus a MUC5AC și Muc5ac prin stimuli diferiți. 10,36,40-42 Interleukina-13 crește foarte mult expresia MUC5AC și Muc5ac, 34,36,43,44 și au fost identificați factori cheie de transcripție în aval, 30,39,44,45, deși căile care le conectează nu sunt încă pe deplin stabilit (Fig. 3). Mulți alți stimuli care cresc expresia MUC5AC și Muc5ac, cum ar fi virușii, 31 componenta fumului acroleină, 40 și citokinele interleukina-4, 9, 17, 23 și 25, 52-54 o fac, cel puțin parțial, prin interleukină -13. Expresia excesivă a citokinei proinflamatorii interleukin-1β sau interleukin-17 crește expresia Muc5ac, 32,54 în timp ce interleukina-6 și factorul de necroză tumorală α nu cresc ele însele expresia Muc5ac, ci o fac indirect creșterea intensității inflamației alergice. 55.56 Controlul expresiei MUC5B și Muc5b este mai puțin bine înțeles. 57
SECRETIA MUCIN
STRAT PERICILIAR
Mucinele legate de membrană contribuie la proprietățile fizice ale lichidului în apropierea suprafeței celulare, conferind caracteristicile unui „gel altoit”, mai degrabă decât un fluid pe stratul periciliar (Boucher RC, Universitatea din Carolina de Nord: comunicare personală). MUC4 este dens exprimat pe cili, configurat ca niște perii de sticle paralele, unde previne pătrunderea prin stratul de gel de mucus și asigură lubrifiere prin apă legată. 4.6 MUC1 este mult mai mic decât MUC4 și este prezent pe suprafața celulară și pe microviliții celulelor ciliate și secretoare. Are o coadă citoplasmatică capabilă de semnalizare intracelulară și modulează apărarea și inflamația agentului patogen. 6,71 MUC16, cea mai mare mucină, este exprimată atât de celulele ciliate, cât și de celulele secretoare și poate fi clivată și încorporată în stratul mobil de gel. 6,72
MECANISME DE ELIBERARE
Gelul de mucus este propulsat într-o direcție proximală prin bătăi ciliare, eliminând particulele inhalate, agenții patogeni și substanțele chimice dizolvate care ar putea deteriora plămânii. 2 Mucinele polimerice sunt sintetizate și secretate continuu pentru a umple stratul de gel. Cilia normală bate de 12 până la 15 ori pe secundă, rezultând o viteză a stratului de gel de aproximativ 1 mm pe minut. 73 Rata clearance-ului mucociliar crește odată cu o hidratare mai mare, 2,73, iar rata bătăilor ciliare poate fi crescută de agoniștii purinergici, adrenergici, colinergici și adenozinici, 60,73, precum și de substanțele chimice iritante. 74
Un al doilea mecanism pentru expulzarea mucusului din căile respiratorii este eliminarea tusei. Acest lucru poate ajuta la explicarea de ce bolile pulmonare cauzate de afectarea funcției ciliare sunt mai puțin severe decât cele cauzate de deshidratare, ceea ce împiedică ambele mecanisme de eliminare. 2 Deși tusea contribuie în mod benefic la eliminarea mucusului în afecțiunile cu producție excesivă sau afectarea funcției ciliare, aceasta poate fi, de asemenea, un simptom deranjant. 75,76
DISFUNCȚIA MUCUSULUI ÎN BOLI
Clearance-ul eficient al mucusului este esențial pentru sănătatea pulmonară, iar boala căilor respiratorii este o consecință consecventă a clearance-ului slab. Mucusul sănătos este un gel cu vâscozitate și elasticitate reduse, care este ușor transportat prin acțiunea ciliară, în timp ce mucusul patologic are vâscozitate și elasticitate mai mare și este mai puțin ușor de curățat. 5.38 Conversia de la mucus sănătos la mucus patologic are loc prin multiple mecanisme care îi modifică hidratarea și constituenții biochimici; acestea includ secreția anormală de sare și apă, producția crescută de mucine, infiltrarea mucusului cu celule inflamatorii și permeabilitatea bronhovasculară crescută (Fig. 4). Acumularea de mucus rezultă dintr-o combinație de supraproducție și scăderea clearance-ului, iar acumularea persistentă poate duce la infecții și inflamații, oferind un mediu pentru creșterea microbiană.
FIBROZĂ CHISTICĂ
ASTM
Mucusul căilor respiratorii în astmul sever are o calitate cauciucată care contribuie la eliminarea clearance-ului și la formarea dopului. Analiza biochimică a acestor dopuri arată concentrații ridicate de mucine și proteine plasmatice, 84,88, iar analiza biofizică arată densitate mare de încurcătură și modul elastic. 89 Un alt rol patologic important al proteinelor plasmatice în formarea acestor dopuri de mucus extrem de elastice este protejarea mucinelor de digestia proteazei. 89 Deoarece activitatea elastazei neutrofile este crescută în căile respiratorii ale pacienților cu astm în faza de recuperare a exacerbărilor aproape fatale, poate ajuta la digerarea dopurilor de mucus la acești pacienți. 90 Un istoric de simptome persistente legate de spută este asociat cu fenotipuri de boală mai severe în astmul cronic, 91 și hipersecreția de mucus este deosebit de problematică în aspergiloza bronhopulmonară alergică. 85
BOALA PULMONARĂ OBSTRUCTIVĂ CRONICĂ
Obstrucția mucusului căilor respiratorii mici este caracteristică BPOC, chiar și la pacienții care nu expectorează spută sau care au un fenotip emfizematos. 92,93 În schimb, pacienții cu BPOC care au expectorație abundentă pot avea o obstrucție redusă a fluxului de aer, probabil pentru că mucusul provine din căile respiratorii mari și provoacă ocluzie minimă. În ciuda acestei slabe corelații cu producția de spută, obstrucția fluxului de aer se corelează cu modificările exprimării genei mucinei, 38 crește numărul și dimensiunea celulelor calicice, 38 ocluzia căilor respiratorii mici cu mucus, 88 și extinderea glandelor submucoase. 21.92 Disfuncția mucusului indusă de fumul de țigară este complexă și incomplet înțeleasă, dar implică efecte adverse asupra structurii și funcției cililor, activarea 94-96 a receptorilor ErbB, 41 funcția scăzută a CFTR, 97 și efectele proinflamatorii care cresc producția de mucină în timp ce scad hidratarea și clearance-ul mucusului. Fumul de țigară conține mai multe toxine, inclusiv particule, substanțe chimice oxidative și compuși organici, printre care acroleina este importantă, deoarece induce puternic producția de mucină. 40
Creșterea producției de mucină și scăderea lichidului luminal în BPOC au consecințe dăunătoare pentru sănătatea căilor respiratorii, așa cum se întâmplă în astm și fibroză chistică, inclusiv staza mucusului și infecția căilor respiratorii. Haemophilus influenzae, P. aeruginosa, Streptococcus pneumoniae și Moraxella catarrhalis sunt detectate în spută la 25 până la 50% dintre adulții cu BPOC. Rata infecției crește odată cu creșterea severității bolii, iar achiziționarea de noi tulpini bacteriene este asociată cu exacerbări ale BPOC. 98 Pe baza studiilor efectuate pe un model de șoarece în care lizatul H. influenzae a provocat inflamație și fibroză a căilor respiratorii, dar nu metaplazie mucoasă, 56 se poate specula că, în BPOC, o reducere a clearance-ului mucusului legată de fumul de țigară duce la infecția căilor respiratorii care, la rândul său, duce la inflamație și fibroză.
ALTE BOLI AEROASE ASOCIATE CU DISFUNCȚIA MUCUSULUI
Disfuncția mucusului apare practic în toate bolile inflamatorii ale căilor respiratorii. Infecții virale și bacteriene acute și boli cronice, cum ar fi diskinezie ciliară primară, bronșiectazie fibroză non-chistică (care este adesea cauzată de infecție atipică cu micobacterii), panbronchiolită și stări de imunodeficiență (de exemplu, hipogamaglobulinemie, infecție cu virusul imunodeficienței umane, transplant de organe și hematologic afecțiuni maligne) toate au o componentă a disfuncției mucusului. În plus, mucusul reținut este o problemă la pacienții intubați și la cei la care mecanica pulmonară este perturbată ca urmare a paraliziei, imobilizării sau intervenției chirurgicale; atelectazia și pneumonia sunt complicații frecvente la astfel de pacienți. S-a raportat că markerii genomici din regiunea cromozomială 11p15.5 (care cuprinde MUC5AC și MUC5B) sunt asociați cu severitatea astmului, 99 și panbronchiolita, 100, deși mecanismele care duc la susceptibilitatea bolii nu au fost încă definite.
TRATAMENT
Dezvoltarea tratamentelor concepute rațional pentru mucusul patologic a fost împiedicată de lipsa de înțelegere a mecanismelor disfuncției mucusului. Medicamentele fără prescripție medicală pentru disfuncția mucusului căilor respiratorii, inclusiv guaifenesina, nu au fost riguros evaluate în studiile clinice și nu sunt recomandate în ghidurile de tratament pentru fibroza chistică, astm sau BPOC. 65,85,93,101–103 Agenți suplimentari multipli cu mecanisme incerte sunt folosiți la nivel mondial fără dovezi clare ale unui beneficiu. 104.105 Astmul, BPOC și fibroza chistică au diferențe importante în mucusul patologic, iar tratamentul cu mucus trebuie adaptat în consecință. Terapiile actuale în această măsură, dar pot fi facilitate de terapii care sunt în curs de dezvoltare. Terapiile pot fi împărțite în cele care scad producția de mucină, cele care scad secreția de mucină, cele care promovează eliminarea mucusului și cele care tratează infecția căilor respiratorii (Tabelul 1).
tabelul 1
Tratamentul hipersecreției mucoasei.
Înțelegerile recente privind formarea mucusului patologic în boală au condus la introducerea unor terapii adaptate, cum ar fi hidratarea prin soluții saline hipertonice aerosolizate sau reducerea vâscozității și elasticității mucusului prin dornaza alfa aerosolizată. Tratamentul țintit al mucusului căilor respiratorii patologice nu numai că îmbunătățește simptomele tusei și dispneei, ci și reduce frecvența exacerbărilor legate de boală și încetinește progresia bolii. Elucidarea modului în care este controlată producția de mucină este încă necesară, deoarece acest lucru ar putea permite dezvoltarea unor terapii suplimentare pentru a preveni supraproducția.
Mulțumiri
Dr. Dickey raportează că primește taxe de consultanță de la BioMarcks Pharmaceuticals; Dr. Fahy, care face parte dintr-un comitet consultativ științific pentru citokinetică și primește taxe de consultanță de la Five Prime Therapeutics, Amira, Oxagen, Gilead, GlaxoSmithKline și Amgen, acordă sprijin Universității din California, San Francisco, de la Genentech, Boehringer Ingelheim și Aerovance, și taxe de călătorie de la GlaxoSmithKline, Merck, Amira și Amgen. Dr. Rapoartele Fahy sunt numite într-o cerere de brevet provizorie depusă pentru o semnătură genetică pentru celulele T helper tip 2 - astm ridicat (cu Genentech).
Mulțumim lui Kenneth B. Adler, Richard C. Boucher, Stephen D. Carrington, C. William Davis, Kyubo C. Kim, Christopher M. Evans, Susan J. Muller, Jay A. Nadel, Mary C. Rose, David J. Thornton și Jeffrey J. Wine pentru lectura atentă a unei versiuni anterioare a manuscrisului; și membrii laboratoarelor Fahy și Dickey pentru informații utile.
Note de subsol
Nu a fost raportat niciun alt potențial conflict de interese relevant pentru acest articol.
- Totul despre grăsime și funcția sa în coacerea Baker Bettie
- Totul despre ouă și funcția lor la coacerea Baker Bettie
- Biscotti de migdale - Joncțiunea funcțională
- A fi supraponderal poate schimba structura inimii, funcția adulților tineri - ScienceDaily
- Cele mai bune 5 alimente pentru a ajuta funcția tiroidiană în mod natural; Suntem Simțiți