Termeni asociați:
- Schistosomiaza
- Boli infecțioase
- Albendazol
- Helmintii
- Eficacitatea vaccinului
- Prevalenta
- Morbiditate
- Paraziți
- Virusul imunodeficienței umane
- Hookworm
Descărcați în format PDF
Despre această pagină
Neuroparazitologie și neurologie tropicală
José Eymard Homem Pittella, în Manualul de neurologie clinică, 2013
Strongyloidiasis
Această helmintiază este cauzată de Strongyloides stercoralis. În cazurile de autoinfecție, larvele filariforme infecțioase pot ajunge la SNC prin răspândirea hematogenă. Ciclul autoinfecției este intensificat la pacienții cu imunosupresie, în special infecția cu HTLV-1, terapia cu corticosteroizi, limfomul, malnutriția și, mai rar, infecția cu HIV, ducând la infecția diseminată (sindromul de hiperinfecție). Inhibarea răspunsului mediat de celule TH2 este asociată cu un risc crescut de autoinfecție (Marcos și colab., 2008). Modificările patologice includ leptomeningita purulentă, reacția inflamatorie granulomatoasă, obstrucția vaselor mici cu micro-infarcte și abcese cerebrale mici (Lucas și colab., 2008; Chacko, 2010). Larvele filiforme de S. stercoralis pot fi găsite în infiltratul inflamator purulent meningeal, în interiorul granuloamelor și obstrucționând lumenul vaselor mici. În plus, larvele fără reacție de țesut gazdă pot fi, de asemenea, observate. Bacteriile gram-negative se găsesc în abcesele mici, ajungând probabil la SNC fie prin aderența la suprafața externă a larvelor, fie în interiorul intestinului larvelor.
Abordări pentru proiectarea și sinteza medicamentelor antiparazitare
Satyavan Sharma, Nitya Anand, în Biblioteca de Farmacochimie, 1997
2.1.1.11 Larva viscerală migrans
Această formă de helmintiază tisulară este cauzată de migrarea larvelor ascaridelor de câine și pisică, Toxocara canis și Toxocara cati în țesuturile viscerale ale oamenilor. Boala este mai frecventă la copii decât la adulți care vin adesea în contact cu ouăle de T. canis sau T. catti în timp ce se joacă pe pământ contaminate de fecale de pisică și câine. Infecția cu Toxocara la câini este cosmopolită; cu toate acestea, sondajele indică faptul că este răspândită în SUA, Marea Britanie, Africa și unele părți ale Asiei [31,32]. La om rata sau incidența migrenei larvelor viscerale este scăzută; cu toate acestea, se estimează că aproape 10.000 de oameni poartă această boală în întreaga lume [24] .
După ce ajung la intestinul omului, ouăle eliberează larve care pătrund în peretele intestinal și intră în sistemul sanguin portal de unde sunt transportate la ficat, plămâni și diferite părți ale corpului. Larva se dezvoltă rar în adult în intestinul uman, deoarece omul nu este gazda sa naturală. La pisici și câini, larvele se dezvoltă în bărbați și femele adulte.
Faza incipientă a toxocariazei la om prezintă eozinofilie scăzută până la mare, care dispare pe măsură ce infecția cronicizează. Se pot observa ocazional atacuri de febră, stare generală de rău, greață, vărsături, tuse, dureri abdominale, anorexie, scădere în greutate și dureri musculare și articulare. În cazurile cronice, pacientul poate raporta unele probleme oculare, cum ar fi vederea slabă și viziunea imparțială care rezultă din migrarea larvelor în ochi. Complicațiile hepatice, cum ar fi hepatita și problemele pulmonare, cum ar fi tusea și atacurile astmatice, pot apărea din cauza migrației larvelor către ficat și, respectiv, plămâni. În mod similar, implicarea creierului în toxocariază poate da naștere unui sindrom asemănător epilepsiei.
Indicele medicamentelor utilizate în medicina ecvină
Derek C. Knottenbelt OBE, BVM & S, DVM & S, DipECEIM, MRCVS, Fernando Malalana DVM, DipECEIM, FHEA, MRCVS, în Saunders Equine Formulary (Ediția a doua), 2015
Mebendazol
Indicații: Tratamentul helmintiazei (puternicilor și ciatostomilor), Parascaris equorum matur și larvar, Oxyuris equi adult, Dictyocaulus arnfieldi la o doză specială.
Prezentări: Seringi gradate (kg) - 4 g mebendazol micronizat în 20 g pastă.
Plicuri conținând 20 g mebendazol pentru utilizare în hrana animalelor.
Doza: 8,8 mg/kg. Repetați la fiecare 6 săptămâni.
15–20 mg/kg zilnic timp de 5 zile pentru Dictyocaulus arnfieldi.
Note:
Sigur pentru iepele și mânjele însărcinate. Poate provoca diaree ușoară în caz de supradozaj. Măgarii însărcinați NU ar trebui să primească regimul de dozare mai mare.
NU se utilizează la caii destinați consumului uman.
Modelele de rezistență nu sunt încă clare.
Boli pulmonare eozinofile
Pneumoniile eozinofile în alte infecții parazitare
Ancylostoma brasiliense de cârlig, care provoacă helmintiază cutanată (erupție târâtoare), poate produce eozinofilie pulmonară simplă în 50% din cazuri. Manifestările pulmonare se dezvoltă după a șaptea zi de erupție cutanată. Ancylostoma duodenale și Necator americanus sunt alte posibile cauze ale sindromului Löffler.
În schistosomiaza acută timpurie (datorată infecției fie cu Schistosoma haematobium, fie cu S. mansoni), pacienții pot dezvolta noduli pulmonari transitori, multipli, mici pe radiografia toracică (cel mai bine văzut la tomografia computerizată toracică) și eozinofilia 251 (vezi eFig. 68-6B) . În schistosomiaza cronică, embolizarea ovulelor în arterele mici din plămâni are ca rezultat formarea granulomului, ocluzia și remodelarea arterelor pulmonare și hipertensiunea pulmonară suplimentară mediată de hipertensiunea portopulmonară. 252.253 Granulomul cuprinde limfocite, eozinofile și celule gigant. Se poate dezvolta un post-tratament al pneumonitei eozinofile (denumită și schimbare pulmonară, pneumonie parazită și pneumonită reacțională de tip Löffler). 254 Ar putea rezulta din eliberarea de antigen parazit după tratament.
Parazitul filarial al câinelui Dirofilaria immitis (lovitura pulmonară) se poate dezvolta ocazional în viermi adulți în plămânii umani după inocularea larvelor infecțioase de către țânțari (eFig. 68-6C). Se poate manifesta prin opacități pulmonare eozinofile în studiile de imagistică toracică (vezi Fig. 39-3).
Alți paraziți care cauzează manifestări pulmonare rare cu eozinofilie includ Paragonimus westermani (vezi Fig. 39-4 și eFig. 39-3), Trichomonas tenax, Capillaria aerophila și Clonorchis sinensis (vezi eFig. 68-6D).
Progrese în parazitologie
Hélène Moné,. Gabriel Mouahid, în Progresele în parazitologie, 2010
2.1 Introducere
Schistosomiaza este o helmintiază umană transmisă de apă cauzată de lovituri de sânge și apare în aproximativ 76 de țări din întreaga lume (Africa, America de Sud, Orientul Mijlociu și continentul din Asia de Sud) (Engels și colab., 2002). Se estimează că 779 de milioane de oameni sunt expuși riscului de infectare cu schistozomi și 207 de milioane de oameni sunt infectați, mai ales în Africa subsahariană (97%) (Steinmann și colab., 2006). Cei mai expuși riscului sunt copiii de vârstă școlară, femeile cu copiii lor și copiii preșcolari și cei implicați în ocupații precum irigații, agricultură și pescuit. Cele două specii majore de schistozomi umani din Africa, Schistosoma haematobium și Schistosoma mansoni, alcătuiesc 2 din cele 13 boli tropicale neglijate (NTD) de pe acest continent (Molyneux și colab., 2005). Schistosomiaza face parte din cele mai răspândite șapte NTD (Hotez și colab., 2007a) și se situează ca a doua cea mai răspândită NTD după infecția cu hookworm în Africa subsahariană (Hotez și Kamath, 2009).
Ciclul de viață al schistozomilor umani include două gazde obligatorii: gazda umană în care se reproduc sexual paraziții masculi și femele adulți (dioecie) și un melc de apă dulce în care parazitul se înmulțește asexuat. Transmiterea de la om la melc este asigurată de un stadiu larvar de înot, miracidium, care cloceste din ou și care pătrunde activ în melc. Transmiterea melcului la om este asigurată de cercarie, un stadiu larvar de înot produs de etapele larvare intramoluscane, sporocistii. Cercaria pătrunde activ și migrează prin pielea umană, ajunge în sistemul vascular, călătorește la ficat, unde crește până la un vierme adult. Aici, viermii masculi și femele se împerechează și apoi trăiesc mulți ani în vasele de sânge din jurul vezicii urinare sau intestinului, hrănindu-se cu sânge. Viermii femele depun ouă, dintre care multe scapă din corp în timpul urinării sau al defecației. În infecțiile severe, mii de ouă scapă zilnic din corp prin ruperea vaselor de sânge capilare cauzând pierderea de sânge. Acele ouă care nu scapă sunt prinse în principal în ficat, provocând daune și, în cazuri extreme, ducând în cele din urmă la moarte.
Nici o țară din continentul african subsaharian nu este ferită de infecții astăzi și mai rău este și dezvoltarea resurselor de apă, cum ar fi construirea barajelor și schemele de irigații, pentru a face față cererii tot mai mari de apă, hrană și energie care duce adesea la o extinderea habitatelor melcilor gazdă intermediari, îmbunătățirea potențialelor locuri de transmisie pentru schistosomiază și introducerea schistosomiazei în zone noi.
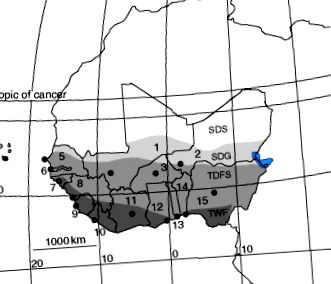
Comunitatea economică a statelor din Africa de Vest (ECOWAS) este cea mai populată comunitate economică regională din Africa. Reprezintă o piață comună din vestul Africii de peste 280 de milioane de consumatori, adică aproximativ 30% din populația totală a continentului african. Este un grup de 15 țări, fondat în 1975, iar statele membre includ: Benin, Burkina Faso, Capul Verde, Coasta de Fildeș, Gambia, Ghana, Guineea, Guineea Bissau, Liberia, Mali, Niger, Nigeria, Senegal, Sierra Leone și Togo (Fig. 2.1). Aceste țări oferă o gamă largă de medii naturale cu patru clase de ecoregiune (teren cu aceeași succesiune de plante caracteristică), de la nord la sud: deșertul și semi-deșertul subtropical, pășunile uscate subtropicale, pădurea uscată tropicală și savana și pădure tropicală umedă (Fig. 2.1). Numărul de clase în care fiecare țară a ECOWAS este traversată de la o singură clasă pentru Capul Verde (pajiști uscate subtropicale), Gambia și Togo (pădure subtropicală uscată și savana) și Liberia (pădure tropicală umedă) la trei clase pentru Niger, Mali și Nigeria; celelalte opt țări sunt traversate de două clase de ecoregiune.
Figura 2.1. Cele 15 țări aparținând Comunității Economice a Statelor Africii de Vest (ECOWAS) cu ecoregiunile care le transectează: 1, Mali; 2, Niger; 3, Burkina Faso; 4, Capul Verde; 5, Senegal; 6, Gambia; 7, Guineea-Bissau; 8, Guineea; 9, Sierra Leone; 10, Liberia; 11, Coasta de Fildeș; 12, Ghana; 13, Togo; 14, Benin; 15, Nigeria; SDS, deșert subtropical și semi-deșert; SDG, pajiști uscate subtropicale; TDFS, pădurea tropicală uscată și savana; TWF, pădure tropicală umedă. Punctele negre sunt capitalele.
ECOWAS își propune să promoveze programe, proiecte și activități de cooperare și integrare, în special în alimentație, agricultură și resurse naturale, industrie, transporturi și comunicații, energie, comerț, bani și finanțe, impozitare, politici de reformă economică, resurse umane, educație, turism, probleme juridice, informație, cultură, știință, tehnologie, servicii și sănătate. O Agenție specializată a ECOWAS, numită Organizația pentru Sănătate din Africa de Vest (WAHO), a fost înființată în 1987. A fuzionat cu „Organizația de coordonare și cooperare francofonă pentru Lutte Contre les Grandes Endémies” (OCCGE) și Comunitatea anglofonă de sănătate din Africa de Vest (WAHC) și s-a angajat să depășească frontierele lingvistice pentru a deservi toate cele 15 state membre ale CEDEAO. Obiectivele sale sunt următoarele: „la realizarea celui mai înalt standard posibil și protecția sănătății popoarelor din subregiune prin armonizarea politicilor statelor membre, punerea în comun a resurselor și cooperarea între ele și cu ceilalți pentru o luptă colectivă și strategică împotriva problemelor de sănătate din subregiune ”.
Principiul de bază pentru CEDEAO este creșterea nivelului de trai al popoarelor sale (aproximativ 7,5 milioane de oameni (aproape jumătate fiind femei), aproape 3% din populația regională sunt considerați migranți) și eliminarea, între statele membre, a obstacolelor în calea libertății circulația persoanelor, a mărfurilor, a serviciilor și a capitalului. Cu toate acestea, această liberă circulație a oamenilor, împreună cu marea rețea de apă din ECOWAS, favorizează extinderea bolilor endemice parazite dependente de apă, cum ar fi malaria, onchocerciaza și schistosomiaza. Mai mult decât atât, marea majoritate a țărilor din ECOWAS adăpostesc 5 din cele 13 NTD din Africa și schistosomiaza la indivizi este adesea asociată cu trei infecții diferite cu helminți (STH) (ascariază, trichuriasis și hookworm) (Molyneux și colab., 2005 ).
Schistosomiaza cauzează probleme grave de sănătate publică în această regiune a Africii și sunt publicate în mod regulat date epidemiologice privind prevalența infecției la om, asociate sau nu cu sondaje malacologice și prevalența schistozomilor la melci. Cu toate acestea, eforturile de actualizare periodică a datelor epidemiologice pentru a urmări evoluția bolii sunt diferite în funcție de țările cu care este asociată. Diferite sunt și modalitățile prin care fiecare țară luptă împotriva bolii. Într-adevăr, țările ECOWAS pot fi separate în două grupuri: primul grup include țările integrate în Inițiativa de control al schistosomiazei (SCI), iar al doilea grup include toate celelalte țări. Cele mai importante două specii schistozomiale umane existente în ECOWAS sunt S. haematobium și S. mansoni. O a treia specie, Schistosoma guineensis (Kane și colab., 2003; Pagès și colab., 2003), este de asemenea prezentă și provine din împărțirea Schistosoma intercalatum în două specii separate, S. intercalatum în Republica Democrată Congo și S. guineensis în regiunea Guineea de Jos. Prin urmare, în prezentul capitol, vom considera schistosomiaza rectală în ECOWAS ca fiind datorată S. guineensis și nu S. intercalatum.
Prezentul studiu își propune să actualizeze datele mai importante și recente despre epidemiologia schistosomiazei umane în ECOWAS. Obiectivele sunt, pentru fiecare dintre țările ECOWAS, să prezinte țara cu ecoregiunile, hidrografia și diviziunile sale administrative; să actualizeze datele epidemiologice privind prevalența infecției atât la om, cât și la melci și programele de control care sunt în curs de dezvoltare.
- Maalox - o prezentare generală Subiecte ScienceDirect
- Brânză cu conținut scăzut de grăsimi - o prezentare generală Subiecte ScienceDirect
- Alimentele pentru sugari - o prezentare generală Subiecte ScienceDirect
- Malting - o prezentare generală Subiecte ScienceDirect
- Sarea iodată - o prezentare generală Subiecte ScienceDirect