Hidroliza și oxidarea lipidelor sunt considerate origini posibile pentru protonofori cu acizi slabi.
Termeni asociați:
- Lipozom
- Lipide
- Acid gras
- Enzimă
- Proteină
- Diacilglicerol
- Colesterol
- Triacilglicerol lipaza
- Proteina kinază C
Descărcați în format PDF
Despre această pagină
ȚESUT ADIPOS Structura și funcția țesutului adipos alb
Reglarea metabolismului țesutului adipos
Atât sinteza lipidică, cât și hidroliza sunt sub control hormonal complex. Hormonii reglează cantitățile de enzime cheie și alte proteine implicate, precum și activitățile lor. În plus, sistemele de „transducție a semnalului” (o serie de reacții care transmit semnale induse de hormoni către ținte din celulă), prin care hormonii își realizează efectele, sunt, de asemenea, supuse controlului endocrin în sine și modificări ale capacității adipocitelor de a transmite astfel de semnale sunt o parte importantă a adaptărilor la unele stări fiziologice (de exemplu, lactație).
Insulina crește sinteza și secreția lipoproteinei lipazei; acest efect este accentuat de glucocorticoizi. Inhibitorii gastrici polipeptidici cresc, de asemenea, activitatea lipoproteinelor lipazice; este probabil ca acest efect să fie important pentru promovarea depunerii de grăsimi la animalele care consumă diete bogate în grăsimi, deoarece aceste diete stimulează secreția acestui hormon. Astfel, insulina și anumiți hormoni intestinali cresc sinteza grăsimilor prin creșterea aportului de acizi grași pentru esterificare. Insulina promovează, de asemenea, formarea glicerolului 3-fosfat, cel puțin parțial, prin creșterea absorbției glucozei de către adipocite. Rata de esterificare a acizilor grași în sine nu poate fi stimulată direct de hormoni, dar variază direct în funcție de disponibilitatea acizilor grași. În mod curios, adipocitele secretă adipsină și două proteine înrudite, care interacționează în prezența chilomicronilor, pentru a produce proteine care stimulează acilarea, care acționează apoi asupra adipocitelor pentru a stimula esterificarea și absorbția glucozei.
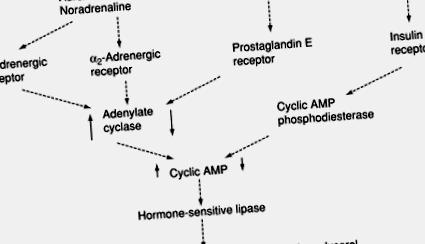
Figura 5. Controlul hidrolizei triacilglicerolului (lipolizei) de către catecolamine (adrenalină și noradrenalină) și insulină. AMP, adenozin monofosfat; ↑, ↓, activitatea/concentrația a crescut sau a scăzut, respectiv, prin stimul.
Metabolismul țesutului adipos se află astfel sub control complex. În general, insulina promovează sinteza grăsimilor și inhibă lipoliza, în timp ce catecolaminele și glucagonul inhibă sinteza și favorizează lipoliza. În plus, hormonii steroizi, hormonii tiroidieni și hormonul de creștere acționează pentru a modula efectele insulinei și catecolaminelor, cel puțin parțial, modificând capacitatea sistemelor de transducție a semnalului de a transmite semnale.
Sisteme și dispozitive purtătoare pe bază de lipozomi utilizate pentru administrarea pulmonară de medicamente
Iftikhar Khan,. Waqar Ahmed, în Biomateriale și Medical Tribology, 2013
9.4.3 Uscare prin congelare
Preparatele lipozomice nu au prezentat nicio modificare fizică înainte sau după uscare prin congelare. Cu toate acestea, a crescut stabilitatea și a redus timpul de reconstituire (Elhissi A. M. A. și Taylor 2005, Lee și colab. 2007).
Analiza metabolică utilizând izotopi stabili
Serghei Tumanov,. Jurre J. Kamphorst, în Methods in Enzymology, 2015
3.2 Analiza LC-MS
Înțelegerea și optimizarea degradării microbiene a uleiului de măsline
42.5 Identificarea etapei de limitare a ratei
Figura 42.4. Prezentare schematică a proceselor celulare și biochimice și a câtorva parametri fizico-chimici importanți implicați în degradarea microbiană a uleiurilor naturale. „Micela” reprezintă substratul într-o stare agregată, adică sub forma unui monostrat adsorbit, a unei micele sau a unei emulsii conform Verger (1997). Substratul este, de asemenea, prezent într-o formă neagregată ca „monomer”, sub concentrația sa critică de micelă (CMC). „Peretele celular” reprezintă bariera de transport pentru transportul substratului în celulă și translocarea lipazei în afara celulei și este mai complexă în compoziția sa structurală decât extrasă. Rețineți că bacteriile gram-negative, de exemplu, au două membrane distincte și un spațiu periplasmatic între ele, ceea ce este crucial pentru plierea corectă a lipazei.
(Jaeger și Eggert, 2002)
Volumul 2
Introducere
Protein kinaza C (PKC) a fost în centrul atenției de la descoperirea de acum un sfert de secol că, prin activarea sa prin diacilglicerol, transmite semnale de la hidroliza lipidelor la fosforilarea proteinelor [1]. Descoperirea ulterioară că PKC sunt ținte ale esterilor de forbol, analogi funcționali nehidrolizabili ai ligandului endogen, diacilglicerolul, a dus la o avalanșă de rapoarte privind efectele esterilor de forbol asupra funcției celulare [2-6]. Studiile biofizice, biochimice, celulare și fiziologice din ultimele două decenii, completate de recentele progrese imagistice structurale și celulare, au dezvăluit multe dintre secretele acestui traductor de semnal în stadiul central [7-9]. Semnalizarea sa necontrolată face ravagii în celulă, după cum este reprezentat de proprietățile puternice de promovare a tumorii ale esterilor de forbol, care o prezintă ca o țintă terapeutică în boli precum cancerul. Acest capitol rezumă înțelegerea noastră actuală a mecanismelor moleculare ale modului în care protein kinaza C transduce informații de la mediatori lipidici la fosforilarea proteinelor.
PROBLEME DE SPOLIERE Probleme cauzate de bacterii
Ruperea altor produse lactate
Microflora laptelui integral tinde să fie prezentă în componenta cremă. Deoarece crema este ingredientul principal al untului, deteriorarea microbiană poate fi o problemă. Microorganismele asociate cu hidroliza lipidică a trigliceridelor în acizi grași liberi pot produce aciditate crescută, râncezire și săpun în unt. Agenții cauzali includ Pseudomonas, Micrococcus și Serratia spp. Curățarea sau putriditatea suprafeței rezultă din creșterea S. putrefaciens.
Contaminarea bacteriană a brânzei este de obicei rezultatul fabricării cu lapte care are un conținut microbian ridicat (≥1000 cfu ml -1). Creșterea nedorită a bacteriilor lactice, cum ar fi Leuconostoc spp. și L. lactis, pot provoca o decolorare roz nedorită lângă suprafața brânzei. Bacillus, Leuconostoc și Pseudomonas spp. poate ataca proteinele și produce dioxid de carbon. Producerea de cantități mari de gaz poate duce la formarea unor găuri nedorite în caș în timpul fabricării brânzeturilor. Aceste bacterii sunt responsabile pentru aroma amară și mucoasa din brânzeturile moi și tari (de exemplu, Brie și, respectiv, parmezan).
În brânza de vaci, Pseudomonas spp., Și anume P. fragi, poate modifica aromele lăsând un gust putrid, rânced, amar sau fructat. O altă problemă este creșterea Flavobacterium spp., Care poate modifica culoarea brânzei de vaci. Escherichia coli în cantități suficient de mari (100 000 cfu g −1) poate avea ca rezultat un gust necurat sau de orz, mai ales atunci când brânza de vaci este lăsată la temperatura camerei (22 ° C).
Dislipidemii mixte primare
Deficiența HL
HL este o enzimă hepatică cheie implicată în catalizarea hidrolizei trigliceridelor și fosfolipidelor din lipoproteinele rămase și din particulele HDL, care joacă astfel un rol important în conversia IDL în LDL. HL hidroliza lipidică în particulele rămase contribuie la absorbția hepatică a acestora printr-un proces mediat de Apo E. În plus, HL este implicat în remodelarea particulelor rămase, HDL și LDL, precum și în producția de LDL mici și dense (Carmena și colab., 2004; Kobayashi și colab., 2015).
Deficitul de HL este o boală autozomală recesivă rară care duce la hiperlipidemie mixtă, caracterizată prin creșterea colesterolului și a trigliceridelor cauzată de acumularea de resturi de lipoproteine și aceasta poate fi însoțită de niveluri normale sau crescute de HDL-C (Hegele și colab., 1993). . Diferite mutații ale genei HL (LIPC) s-au dovedit a duce la pierderea activității circulante a HL, provocând o creștere a resturilor plasmatice și a HDL bogat în trigliceride, care produce un risc crescut de CHD (Chatterjee și Sparks, 2011). Fenotipul este similar cu cel găsit în FDBL, cu niveluri ridicate de colesterol total și trigliceride, arcus cornean prematur, xantome palmar și tubero-eruptive și BCV prematură (Semenkovich et al., 2016).
Diagnosticul necesită demonstrarea deficitului de HL cu teste in vitro ale activității HL în probe de plasmă postheparină sau analize ADN pentru a identifica o mutație. După cum sa indicat în tratamentul FDBL, se recomandă terapia cu statine pentru a reduce lipoproteinele rămase și riscul de BCV în această boală.
Formularea de creme, geluri, loțiuni și suspensii
4.4 Formularea cu lipozomi
Lipozomii au o soluție apoasă de miez înconjurată de o membrană hidrofobă, sub forma unui strat strat lipidic. În timpul procesului de formulare, materialele hidrofile pot fi dizolvate în nucleul apos și materialele hidrofobe realizate pentru a se asocia cu stratul bistrat. În consecință, lipozomii pot fi utilizați în formulări ca „purtători” atât pentru ingrediente hidrofile, cât și hidrofobe. Membranele celulare din pielea umană sunt, de asemenea, alcătuite din structuri bistrat lipidice. Straturile lipidice ale lipozomilor din produsele formulate se pot „fuziona” cu straturile din membrana celulară, livrând astfel conținutul lipozomului într-un loc de acțiune. În acest fel, lipozomii pot fi folosiți ca vehicul pentru administrarea substanțelor nutritive și a medicamentelor farmaceutice.
Prezența surfactanților într-o formulare va compromite integritatea lipozomilor. Ca urmare, stabilitatea devine o preocupare majoră atunci când se încearcă formularea lipozomilor în sistemele de emulsie. Pentru căile de administrare topice sau transdermice, lipozomii pot fi formulați în siguranță în doze de tip gel. Gelurile fabricate din carbomer, derivați de celuloză și acizi hialuronici sunt cele mai potrivite pentru formularea cu lipozomi. Prinderea lipozomilor într-o matrice îngroșată ajută la prelungirea duratei lor de valabilitate, reducând posibilitatea coliziunilor lipozom - lipozom. Pentru formulări injectabile de lipozomi, lipozomii pot fi liofilizați și furnizați cu un mediu purtător separat adecvat (cum ar fi soluții de soluție salină sau dextroză). Lipozomii sunt resuspendați prin amestecarea cu mediul purtător imediat înainte de injectarea în corp.
Unii dintre factorii critici care afectează stabilitatea lipozomilor includ [4]:
pH-ul formulării: un pH de formulare finită de 6,5 este ideal, deoarece, la acest pH, rata hidrolizei lipidelor este cea mai mică.
Temperatura de depozitare: lipozomii sunt foarte sensibili la temperaturi care favorizează oxidarea și scurgerea încărcăturii prinse. Prin urmare, depozitarea la 2-8 ° C este ideală. În plus, este esențial ca lipozomii încărcați să nu fie supuși condițiilor de îngheț și dezgheț, deoarece se știe că încărcătura încărcată poate scurge după îngheț - stres de dezgheț.
Sistem de închidere a containerelor: selectarea sistemului de închidere a containerelor utilizat pentru depozitarea formulărilor de lipozomi este crucială. Lipozomii nu sunt compatibili cu anumite materiale plastice. Pentru suspensiile lipozomice injectabile, testarea compatibilității cu dopurile elastomerice care urmează să fie utilizate cu flacoanele de injecție este esențială. Folosirea fiolelor de sticlă, mai degrabă decât a fiolelor de injecție cu dop, este adesea mai sigură. Deoarece lipidele sunt sensibile la fotooxidare, este foarte recomandat să le protejați de lumină în timpul depozitării.
Tuburi de perfuzie: Pentru formulări de lipozomi infuzibili, este esențială stabilirea compatibilității suspensiilor de lipozomi cu tuburile intravenoase, deoarece acest tub este realizat din materiale plastice sintetice. Eticheta produsului trebuie să specifice părțile/tipurile de tuburi care pot fi utilizate în timpul administrării medicamentului.
Enzime, industriale (prezentare generală)
Enzime în modificarea grăsimilor și uleiurilor
Lipazele (EC 3.1.1.3, glicerol ester hidrolaze) sunt o clasă omniprezentă de enzime care catalizează hidroliza, esterificarea (sinteza) și transesterificarea (schimbul grupului de esteri). Aceste enzime sunt utilizate în diverse scopuri, cum ar fi hidroliza grăsimilor, dezvoltarea aromelor în produsele lactate, sinteza esterilor, transesterificarea grăsimilor și uleiurilor, producerea de compuși organici chirali, produse de spălare și curățare și tratarea produselor casnice și industriale. Reacțiile lipolitice apar la interfața lipidă-apă. Există două tipuri largi de lipaze bazate pe specificitatea lor de poziție. Lipaza nespecifică eliberează acizi grași din toate cele trei poziții ale porțiunii glicerol și este utilizată pentru a hidroliza complet grăsimile și uleiurile pentru a elibera acizii grași și glicerina. Acestea sunt produse de Candida sp., Staphylococcus sp. Și Geotrichum sp. Celălalt tip de enzimă este lipaza 1,3-specifică care eliberează acizi grași din pozițiile 1,3 și acizi grași liberi preferențial și di- și monogliceride ca produse de reacție. Acest tip de lipază este produs de Aspergillus, Mucor, Rhizopus și Pseudomonas sp.
Fermentare în stare solidă pentru producția de lipaze pentru aplicații de mediu și biodiesel
2.5 Aplicații ale lipazelor produse prin fermentare în stare solidă
Deși numeroase lipaze au fost produse de SSF, doar câteva rapoarte descriu aplicarea acestor biocatalizatori.
Cele mai studiate aplicații pentru lipazele SSF sunt sinteza esterilor de aromă și parfum [48,69-72], sinteza biodieselului [50,54,57,59,68,73-76] și hidroliza lipidică a apelor uzate cu un conținut ridicat de ulei și grăsimi [77-84]. Lipazele SSF au fost, de asemenea, folosite pentru a îndepărta uleiul din țesătura de bumbac [85], pentru a spori aroma ceaiului negru [86], reacția enantioselectivă [67], intereserificarea lipidelor [87], hidroliza selectivă a uleiului [65] și hidroliza uleiului și a grăsimilor [ 56,88] .
Având în vedere varietatea largă de aplicații lipazice și puținele zone acoperite cu lipaze SSF, rămâne încă o zonă mare de explorat. Următoarea secțiune tratează mai detaliat aplicarea lipazelor SSF în scopuri de biodiesel.
- Inulina - o prezentare generală Subiecte ScienceDirect
- Vâscul - o prezentare generală Subiecte ScienceDirect
- Cafeaua instant - o prezentare generală a subiectelor ScienceDirect
- Dieta cu indice glicemic scăzut - o prezentare generală Subiecte ScienceDirect
- Ilex Paraguariensis - o prezentare generală Subiecte ScienceDirect