1 Departamente de Chirurgie și Fiziologie Medicală, Institutul de Cercetări Cardiovasculare, Centrul de Științe ale Sănătății Sistemului Universitar A&M din Texas, Temple, Texas 76504
1 Departamente de Chirurgie și Fiziologie Medicală, Institutul de Cercetări Cardiovasculare, Centrul de Științe ale Sănătății Sistemului Universitar A&M din Texas, Temple, Texas 76504
1 Departamente de Chirurgie și Fiziologie Medicală, Institutul de Cercetări Cardiovasculare, Centrul de Științe ale Sănătății Sistemului Universitar A&M din Texas, Temple, Texas 76504
1 Departamente de Chirurgie și Fiziologie Medicală, Institutul de Cercetări Cardiovasculare, Centrul de Științe ale Sănătății Sistemului Universitar A&M din Texas, Temple, Texas 76504
Abstract
endoteliul vascular servește ca o barieră eficientă pentru a controla trecerea transvasculară a substanțelor dizolvate, a fluidelor și a celulelor sanguine. Modificările funcției de barieră sunt implicate în trombogeneză, angiogeneză, inflamație și leziuni de ischemie-reperfuzie. Legarea agoniștilor și a celulelor inflamatorii de celulele endoteliale determină o multitudine de evenimente de semnalizare intracelulară, care pot duce la o creștere a permeabilității endoteliale (12, 19, 30, 34). Interacțiunea cu actomiozină generează forțe contractile care îndepărtează celulele endoteliale strâns legate, ducând la efluxul macromolecular. O proteină adezivă transmembranară numită endotelial vascular (VE) -cadherină formează joncțiuni endoteliale aderente (AJ) care inhibă scurgerea paracelulară a macromoleculelor. Când echilibrul dintre aceste forțe adezive și contractile este modificat, apar disfuncții de barieră și scurgeri.
Studiile anterioare au arătat că un grup de celule inflamatorii, leucocitele polimorfonucleare (PMN), aderă și migrează prin endoteliu în țesuturile înconjurătoare la locurile de leziune sau inflamație și că acest proces este asociat cu permeabilitatea crește (1, 2, 35). Am demonstrat că hiperpermeabilitatea indusă de PMN are loc concomitent cu o creștere a fosforilării tirozinei a VE-cadherinei și β-cateninei, un membru important al unei familii de proteine care leagă complexul cadherin de citoscheletul de actină (14, 16, 27). Recent, studiile au arătat o legătură aparentă între β-catenina și tirozin kinazele familiei Src (Src) (17). Se știe că kinazele Src joacă un rol în semnalizarea transducției disfuncției barierei endoteliale și a angiogenezei (9, 13, 15, 24). Activitatea Src este reglementată de fosforilarea tirozinei la Tyr416, care reglează în sus kinaza, și Tyr527, ceea ce face ca Src să fie mai puțin activ (24).
Produse chimice și medicamente.
Substanțele chimice utilizate au fost C5a recombinant uman și oxid de fenilarsină (PAO; Sigma), SRCi și PP1 (Calbiochem), anti-Src policlonal și anti-β-catenin policlonal (Santa Cruz), antifosfo-Src policlonal (Tyr416) și ( Tyr527) (Semnalizare celulară) și antifosfotirozină policlonală (Transducție). SRCi [Ac-Tyr (PO3H2) -Tyr (PO3H2) -Tyr (PO3H2) -Ile-Glu-OH] concurează pentru legarea la domeniile SH2 (31). Peptida de control negativă a fost [Ac-Asp-Ser (PO3H2) -Thr (PO3H2) -Val-Ser (PO3H2) -OH].
Izolarea și perfuzia microvaselor.
Analize de celule endoteliale.
Izolarea neutrofilelor.
Neutrofilele porcine (PMN) au fost izolate așa cum s-a descris anterior (27). Pentru activare, PMN-urile au fost expuse la C5a recombinant uman (10-8 M). În preparatele izolate de venulă, PMN-urile au fost adăugate la baia de suflare și, în cazul studiilor HUVEC, au fost adăugate direct pe monostrat, în ambele cazuri la o concentrație de 10 6/ml. Studiile anterioare au arătat că C5a afectează funcția endotelială prin căi dependente de neutrofile, dar nu afectează permeabilitatea de la sine (27).
Transfectia proteinelor.
Pentru a transfecta venulele cu SRCi, vasele au fost perfuzate timp de 1 oră cu peptida la 10 μg/ml în prezența reactivului de transfecție a poliaminei TransIT-LT1 (PanVera) la 10 μl/ml. Studiile anterioare de transfecție folosind proteine fluorescente verzi și diferite peptide inhibitoare au arătat că aceasta este o modalitate adecvată de a introduce proteine / peptide în microvase intacte (28). În plus, TransIT-LT1 singur nu are efecte aparente asupra permeabilității sau vasoreactivității microvasculare (28). Pentru transfecția HUVEC, SRCi și TransIT-LT1 au fost adăugate la mediul celular la aceleași concentrații și transfecția a fost lăsată să continue timp de 1 oră. Studiile anterioare au arătat transfecția cu succes a proteinelor celulelor endoteliale folosind această tehnică (26).
Analiza datelor.
În studiile de imunoblot, a fost selectată o imagine reprezentativă a Western blot. Au fost efectuate cel puțin trei repetări pentru fiecare intervenție, iar densitățile optice ale benzilor de proteine au fost calculate în medie. Analiza varianței a fost utilizată pentru a evalua semnificația diferențelor intergrupale în analizele imunoblot și studiile de permeabilitate. O valoare de P 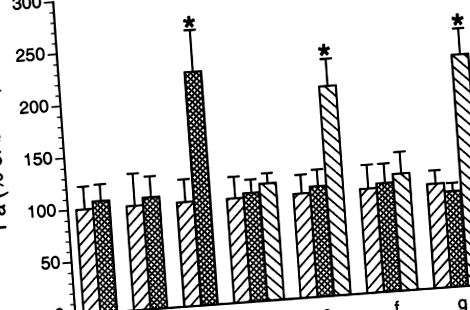
FIG. 1.Hiperpermeabilitatea venulară indusă de leucocitele polimorfonucleare (PMN). Venulele au fost perfuzate cu soluție de sare fiziologică a albuminei (APSS), iar coeficientul de permeabilitate bazală al albuminei (Pa) a fost determinat pe o perioadă de 1 oră (prima bară din fiecare grup). Rezultatele sunt exprimate ca procentaj bazal. Tratamentele au fost după cum urmează: A: PMN porcin neactivat (10 6/ml),b: C5a (10 −8 M), c: C5a a activat PMN, d: SRCi transfectat timp de 1 oră urmat de PMN activat C5a, e: peptida martor negativ transfectată timp de 1 oră urmată de PMN activat cu C5a, f: PP1 (10-6 M) urmat de PM5 activat C5a și g: DMSO (0,05%) urmat de PM5 activat C5a. Valorile sunt medii ± SE. * Creșterea semnificativă a permeabilității bazale,P
Hiperpermeabilitatea indusă de PMN în celulele endoteliale cultivate.
Pentru a determina că răspunsul de permeabilitate al monostratelor de celule endoteliale este în acord cu cel al venulelor intacte, HUVEC-urile au fost expuse la PMN-uri activate după transfecție cu SRCi sau peptidă de control negativ sau expunere la PP1. Așa cum se arată în Fig.2b, PMN-urile activate au indus răspunsuri semnificative de hiperpermeabilitate peste nivelurile de control. În plus, supernatantul obținut după ce PMN-urile activate au fost centrifugate a avut un efect similar asupra permeabilității (Fig. 2c). Cu toate acestea, SRCi a abolit complet aceste creșteri ale permeabilității (Fig. 2e). Transfecția peptidei martor negativ nu a blocat hiperpermeabilitatea indusă de PMN (Fig. 2g). În acord cu efectele SRCi, PP1 a blocat și hiperpermeabilitatea indusă de PMN (Fig. 2eu), în timp ce vehiculul DMSO nu a avut niciun efect (Fig. 2k).
FIG. 2.Răspunsul la hipermeabilitate în celulele endoteliale ale venei ombilicale (HUVEC). Tratamentele au fost după cum urmează: A: Control, b: PM5 porcin activat C5a (10 6/ml),c: supernatant din PMN activat, d: SRCi,e: SRCi urmat de PMN activat, f: peptida martor negativ, g: peptida martor negativ urmată de PMN activat, h: PP1 (10 −6 M), eu: PP1 (10-6 M) urmat de PMN activat, j: DMSO (0,05%) și k: DMSO urmat de PMN activat. Pa a fost măsurat după 30 de minute, iar rezultatele sunt exprimate ca procent de control. Valorile sunt medii ± SE. * Creștere semnificativă a permeabilității, P
Fosforilarea tirozinei cardiace.
După cum sa menționat anterior, Src este o tirozin kinază care este reglementată de fosforilarea tirozinei. Folosind HUVEC, am arătat că PMN-urile activate și PAO (un inhibitor al tirozinei fosfatazei) induc fosforilarea Src la Tyr416 (Fig. 3A,benzi 4 și 7), o condiție cunoscută pentru activarea Src. Această fosforilare Tyr416 a fost atenuată în celulele care au fost transfectate cu SRCi (Fig. 3A, benzi 6 și8). Figura 3B, benzi 4 și7, arată că atunci când Src este activat de PMN sau PAO, fosforilarea la Tyr527 este scăzută. Intensitatea benzii din trei experimente diferite a fost obținută prin utilizarea densitometriei de scanare urmată de cuantificare utilizând software-ul de imagine National Institutes of Health. Aceste date au arătat că modificările de fosforilare ale Src Tyr416 și Tyr527 ca răspuns la PMN și PAO activate sunt semnificativ diferite de cele ale nivelurilor de control (Fig. 3,D și E). Cantitatea de Src prezentă în celule nu pare să varieze semnificativ în niciuna dintre condițiile de testare (Fig. 3C).
FIG. 3.Fosforilarea Src în HUVEC. Tratamentele au fost după cum urmează: 1: Control, 2: C5a (10 −8 M), 3: PMN (10 6/ml), 4: PMN activat C5a (10 6/ml), 5: SRCi transfectat timp de 1 oră,6: SRCi urmat de PMN activat (10 6/ml),7: oxid de fenilarsină (PAO) (10 −8 M) și8: SRCi urmat de PAO (10-8 M). Tratamentele au fost timp de 10 minute. După liza celulară, 10 μg de proteine din fiecare tratament au fost supuse analizei occidentale pe un gel PAGE de 6%. Anticorpii utilizați au fost după cum urmează: A: anti-fosfo Src (Tyr416), B: anti-fosfo Src (Tyr527) și C: anti-Src. D și E: benzi din A șiB, respectiv, au fost cuantificate prin densitometrie de scanare și Src Tyr416 (D) și Tyr527 (E) fosforilarea a fost exprimată ca procent de control. Aceste experimente au fost repetate de 3 ori. Valorile sunt medii ± SE. *P
Activarea Src și β-catenina.
FIG. 4.Localizarea β-cateninei în HUVEC. A: celule de control;B: celule expuse la PMN activat C5a; C: supernatant din PMN activat cu C5a; D: PP1 (10-6 M) urmat de PMN activat; E: SRCi transfectat timp de 1 oră; F: SRCi urmat de PMN activat C5a; G: Expunere PMN activată C5a, spălați cu PBS, reveniți la mediul complet timp de 1 oră; și H: peptidă martor negativă urmată de PMN activat cu C5a. După fixare și permeabilizare, celulele au fost incubate cu anticorp primar anti-β-catenină urmat de anticorp secundar conjugat cu FITC. Observați formarea decalajului și pierderea β-cateninei în locurile în care celulele au pierdut contactul B,C, și H.
FIG. 5.Asocierea Src/β-catenină indusă de PMN în HUVEC. PentruA și B, tratamentele au fost după cum urmează:1: Control, 2: PMN activat C5a (10 6/ml) și 3: SRCi transfectat timp de 1 oră urmat de PMN activat C5a (10 6/ml). După tratamentul cu PMN timp de 10 min, s-au folosit 100 μg de proteine pentru imunoprecipitarea Src. Imunoprecipitații au fost supuși analizei occidentale și au fost testați fie pentru β-catenină (A) sau Src (B). PentruC, D, și E, tratamentele au fost după cum urmează: 1: Control, 2: PM5 activat C5a (10 6/ml), 3: SRCi transfectat timp de 1 oră urmat de PMN activat C5a (10 6/ml) și 4: Transfecție SRCi. După tratamentul cu PMN timp de 10 minute, s-au folosit 100 μg de proteine pentru imunoprecipitarea β-cateninei urmată de imunoblotarea cu fosfotirozină (C) sau imunoprecipitarea cu fosfotirozină urmată de imunoblotarea β-cateninei (D). În E, 15 μg de proteină celulară totală au fost utilizate pentru imunoblotarea β-cateninei.
Studiile noastre anterioare au arătat efectele definitive ale PMN asupra endoteliului vascular, utilizând atât microvase intacte, cât și celule cultivate, în care PMN-urile activate provoacă fosforilarea și modificări conformaționale ale proteinelor AJ în asociere cu formarea decalajului intercelular (27,35). Cu toate acestea, evenimentele de semnalizare care apar între aderența PMN și modificarea AJ nu sunt bine înțelese. Acest studiu, pentru prima dată, leagă binecunoscuta cale de semnalizare Src de aceste procese. Știm că, în ceea ce privește Src tirozin kinaze, care au șase domenii funcționale, fosforilarea Tyr527 și interacțiunile dintre domeniile SH2 și SH3 stabilizează forma inactivă a Src (21). În schimb, fosforilarea Tyr416 în bucla de activare a domeniului kinazei activează Src (21). Alții au demonstrat o cerință Src pentru permeabilitatea vasculară ca răspuns la factorul de creștere endotelial vascular (9). Rezultatele noastre arată clar că hiperpermeabilitatea indusă de PMN atât în microvase cât și în celulele endoteliale poate fi mult atenuată prin inhibarea Src. PMN-urile activate au crescut fosforilarea Src Tyr416 și au scăzut fosforilarea Tyr527, două evenimente despre care se știe că reglează în sus activitatea Src. Aceste descoperiri sugerează că Src este o componentă majoră în disfuncția barierei endoteliale mediată de PMN.
Mecanismele moleculare precise care duc la scurgeri microvasculare după aderența PMN nu sunt clar înțelese. Studiile anterioare cu monostraturi endoteliale au arătat că PMN activate induc formarea fibrelor de stres actinic, spre deosebire de celulele nestimulate în care cea mai mare parte a actinei filamentoase se găsește la periferia celulară (27). Aparent, aceste fibre intră în contact cu părțile opuse ale membranei celulare și induc contracția celulară, care rupe contactele dintre celule și duce la formarea decalajului. Ipoteza noastră este că proteinele AJ interacționează cu fibrele de stres ale actinei și această interacțiune duce la o dezorganizare a AJ și la modificări ale morfologiei celulare. Fosforilarea β-cateninei, cunoscută pentru a lega VE-cadherina de citoscheletul de actină (14), poate fi un eveniment de semnalizare crucial care direcționează astfel de modificări structurale. Mecanismul propus pentru fosforilarea tirozinei β-cateninei în dezorganizarea AJ este paralel cu calea de semnalizare Wnt/β-catenină în care se constată că Wnt stabilizează β-catenina prin blocarea fosforilării serinei/treoninei și direcționarea ulterioară spre degradare, ducând la β- localizarea nucleară a cateninei și activarea transcripțională (23). Dimpotrivă, absența Wnt duce la fosforilarea serinei/treoninei β-cateninei și degradarea proteazomală (18).
Un obiectiv al acestui studiu a fost o încercare de a corela PMN-urile activate cu o cale de semnalizare care implică β-catenina care duce la alterarea componentelor AJ. Acest studiu a arătat că, în condiții stimulate de PMN, β-catenina coimmunoprecipitată cu Src. Această aparentă asociere Src/β-catenină a fost complet blocată atunci când celulele au fost transfectate cu SRCi. În plus, am putut demonstra că fosforilarea β-catenin-tirozinei indusă de PMN este blocată în condiții de inhibare a Src în celulele endoteliale cultivate. Luate împreună, aceste rezultate sugerează că interacțiunea și fosforilarea Src și β-catenină sunt necesare pentru hiperpermeabilitatea indusă de PMN. Poate că Src kinaza fosforilează direct β-catenina ca răspuns la PMN-urile activate; acest eveniment duce la dezorganizarea AJ și, în cele din urmă, a disfuncției barierei endoteliale. Este evident că Src și β-catenina sunt implicate în mai multe procese celulare și studii suplimentare vor încerca să înțeleagă mai pe deplin legătura dintre aceste două proteine și interacțiunile lor cu alte componente esențiale pentru integritatea barierei în endoteliul microvascular.
Această lucrare a fost susținută de subvențiile Institutului Național de Inimă, Plămân și Sânge HL-61507 și HL-70752 (către S. Y. Yuan) și o subvenție VA VISN 17 (către J. H. Tinsley). S. Y. Yuan este beneficiarul Premiului Institutului Național de Cercetare în Sănătate K02 HL-03606.
NOTĂ DE PICIOASĂ
Adresa pentru cereri de reimprimare și alte corespondențe: J. H. Tinsley, Dept. de Fiziologie Medicală, Texas A&M Univ. Centrul de Științe ale Sănătății Sistemului, 702 SW HK Dodgen Loop, Rm. 206F, Temple, TX 76504 (E-mail: [email protected] edu).
- Sindromul de congestie pelviană - Pacific Vascular
- Ciudat, dar adevărat, băut prea multă apă poate ucide - Scientific American
- Stroke Connection și știri American Stroke Association
- Rusia a reținut un atașat militar american bolnav de la plecarea din Moscova - The New York Times
- Program de scădere în greutate administrat de farmacist, care utilizează produsul de înlocuire a meselor American Journal of
