Abstract
O prezentare generală asupra controlului progresiei tumorilor prin intervenții dietetice
O multitudine de date epidemiologice și experimentale au demonstrat eficacitatea regimurilor dietetice geroprotectoare (de exemplu, post, calorii, proteine sau restricții de aminoacizi unici) în prevenirea cancerului (1-3). Mai mult, astfel de modele dietetice sunt eficiente în distrugerea selectivă a celulelor canceroase, în timp ce creșterea rezistenței celulelor normale la efectele toxice ale tratamentului anticancerigen.
Restricția calorică (CR), definită ca fiind cu 30-60% mai mică din necesarul zilnic de calorii fără malnutriție, este cunoscută pentru a prelungi durata de viață sănătoasă de la drojdie la mamifere (4). Efectele anticancerigene ale RC sunt cunoscute de câțiva ani (5). CR este deosebit de eficient în reducerea incidenței, masei și metastazelor celulelor cancerului de sân (6, 7). În mod remarcabil, aplicarea CR în combinație cu radioterapia a îmbunătățit eficacitatea radioterapiei inducând o apoptoză mai pronunțată a celulelor cancerului de sân decât radioterapia singură (7). Cu toate acestea, la om, RC necesită menținerea unor provocări mari de conformitate pentru o perioadă terapeutică adecvată. Din aceste motive, perioadele scurte de post fără malnutriție au fost propuse ca intervenții potențial sigure care trebuie asociate cu tratamentele împotriva cancerului (8).
Modulația nutrienților în celulele canceroase proliferante/rezistente: o vedere moleculară
Nivelurile reduse de substanțe nutritive și factorii de creștere observați în timpul postului au condus la ipoteza rolului lor obligatoriu în guvernarea răspunsurilor la stres diferențial în celulele normale și canceroase (10, 14, 16, 18). Răspunsurile diferite ale celulelor normale și canceroase la post aruncă lumină asupra sensibilității lor diferite la nutrienți și la factorii de creștere (18).
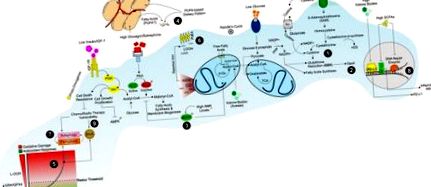
Semnalizarea IGF-1/IGF-1R este puternic dependentă de disponibilitatea nutrienților și implică intensificarea proliferării celulelor canceroase, prin efectele directe asupra semnalizării PI3K/Akt și rezistența la moarte celulară impusă de chimioterapie și radioterapie (Figura (Figura 1) 1) ( 32). Într-adevăr, postul reduce nivelurile circulante de IGF-1 și acest eveniment protejează șoarecii deficienți în producția hepatică de IGF-1 împotriva medicamentelor pentru chimioterapie (16). În consecință, restaurarea IGF-1 a fost suficientă pentru a inversa efectul protector al postului (16). Reducerea IGF-1 protejează glia primară, dar nu celulele gliomului, împotriva ciclofosfamidei și a fibroblastelor embrionare de șoarece împotriva doxorubicinei (16). În mod opus, suplimentarea cu IGF-1 în celulele canceroase de sân înfometate a inversat sensibilizarea medicamentului. În ansamblu, aceste constatări indică cu tărie că sensibilizarea mediului post-mediat al celulelor canceroase la medicamentele chimioterapeutice este conferită de scăderea nivelurilor IGF-1 (15).
Strategie dietetică pentru promovarea unui metabolism ostil în celulele canceroase proliferante/rezistente. Modelele dietetice sărace în proteine, amidon și zaharuri promovează un mediu sărac în aminoacizi de sulf (adică, metionină, cisteină), glucoză și factori de creștere (insulină/IGF-1) care ar putea limita producția de NADPH/GSH (1) și GPX4 activitate (2). Nivelurile reduse de glucoză și raportul glucagon/insulină opresc sinteza lipidelor și pornesc căile de oxidare a lipidelor conduse de AMPK în celulele canceroase proliferante (3). În astfel de condiții metabolice, celulele canceroase își acumulează membranele prin utilizarea acizilor grași extracelulari derivați din dietă și/sau de țesut adipos alb (4). Activarea concomitentă a metabolismului OxPHOS și reducerea nivelurilor GSH sunt cauzatoare de stres oxidativ (5) culminând cu o peroxidare masivă a lipidelor (LOOH) (6) și feroptoză în celulele canceroase (7). Dieta săracă în amidon, zaharuri și proteine, dar bogată în acizi grași, crește, de asemenea, corpurile cetonice și modulează caracteristicile microbiotei intestinale prin producerea acizilor grași cu lanț scurt (SCFA). Corpurile cetonice și SCFA afectează PD-L1, factorul nuclear kb și transcripția genelor enzimelor de reparare a ADN-ului (8) promovând vulnerabilitatea chimio/radioterapică a celulelor canceroase (9).
Mecanismele prin care KD acționează ca adjuvanți în terapia cancerului par, de asemenea, să fie asociate cu stresul oxidativ crescut în celulele canceroase (24). Într-adevăr, la KD, nivelul ridicat de acizi grași circulanți limitează disponibilitatea glucozei pentru glicoliză (ciclul Randle) (38). Acest lucru reduce formarea piruvatului și glucozei-6-fosfatului și, la rândul său, sinteza NADPH prin calea pentozei fosfat (PPP) (39). NADPH este necesar pentru tamponarea producției de hidroperoxizi (LOOH) prin intermediul sistemului glutation/glutation peroxidază (GSH/GPX) dependent de NADPH (40, 41). Ca o consecință, o creștere a LOOH este probabil provocată (24) (Figura (Figura 1). 1). În consecință, pacienții diabetici hipercetotici au un nivel mai ridicat de peroxidare a lipidelor în membranele eritrocitelor și o scădere semnificativă a nivelurilor celulare de GSH decât pacienții diabetici ketonici normali (42). Tratamentele cu acetoacetat de cetonă au ridicat nivelurile de peroxidare a lipidelor în celulele endoteliale umane inhibând proliferarea acestora (42). Aceste dovezi sugerează un rol direct al organismelor cetonice în afectarea directă a nivelurilor GSH.
Angajamentul mediate de nutrienți față de feroptoză în celulele canceroase
Prin conservarea nivelurilor de NADPH, celulele canceroase susțin activitatea GPX/GSH în timpul limitării nutrienților, iar acest lucru poate conferi rezistență la chimioterapice pe bază de redox (61-63). Într-adevăr, multe celule canceroase rebele folosesc un truc comun pentru a se sustrage anihilării; intră în ceea ce este cunoscut sub numele de stare mezenchimală, care este o tranziție „epitelial-mezenchimală”, care asigură rezistența celulelor canceroase la regimurile terapeutice convenționale (64). S-a demonstrat că celulele canceroase mezenchimale rezistente la terapie se bazează strict pe GPX4 dependent de seleniu pentru supraviețuire (65). Prin utilizarea puterii de reducere a GSH, GPX4 transformă L-OOH potențial toxic în alcooli lipidici netoxici (L-OH) (Figura (Figura 1) 1) (66-68). În consecință, inactivarea GPX4 prin epuizarea GSH cu erastin sau cu un inhibitor direct GPX4 are ca rezultat în final peroxidarea lipidelor în celulele canceroase (69). Prin urmare, este provocator să ipotezăm că presiunea evolutivă pentru menținerea proteinei de seleniu GPX4 s-ar putea corela cu cerința unui organism pentru un conținut crescut de PUFA, ceea ce, la rândul său, face posibile activități biologice complexe (70).
Strategii dietetice pentru a stimula răspunsurile imunometabolice în terapia cancerului
Postul pe termen scurt are un efect benefic asupra imunosupravegherii cancerului (100). În special, Pietrocola și colegii săi au demonstrat că medicamentele care postesc sau imită CR, induc epuizarea celulelor T reglatoare (care diminuează imunitatea anticancerigenă), aprinzând astfel fluxul autofagic în modelele murine de cancer pulmonar indus de KRAS. În consecință, efectul inhibitor al postului asupra creșterii tumorii se pierde în cazurile de cancer care au devenit carente de autofagie (100). Recent, de asemenea, s-a demonstrat că dieta isocalorică cu restricție de proteine induce UPR dependent de IRE1α în celulele canceroase, îmbunătățind răspunsul mediat al celulelor T CD8 + citotoxice (un tip de limfocit T efector) împotriva tumorilor (101).
Similar cu ceea ce s-a observat cu postul prelungit (102), ciclurile unei diete care mimează postul (FMD) sunt eficiente în creșterea proliferării celulelor hematopoietice și promovarea regenerării și modularii sistemului imunitar (103). Foarte important, febra aftoasă are un efect stimulator asupra celulelor progenitoare limfoide comune și a citotoxicității CD8 + dependente de celulele T asupra cancerului de sân și a celulelor melanomului (Figura (Figura 2) 2) (17, 102). Prezența celulelor T citotoxice CD8 + în mediul tumoral [limfocite infiltrante tumorale (TIL)] este considerată un rezultat pozitiv al tratamentului pentru cancer (104, 105).
Manipularea nutrienților pentru a stimula fenotipul imunometabolic al limfocitelor infiltrante tumorale CD8 + (TIL). Celulele T CD8 + naive recunosc antigenul celulelor canceroase feroptotice pe MHC de clasa I pe celulele dendritice, devenind astfel celule T CD8 + citotoxice mature (1). După o dietă prelungită a postului sau a imitării postului (FMD), poate apărea o rată de regenerare hematopoietică îmbunătățită (2) și îmbogățirea celulelor progenitoare limfoide comune (CLP) (3). Imunoterapia in vitro cu celule T adoptive (ACI) (4) și modificările in vivo ale nutrienților (5) resetează metabolismul CD8 + TIL către căile oxidative mitocondriale, limitând astfel concurența substratului cu celulele canceroase și îmbunătățind imunosupravegherea mediată de CD8 + TIL. Strategiile dietetice care promovează modificările funcționale ale microbiotei intestinale (de exemplu, îmbogățirea Akkermansia muciniphila) (6) ar putea îmbunătăți eficacitatea inhibitorilor punctului de control imun (anti PD1/PD-L1) (7).
Celulele T CD8 + sunt influențate de nutrienți și alte semnale de susținere care sunt disponibile în general în mediul lor. În general, celulele tumorale inactivează celulele CD8 + T. Suprimarea fosforilării oxidative și un flux glicolitic suprareglatat de celule canceroase proliferante creează un microambient imunosupresor (106). Într-adevăr, CD8 + TIL dependent de glucoză ar putea suferi un dezavantaj competitiv pentru nutrienți, iar acest lucru le-ar afecta negativ funcția imunitară. Mediul metabolic imunosupresor ar putea fi îmbunătățit și mai mult prin expresia tumorală a liganzilor inhibitori pentru receptorul programat de moarte 1 (PD-1) care, atunci când este legat de receptorii lor înruditi de pe celulele T, limitează absorbția de glucoză intrinsecă a celulelor T și glicoliza (107, 108) . S-a raportat că KD reduce semnificativ expresia ligandului inhibitor PD-1 (PD-L1) pe CD8 + TIL (109). În plus, șoarecii hrăniți cu KD au o expresie redusă a PD-L1 pe celulele canceroase care inhibă în mod notoriu activitatea celulelor T CD8 + (109). Acest lucru sugerează că KD poate modifica supresia celulelor T mediată de tumori prin reducerea numărului de celule susceptibile la inhibare prin calea inhibitoare a PD-1 (Figura (Figura2 2).
Acum apare că răspunsul CD8 + TIL la blocarea punctului de control imun inhibitor PD1 poate fi, de asemenea, modulat de microbiota intestinală (118-120). O lucrare foarte recentă a arătat că microbiota fecală de la pacienții afectați de melanom metastatic și care răspund la terapia anti-PD1 prezintă abundență crescută de Akkermansia muciniphila. A. introducerea muciniphila la șoareci care au primit transplant de microbiotă fecală nonresponder umană a îmbunătățit infiltrarea și activitatea celulelor T CD8 + imune antitumorale și a crescut eficacitatea terapiei anti-PD1 (120, 121). O altă observație interesantă este că Faecalibacterium și Bifidobacterium sunt asociate cu răspunsuri antiinflamatorii, un braț reglator al sistemului imunitar care are ca scop prevenirea supraactivării răspunsului imun și restabilește homeostazia gazdei (120). Având în vedere că schimbările în metabolismul gazdei și microbiota pot apărea în tandem, s-a emis ipoteza că diversitatea și compoziția microbiană intestinală sunt predictori ai răspunsului la terapia cancerului (121) (Figura (Figura 2). 2). În consecință, șoarecii fără germeni implantați cu celule tumorale umane și transplantați cu fecale de la respondenții la chimioterapie au prezentat un răspuns ameliorat la chimioterapie decât șoarecii colonizați cu microbiota de la pacienții care nu au răspuns (119).
Concluzie și perspectivă
În ciuda progreselor recente realizate în terapia cancerului, prognosticul pentru mulți pacienți cu cancer rămâne slab, iar tratamentele actuale încă prezintă evenimente adverse severe. Astfel, este urgentă găsirea de tratamente complementare care au o toxicitate limitată pentru pacienți și care îmbunătățesc simultan răspunsurile la terapie în cancer față de celulele normale. Dieta are o capacitate puternică de a modula răspunsurile celulare la stimulii de mediu și prezintă un potențial mare în îmbunătățirea prognosticului cancerului. Mecanismele prin care substanțele nutritive dietetice sporesc efectele anticancerigene ale terapiilor anticanceroase standard (chimioterapie, radioterapie, imunoterapie) nu au fost încă pe deplin elucidate. Studiile preclinice au demonstrat siguranța și eficacitatea intervențiilor dietetice specifice în contracararea progresiei tumorii în timpul terapiei anticanceroase la modelele murine. Cu toate acestea, majoritatea datelor prezente în literatură profită de utilizarea șoarecilor și acest lucru poate limita traducerea la cercetarea clinică. Prin urmare, acum este necesară o cantitate uriașă de muncă pentru a confirma aceste rezultate foarte promițătoare la oameni.
Privarea de nutrienți (de exemplu, glucoză, aminoacizi de sulf), precum și a factorilor de creștere sensibili la nutrienți (de exemplu, IGF-1) pare să distrugă selectiv celulele canceroase cu proliferare/rezistență ridicată prin forțarea activului lor glicolitic către un metabolism oxidativ (de exemplu, acizi grași și corpuri cetonice ca surse de energie) și limitarea activității GPX ca o consecință a nivelurilor reduse de GSH. Deficitul de nutrienți îmbunătățește, de asemenea, imunometabolismul, sporind eficiența citotoxică a CD8 + TIL în masa tumorii, probabil, prin microbiota intestinală concomitentă și rearanjări imunometabolice (Figura 3 3).
Îmbunătățirea metaboliților și a profilului anticancerigen imunologic prin k-PBD. Dovezile provenite din dieta prelungită a postului, dieta care mimează postul (FMD) și dieta ketogenică au demonstrat o utilitate puternică ca adjuvanți în terapia cancerului (1). În acest număr, propunem o dietă moderată ketogenică pe bază de plante (k-PBD), săracă în carbohidrați (amidon și zaharuri în special) și proteine animale (sărace în aminoacizi cu sulf și seleniu), dar bogată în grăsimi [în principal în polinesaturați vegetali acizi grași (PUFA)] (2), care ar putea modula puternic metaboliții circulanți (3), factorii imunologici (4) și activul microbiotei intestinale (5) care, în general, creează un mediu ostil celulelor canceroase.
Răspunsurile fenotipice ale cancerului hipotetic la k-PBD. Pentru studiile de intervenție dietetică umană, k-PBD (timp de 4 zile consecutive; 5 porții în fiecare zi) ar trebui să furnizeze aproximativ 1.100 kcal/matriță cu 5% din calorii din proteinele vegetale, 25% din carbohidrați (legume fără amidon) și 70 % din uleiuri vegetale neprelucrate (1). k-PBD propus pentru modelele de cancer murin trebuie redus în calorii totale (reducere cu 40% față de dieta ad libitum), să furnizeze 7% calorii din proteine vegetale, 45% din carbohidrați cu conținut scăzut de amidon, 48% în uleiuri vegetale (2). Modelul dietetic propus trebuie început înainte de terapiile convenționale împotriva cancerului (3).
Contribuțiile autorului
DL-B a conceptualizat și a scris manuscrisul. KA a efectuat o revizuire critică a manuscrisului pentru conținutul intelectual.
Declarație privind conflictul de interese
Autorii declară că cercetarea a fost efectuată în absența oricărei relații comerciale sau financiare care ar putea fi interpretată ca un potențial conflict de interese.
- Obezitatea crește semnificativ efectele secundare ale radioterapiei stereotactice a corpului în cancerul pulmonar
- Aplicații potențiale pentru liganzii receptorilor sigma în diagnosticul și terapia cancerului - ScienceDirect
- Amenoree primară datorată sindromului ovarian polichistic (SOP) - Consilier pentru tratamentul cancerului
- Efectele secundare ale tratamentului de substituție a enzimelor pancreatice pentru cancerul pancreatic - pancreatic
- Otita medie - Consilier pentru tratamentul cancerului